液態發酵原位酶解糖化水稻秸稈工藝優化
文曉霞,白光劍,李韜,馬一凡,鄒偉*
1(四川輕化工大學 生物工程學院,四川 宜賓,644005)2(濃香型白酒資源微生物與大數據實驗室,四川 宜賓,644005)
水稻秸稈是世界三大農作物秸稈之一,主要成分是木質纖維素,占比接近50%[1-2],擁有巨大的潛在價值。酶解糖化秸稈用于發酵工業生產已成為世界各國重點研發的熱點之一。眾多研究表明,纖維素酶的產酶條件和酶的作用條件不在一個范圍內,因此發酵和產酶不能最大化進行一直是一個困擾木質纖維素資源化利用的難題。為了解決這個問題,工業上最常用的方法是纖維素酶直接糖化[3],但是糖化成本很高;其次是同步發酵糖化[4],其受制于微生物的限制,發酵產物單一,而且不能得到應用范圍更廣的可發酵糖。然而采用原位酶解方式可以有效解決這些問題[5],能更好的酶解纖維素產可發酵性糖,是實現纖維素資源有效利用的最新手段,受到廣泛關注。
高效且低成本的降解技術是實現資源化利用水稻秸稈必需解決的難題。國內外已先后建成了多套纖維素生物轉化試驗裝置,但由于技術積累不夠,生產成本過高,無法真正實現工業化[3,6]。造成木質纖維素降解成本過高的主要技術瓶頸是水解過程的纖維素酶用量較高,酶解效率有待改進[7]。相關研究表明,液態原位酶解工藝可以降低天然木質纖維素糖化對預處理的要求,同時提高酶解效率與糖化率,克服直接發酵法中還原糖積累少的缺點[8]。原位酶解工藝在各研究領域都有所涉獵,且纖維素原位酶解已廣泛應用于離子液體中,如MESBAH等[9]結合離子液體和纖維素酶En5H處理稻草,纖維素轉化率提高28%。李強等[10]利用合成的離子液體[Meim]DMP原位酶解秸稈,結合秸稈預處理,最后酶解轉化率提高了2.4倍。目前為止,國內外關于利用微生物發酵原位酶解糖化秸稈報道較少,水稻秸稈更是鮮有研究,近年來逐漸成為研究的一大熱點。
發酵產酶和酶解在同一地點或容器內被稱為原位酶解[10-11]。本研究以水稻秸稈為底物,里氏木霉為產酶微生物,通過研究液態發酵原位酶解糖化水稻秸稈,對發酵過程和酶解過程協同控制條件進行優化,從而提高水稻秸稈的糖化率。為天然木質纖維素的高效糖化研究提供一定參考。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
實驗菌種:里氏木霉CICC 41027,中國工業微生物菌種保藏管理中心。
水稻秸稈段:采用預處理后的水稻秸稈段[12]。
粗酶液:實驗前期產酶優化培養基培養的發酵液,離心取上清液為粗酶液,備用。
1.1.2 試劑及藥品
無水葡萄糖、NaOH、Ca(OH)2、鹽酸、亞硫酸鈉、尿素、硫酸、一水檸檬酸、檸檬酸三鈉、3,5-二硝基水楊酸、亞硝酸鈉、苯酚、酒石酸鉀鈉、羧甲基纖維素鈉等(分析純),成都市科龍化工試劑廠。
檸檬酸緩沖液(0.05 mol/L,pH 4.8):取一水檸檬酸4.83 g,溶解于約750 mL去離子水中,邊攪拌邊加入檸檬酸三鈉7.94 g,定容至1 000 mL,調節pH值至4.8后4 ℃儲存備用。
10 g/L羧甲基纖維素鈉溶液(carboxymethylcellulose sodium,CMC-Na):取1 g CMC-Na溶解于100 mL pH 4.8的檸檬酸緩沖液中,保存時間不超過3 d。
3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)試劑:稱取DNS 3.15 g,加適量水45 ℃水浴攪拌溶解,然后再加入20 g NaOH溶液攪拌溶解,再依次加入酒石酸鉀鈉91 g、亞硝酸鈉2.5 g、苯酚2.5 g,加熱攪拌溶解后定容至1 000 mL,用濾紙過濾后,裝入棕色瓶黑暗處放置7 d后可使用。
1.2 儀器與設備
QYC-2102搖床,上海滬奧明科學儀器有限公司;MJ-250恒溫培養箱、TG-16醫用離心機,四川蜀科儀器有限公司;V-1000可見分光光度計,翱藝儀器有限公司;HH-6D數顯恒水浴鍋,常州普天儀器制造有限公司;Whatman1號濾紙、抗腐蝕的濾袋。
1.3 培養基的制備
糖化培養基1(初始):水稻秸稈20 g、(NH4)2SO42 g、KH2PO43 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐溫-80 0.5 mL、H2O 1 000 mL、pH 6。
糖化培養基2:水稻秸稈30 g、(NH4)2SO42 g、KH2PO43 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐溫-80 0.5 mL、H2O 1 000 mL、pH 6。
微量元素液:CoCl2·6H2O 2 mg、MnSO4·H2O 2 mg、ZnSO4·7H2O 3.45 mg、FeSO4·7H2O 4 mg、H2O 1 000 mL。
CMC-Na種子培養基:CMC-Na 10 g、蛋白胨3 g、KH2PO41 g、MgSO4·7H2O 0.5 g、葡萄糖0.5 g、H2O 1 000 mL、pH自然。
發酵產酶培養基(優化后):預處理水稻秸稈15 g、(NH4)2SO42 g、MgSO4·7H2O0.5 g、KH2PO43 g、吐溫-80 0.5 mL、FeSO4·7H2O 0.002 g、微量元素液10 mL、H2O 1000 mL、pH6~6.5(自然)。
1.4 實驗方法
1.4.1 液態發酵原位酶解糖化工藝
液態發酵原位酶解糖化工藝如下:
秸稈培養基→接種→發酵產酶及破壞秸稈結構→調節pH→升溫酶解→取樣測還原糖
配制糖化培養基1,121 ℃滅菌,接種5%(體積分數)種子液,搖床恒溫(26~32 ℃)培養一定時間,取出,用NaOH和稀鹽酸溶液調節pH值,置于培養箱中恒溫(40~60 ℃)一段時間,取樣,6 000 r/min離心5 min,用DNS法測發酵液中的還原糖[13]。
秸稈比產糖量(g/g):單位秸稈產生的還原糖量,根據每瓶發酵液中的總還原糖和秸稈的添加量,算出每克秸稈最終的糖化率[12]。
1.4.2 液態發酵原位酶解過程隨時間變化趨勢
秸稈糖化培養基1,250 mL錐形瓶裝液100 mL,初始pH 6,29 ℃,150 r/min,接種量5%,從發酵第2天開始每天取2瓶,取樣測發酵液中的還原糖和濾紙酶活力(fliter paper actioity,FPA)酶活,然后將錐形瓶中剩余發酵液置于55 ℃搖床中保溫6 h后,再次測發酵液中的還原糖和FPA及pH值。
1.4.3 酶解階段條件控制
1.4.3.1 酶解階段pH控制對產糖的影響
配制糖化培養基1,250 mL錐形瓶裝100 mL若干瓶,初始pH 6,種子液接種量5%,150 r/min,29 ℃恒溫培養,發酵48 h后,發酵液的pH值在3~3.5,用NaOH和鹽酸溶液調節不同初始酶解pH值(3.2、3.6、4.0、4.4、4.8、5.2),將錐形瓶靜置于50 ℃的培養箱中,酶解24 h,取樣,6 000 r/min離心5 min,測還原糖,比較初始酶解pH對產糖的影響。
1.4.3.2 酶解階段溫度控制對產糖的影響
發酵條件不變,發酵48 h后,調節初始酶解pH 4.8,然后將錐形瓶置于不同溫度(40、45、50、55、60、65 ℃)的培養箱中酶解24 h,分別在6、12、24 h取樣,測還原糖。
1.4.3.3 酶解時間對產糖的影響
發酵條件不變,發酵48 h后,調節初始酶解pH 4.8,酶解溫度50 ℃,不同酶解時間取樣(0、2、6、12、24、36、48、72、84 h),測還原糖。
1.4.4 發酵培養基的優化
1.4.4.1 水稻秸稈的最佳添加量
原位酶解法糖化水稻秸稈,基礎培養基中每升培養基中秸稈的裝載量為20 g,實驗通過不同的水稻秸稈添加量(10、20、30、40、50 g/L),比較每升培養基總還原糖產量和每克秸稈產糖量,確定較優的秸稈載量。
1.4.4.2 氮源的選擇
在水稻秸稈30 g/L的基礎上,選擇不同的氮源2 g/L,其他條件相同,選擇對于原位酶解法產糖的較優氮源。
1.4.5 發酵階段的條件控制
1.4.5.1 發酵溫度的優化
在確定發酵培養基為:水稻秸稈30 g、(NH4)2SO42 g、KH2PO43 g、MgSO4·7H2O 0.5 g、微量元素液10 mL、吐溫-800.5 mL、H2O1 000 mL的情況下探究發酵溫度對產糖的影響。設置發酵階段的溫度為24、26、28、29、30、32 ℃。
1.4.5.2 發酵pH的優化
在上述實驗基礎上探究發酵初始pH值對產糖的影響,設置初始pH值分別為4、5、6、6.5、7。
1.4.5.3 發酵時間的優化
在上述實驗基礎上探究發酵時間對產糖的影響,設置不同的發酵時間為24、36、48、60、72、84 h。
1.4.6 原位酶解補加酶液對糖化的影響
由于液態原位酶解糖化工藝中發酵階段只有48 h,還未達到產纖維素酶高峰期,探究在進入酶解階段前補加粗酶液(由實驗前期得到的發酵產酶優化培養基培養的發酵液離心獲得)能否進一步提升秸稈糖化的比產糖量。分別添加產酶優化后的粗酶液0、2.5、5、7.5、10 mL,測最終的比產糖量。
1.4.7 數據處理
每個樣品固態發酵均做3次平行試驗,采用Excel對試驗數據初步處理,再用Design Expert 8.0處理數據,Origin 8.5作圖,試驗結果以“平均值±標準差”表示。數據采用ANOVA進行Duncan差異分析,以P<0.05為差異顯著。
2 結果與分析
2.1 原位酶解產糖隨發酵時間變化趨勢
通過對發酵過程、酶解過程中還原糖、FPA、pH過程檢測,了解發酵、酶解過程隨時間的變化情況,對原位酶解發酵法糖化工藝進行初步探索。由圖1和表1可知,首先在2~6 d時發酵液中本身的還原糖濃度很低,還原糖濃度最高時為發酵第2天,約為1.414 mg/mL。纖維素酶活隨發酵時間的延長逐步增加,最高為第6天,約0.706 IU/mL,這與纖維素產酶的特點是相符的。通過對發酵液進行升溫酶解,6 h后測其中的還原糖,發現發酵2~4 d的發酵液通過升溫酶解后,還原糖含量明顯增加,其中第2天發酵液中的還原糖含量由1.414 mg/mL上升至4.2 mg/mL,是未酶解前的3倍,而5~6 d酶解后還原糖變化不大。酶解6 h后相比于酶解前發酵液中的酶活都有所下降,特別是4~6 d。由表1可知,發酵液中的pH值隨發酵時間降低,在發酵第6天僅有2.04。
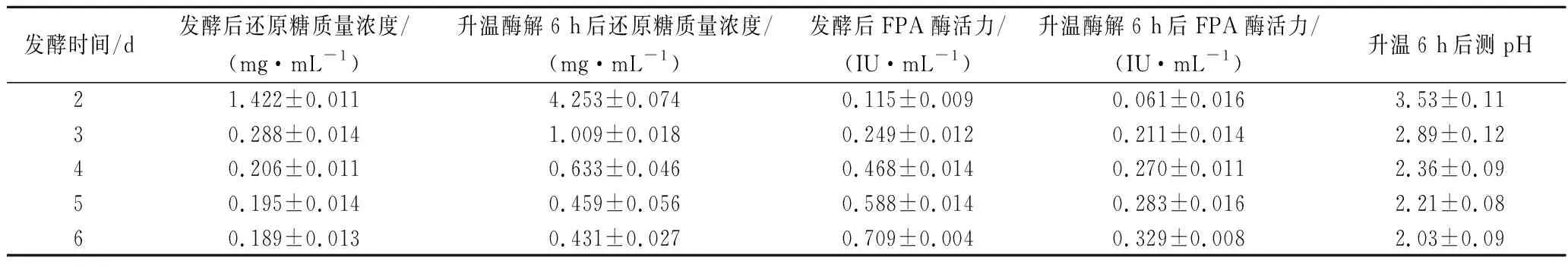
表1 原位酶解產糖過程中各參數隨發酵時間的變化Table 1 Changes of various parameters with fermentation time during in situ enzymatic hydrolysis)
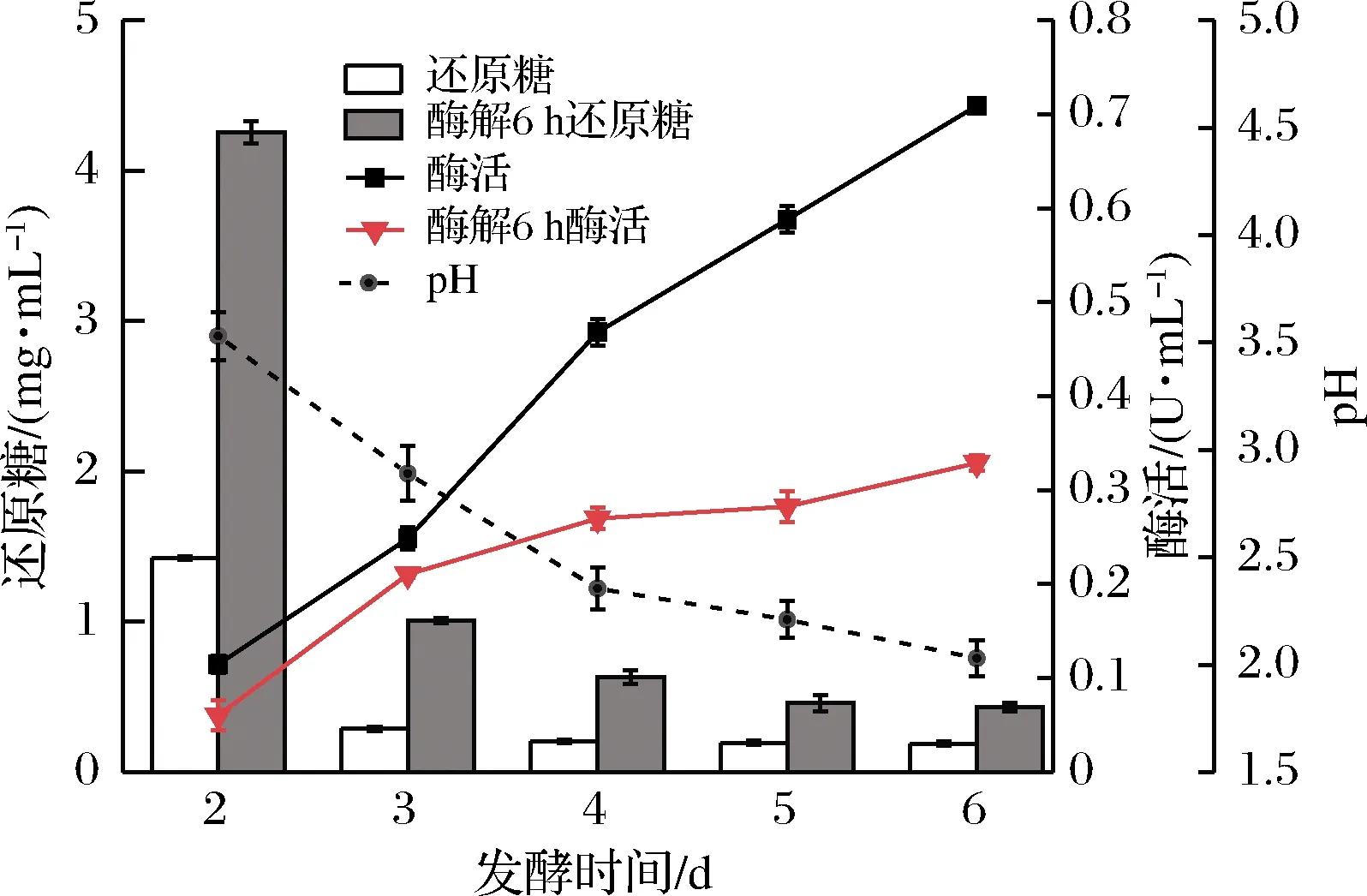
圖1 不同發酵時間保溫前后還原糖和酶活變化Fig.1 Changes of reducing sugar and enzyme activity before and after holding at different fermentation time

根據研究和預實驗發現,就整個過程而言,酶解條件控制對秸稈的糖化影響大于發酵過程,因此先將影響大的條件確定下來,再優化影響較小的,這樣整個實驗過程中的理論誤差最小。同時發酵過程有前期實驗做的產酶條件優化作參考,有一定指導意義,因此接下來實驗將先研究不同的酶解條件對于水稻秸稈糖化的影響,后研究不同的發酵產酶條件對于糖化的影響。
2.2 酶解階段的條件控制
pH是影響纖維素酶活的重要因素,對于糖化效率有很大的影響。將發酵48 h后的發酵液分別調節pH 3.2、3.6、4.0、4.4、4.8、5.2,然后升溫50 ℃酶解24 h。如圖2-a所示,每克秸稈的還原糖產量先隨pH升高而增加然后減小,在pH=4.8時取得最大值,約0.406 g/g,同時pH 4.4時和pH 4.8相差不大,約0.396 g/g。最終選擇pH 4.8為酶解階段的最適pH。

圖2 不同酶解條件對產糖的影響Fig.2 Effect of different enzymatic hydrolysis conditions on sugar production注:不同大、小寫字母、希文字母表示差異顯著(P<0.05)(下同)
纖維素酶的最適合成溫度和最適酶解溫度不同,找到最適酶解溫度有助于提高糖化效率。結合已有的研究,同時考慮到高溫會對蛋白質的結構有影響,因此實驗設置為不同溫度下,不同時間的酶解產糖。如圖2-b,在酶解6 h時,產糖量最高的是溫度為60 ℃時,而50、55、65 ℃時處于同一水平。當酶解至12 h時,產糖量最高的是溫度為55 ℃時,依次為60、50 ℃。當酶解至24 h時,產糖量最高的是溫度為50 ℃時,依次為45、55 ℃。根據實驗結果可知,在短時間的酶解時,60 ℃和55 ℃的酶解效率更高,但隨著酶解時間延長,溫度對酶的損害作用逐漸體現出來,其綜合正向促進作用開始小于負向的損害作用。溫度40 ℃時酶的糖化效率不高。因此,若酶解時間超過24 h,應選擇酶解溫度為50 ℃或45 ℃,本研究選擇50 ℃作為酶解階段的發酵溫度。
酶的催化通常會有動力學方程,酶解效率會受酶解條件和環境的影響,隨著酶解過程的進行,底物減少、產物的反饋抑制、酶的損耗等都會影響到最終的產物,纖維素酶的酶解糖化過程也有這些現象。如圖2-c,酶解時間越短,曲線的斜率越大,單位時間的糖化效率越快。在酶解的前12 h,底物充足,酶的活性高,反饋抑制弱,糖化的速度快,在12 h時產糖量約為0.282 g/g;在酶解至24 h時約為0.410 g/g,12 h增加了0.118 g/g;在酶解至36 h時約為0.474 g/g,12 h增加了0.074 g/g;最終酶解至72 h時約為0.567 g/g。隨著酶解時間的延長,受制于發酵液中的底物和酶的限制,最終產糖量提升并不多。考慮到成本因素,暫選24 h作為后續研究的酶解時間。
2.3 發酵培養基的優化
2.3.1 水稻秸稈的最佳添加量
水稻秸稈段中有許多空隙和中空,平均體積大,密度小,且不溶于水,每升發酵液中的裝載量較少。在不壓實的狀態下,每升發酵液能裝40~50 g秸稈段,而且秸稈段裝載過多,發酵一段時間后發酵液會成糊狀,不利于發酵過程的進行。因此,通過比較每升發酵液中不同水稻秸稈段的添加量對單位秸稈的糖化率和每升發酵液中的總產糖量的影響,選擇出合適的秸稈添加量。如圖3所示,每克秸稈的產糖量隨秸稈的添加量增加而減少,每升發酵液中的總產糖量隨秸稈添加量增加而增加。根據原位酶解發酵產糖工藝,發酵階段主要是產酶和進一步打破秸稈為下一步酶解提供基礎,酶的產量與秸稈量在一定范圍內呈負相關,每升發酵液中秸稈含量少,更利于纖維素酶的誘導合成,同時在酶解階段單位質量秸稈會擁有更多的纖維素酶,而且發酵液中的總糖含量低,酶解的反饋抑制作用也會降低。因此,在一定范圍內,每升發酵液中含有的秸稈越少其單位質量的糖化率反而更高。但是每升發酵液秸稈添加少,其總的產糖也必然少,即便糖化率高其研究價值也不大,在實際應用中需要平衡單位秸稈糖化率和每升發酵液中總產糖量的關系。要想得到客觀可靠的結果,必須對整個生產過程的成本進行估算,建立一個成本模型和函數關系,最后才能得出最適的添加量,這其中涉及的問題較多且復雜。在30~35 g/L的秸稈添加量時,單位秸稈糖化率和每升發酵液的總糖量都能保持在一定水平,因此在缺少相關的數據和信息前,本研究只能簡單的暫選30 g/L作為每升發酵液的秸稈添加量。
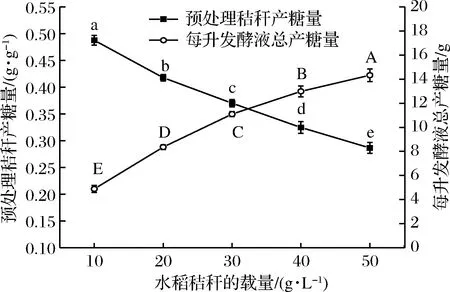
圖3 秸稈的添加量對產糖的影響Fig.3 Effect of added amount of straw on sugar production
2.3.2 氮源的選擇和氮源含量
在微生物發酵過程中添加氮源主要是為了補充生長繁殖所必需的氮元素。如圖4所示,以蛋白胨為氮源糖化率最高,為0.355 g/g,硫酸銨氮源的糖化率其次,為0.336 g/g,硝酸銨和麩皮糖化率分別為0.277、0.233 g/g,以尿素為氮源的糖化率最低,僅0.030 g/g。蛋白胨和硫酸銨都是里氏木霉的優質氮源,但考慮到蛋白胨和硫酸銨的成本差異,仍選擇硫酸銨為原位發酵酶解法糖化工藝的氮源。
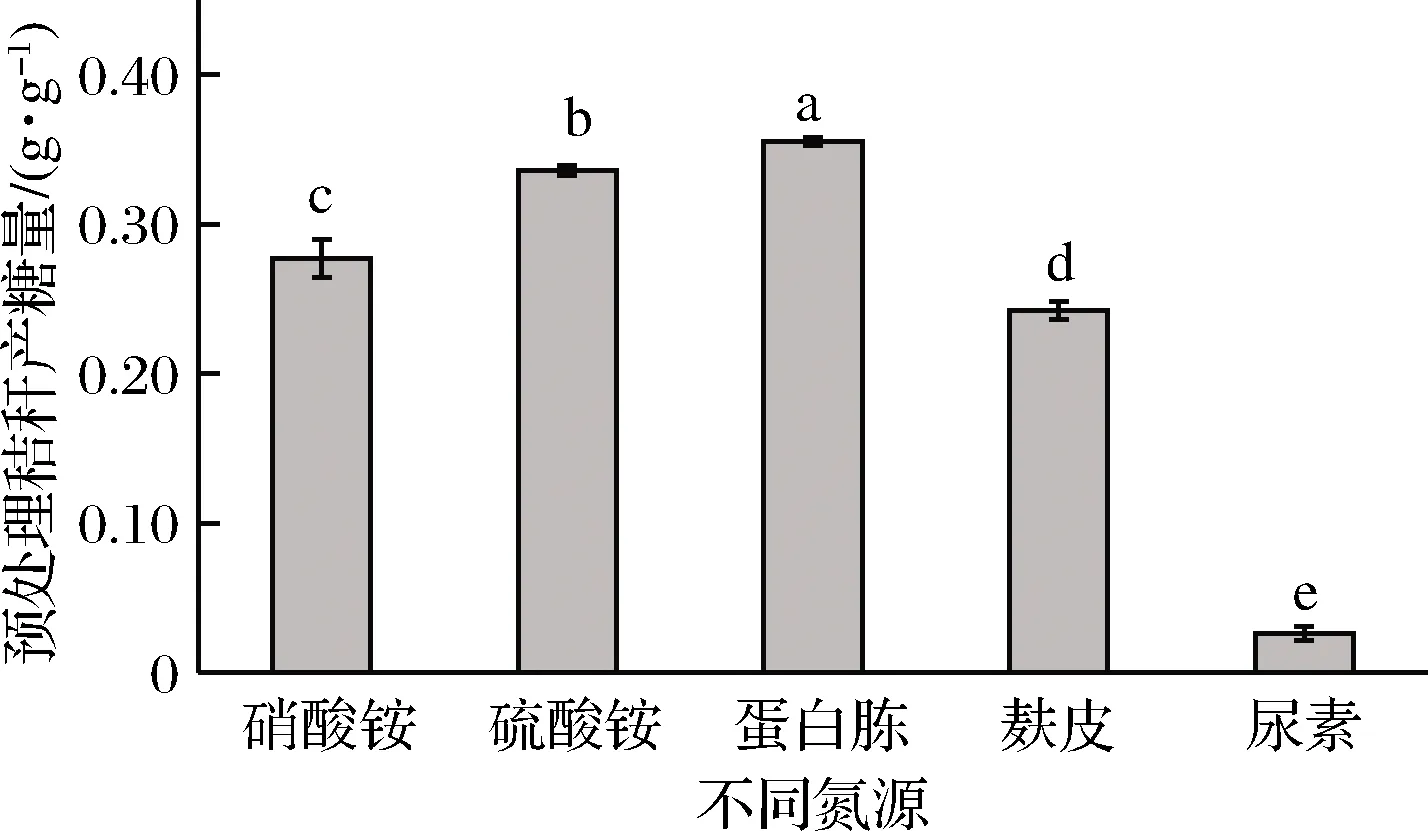
圖4 不同氮源對產糖的影響Fig.4 Effect of nitrogen source on sugar production
2.4 發酵階段的條件控制
發酵階段的主要目的是微生物的快速生長和產酶,溫度過高和過低都不利于微生物的生長代謝。如圖5-a所示,發酵階段的溫度在30 ℃時,最終的產糖量更高。但是根據鄔敏辰等[16]的研究,在里氏木霉發酵產酶的溫度優化中,先將發酵液在29 ℃的溫度下發酵1~2 d,再降低到28 ℃發酵,最終發酵酶活更高。他認為溫度高一點更有利于前期發酵微生物的生長繁殖,本研究的結果與其有相似之處。最終選擇30 ℃作為發酵產酶階段的發酵溫度。
發酵階段的pH對微生物的生長繁殖和代謝有重要影響。如圖5-b所示,在原位酶解發酵法糖化中pH 6.5時有最大產糖量,但在pH 5時產糖量排在第2,初始pH 6、7分別排在第3和第5。由表1可知,在持續的產酶發酵過程中,發酵液的pH會隨著時間降低,在發酵第3~6天時pH值已經低于3了,pH過低會對微生物的生長代謝帶來不利影響,因此高初始pH可以減緩pH減低的速度,但同時pH過高不利于微生物前期的生長繁殖。由于發酵時間為2 d,發酵液中pH降低不明顯,最終表現為初始pH 4~6.5對產糖量的影響并不大。可推測在里氏木霉的發酵產酶過程中,pH過高不利于微生物的生長和產酶。在一定范圍內,pH過低雖然同樣不利于微生物的生長,但對產酶有促進作用。由于剛配制的發酵液自然pH 6~7,且在初始pH 6.5時有最大產糖量,因此本研究選擇pH 6.5作為發酵液的初始pH值。
發酵時間是發酵產酶階段和酶解糖化階段的重要分界點,對最終產糖量影響很大,是原位酶解糖化工藝中的關鍵因素。發酵階段微生物快速生長,產纖維素酶對天然木質纖維素結構進行破壞;酶解階段為纖維素酶提供適宜的酶解條件使其充分酶解糖化。發酵時間過長,大量的底物被消耗,酶解階段可利用底物減少,秸稈的糖化率降低;發酵時間過短,微生物生長不足,產酶不足,秸稈破壞程度低,都會對酶解階段造成影響,使秸稈糖化不充分,糖化率低。如圖5-c所示,在發酵48 h時取得最大秸稈糖化率,約0.350 g/g。發酵24和36 h,發酵時間不足,糖化率低,超過48 h,微生物進一步生長代謝,底物消耗,糖化率降低。本研究選擇48 h作為發酵階段的發酵時間。
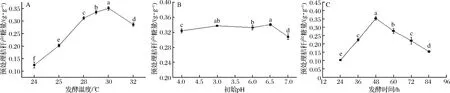
a-發酵溫度;b-初始pH;c-發酵時間圖5 不同發酵條件對產糖的影響Fig.5 Effect of different fermentation conditions on sugar production
2.5 原位酶解補加酶液對糖化的影響
在原位酶解發酵法糖化工藝中,發酵產酶階段的主要目的是發酵產酶和利用微生物對秸稈的結構進一步破壞,但是由于里氏木霉的產酶特性,在發酵前兩天并不是產酶最快的時間,發酵液中的纖維素酶含量并不高,通過外加少量粗酶液的方式,提高發酵液中的纖維素酶,進而提高比產糖量。研究表明,與商品酶相比,未加工的粗酶液有更高的酶解效率[17-18]。李勇昊[19]通過里氏木霉發酵產酶,將未經任何處理的纖維素粗酶液加入秸稈中進行酶解糖化,發現在50 ℃酶解溫度下,里氏木霉的存在不僅不會影響糖化效率,而且自身被裂解釋放出部分葡萄糖,提高了最終的糖濃度。如圖6所示,液態原位酶解糖化工藝中不補加酶液的比產糖量為0.332 g/g,隨著添加粗酶液其最終比產糖量有所提升,當每100 mL糖化液中粗酶液添加量超過5 mL時,其比產糖量在0.400 g/g附近不再顯著提升。因此可以選擇5 mL為較適的粗酶液添加量。
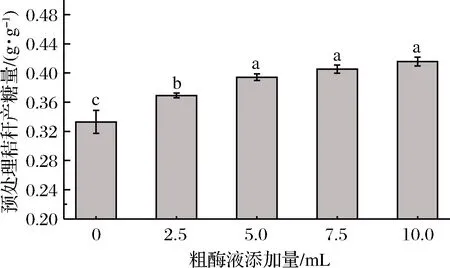
圖6 補加酶液對比產糖量的影響Fig.6 Effect of supplemented enzyme solution on sugar production
3 結論與討論
基于里氏木霉產酶特性和酶解特性的差異性矛盾,對將產酶過程和酶解過程整合起來的液態原位酶解糖化工藝進行了探索。發現水稻秸稈的原位酶解發酵糖化將面臨幾個問題:(1)發酵產酶和微生物破壞秸稈結構與底物消耗之間的平衡關系;(2)纖維素酶的酶活力不能充分發揮;(3)底物在產糖以外的消耗等。根據原位酶解產糖面臨的問題,實驗主要圍繞以下3個方向展開:
(1)首先,通過為酶解階段的纖維素酶提供適宜的酶解條件,充分激發酶的活力,從而減少單位秸稈對纖維素酶活的需求,提高糖化效率,進而縮短發酵時間,減少底物的無效消耗。
(2)通過優化改良發酵培養基成分,使其在發酵階段產酶效率提高的同時對酶解階段的負效應降低。
(3)通過優化發酵階段和糖化階段的條件控制,找到發酵產酶和微生物破壞秸稈結構與底物消耗之間的平衡,從而提高糖化工藝的綜合效能[20]。
實驗初步發現在發酵過程中發酵液中的還原性糖積累很少,僅能滿足微生物的生長所需,pH隨發酵時間降低,FPA隨發酵時間增加,在發酵2 d后通過升溫、調節pH的方式可以有效提高發酵液中的還原糖積累。對水稻秸稈的液態原位酶解糖化工藝進行優化,在液態產酶培養基的基礎上,確定了每升30 g秸稈的發酵培養基;發酵條件為發酵溫度30 ℃,初始pH 6.5,發酵時間48 h;酶解條件為酶解pH 4.8,酶解溫度50 ℃,酶解時間24 h,最終的比產糖量為0.350 g/g。同時發現發酵結束后補加少量酶液可以進一步提高比產糖量至0.400 g/g,約提升了20%。
目前鮮有關于分位原位酶解糖化工藝的研究報道。本研究主要探究了液態發酵原位酶解糖化工藝條件,以每克秸稈的產糖量為評價指標,得到較優的水稻原位酶解工藝。后續將繼續對其固態原位酶解糖化工藝進行優化,為進一步應用于木質纖維素的糖化和生物煉制提供更多的理論參考。

