水溶性蠶蛹蛋白功能特性探究
李丹丹,謝盛莉,馬良, ,侯勇,付余,張宇昊, *
1(西南大學 食品科學學院,重慶, 400715)2(西南大學 前沿交叉學科研究院,生物學研究中心,重慶, 400715)
蠶蛹(silkworm pupa,SP)是蠶蛾科家蠶蛾的蛹,屬于蠶繭抽絲后的副產物。蠶蛹蛋白是蠶蛹干基中的主要營養物質,據研究,1 kg鮮蛹中蛋白含量相當于0.85 kg瘦豬肉、0.96 kg雞蛋、1.09 kg鯽魚中蛋白含量[1],可作為一種優質昆蟲蛋白源。蠶蛹蛋白含有18種氨基酸,8種必需氨基酸含量約40%,符合聯合國糧農組織(Food and Agriculture Organization of the United Nations,FAO)和世界衛生組織(World Health Organization,WHO)聯合食品標準建議的理想氨基酸模式[2]。呂汶駿等[3]采用FMOC-OPA柱前衍生化高效液相色譜法測定蠶蛹蛋白水解液中的氨基酸,8種必需氨基酸含量達49.09%,高于FAO/WHO建議的40%;秦偉佳等[4]通過比較提取前后蠶蛹蛋白的氨基酸組成發現,蠶蛹蛋白氨基酸種類豐富,配比合理,符合保健類食品藥品要求,有著巨大的發展應用前景。
近年來,國內外研究主要集中在蠶蛹水溶性蛋白的提取、營養性等方面[5-7],劉娟[5]采用連續分級提取法從文冠果蛋白中得到清蛋白(水溶性)、球蛋白(鹽溶性)、醇溶蛋白和谷蛋白(堿溶性)。練釗[7]采用Osborn法從繅絲后蠶蛹中提取得到水溶性蛋白,并對其功能性質進行研究,結果表明蠶蛹中水溶性蛋白的氮溶性指數(nitrigen soluble index,NSI)為97.19%,具有良好的溶解性。謝盛莉等[8]研究表明,蠶蛹水溶性蛋白含量較高,過敏原含量極低,有直接開發蛋白產品或者用于食品添加的可能性。但關于蠶蛹水溶性蛋白的功能性質的研究,國內外鮮有報道。本實驗以鮮蠶蛹為原料,對蠶蛹水溶性蛋白的功能性質進行研究,為蠶蛹水溶性蛋白相關食品的開發應用提供理論依據。
1 材料與方法
1.1 材料與試劑
鮮蠶蛹,家蠶實驗品種“夏芳”,25 ℃,桑葉飼養,化蛹后第3天放置于-20 ℃凍存備用。
大豆油(九三牌),購于重慶市永輝超市,使用時不進行純化;鹽酸,重慶川東化工(集團)有限公司;NaCl,上海易恩化學技術有限公司;十二烷基硫酸鈉,美國Bio Basic公司;8-苯胺-1-萘磺酸,Sigma-Aldrich公司;30 g/100mL丙烯酰胺工作液(丙烯酰胺29 g,甲叉雙丙烯酰胺1 g)、樣品緩沖液(2X),北京索萊寶科技有限公司;1.5、1.0 mol/L Tris-HCl,賽國生物科技有限責任公司;過硫酸銨,廣東光華科技股份有限公司;蛋白Marker(10 kDa~200 kDa),Thermo Fisher公司;考馬斯亮藍R-250,百奧生物技術有限公司;甲醇,天津市科密歐化學試劑有限公司;冰乙酸,成都市科隆化學品有限公司。所有試劑均為分析純,所有水均為二次蒸餾水。
1.2 儀器與設備
DGG-9140A 電熱恒溫鼓風干燥箱,上海齊欣科學儀器有限公司;JA3003B電子天平,上海精天電子儀器有限公司;DW-3型數顯電動攪拌器,昆山市超聲儀器有限公司;HH-4數顯恒溫攪拌水浴鍋,上海新諾儀器設備有限公司;Multifuge X3R高速冷凍離心機,賽默飛世爾科技有限公司;F-380熒光分光光度計,港東科技;L8900全自動氨基酸分析儀,日本日立公司;DSC 4000差示掃描量熱儀,美國Perkin Elmer公司;MOS-500圓二色譜儀,法國Bio-Logic公司。
1.3 試驗方法
1.3.1 蠶蛹水溶性蛋白提取
鮮蠶蛹解凍,60 ℃干燥,粉碎,脫脂,純水為溶劑,提取分離,提取液調節pH至等電點,沉淀透析48 h 后冷凍干燥,得到蠶蛹水溶性蛋白。
1.3.2 蠶蛹蛋白性質測定
(1)氨基酸分析
參照GB 5009.124—2016 《食品中氨基酸的測定》[9]。
(2)溶解性測定
參照簡華君等[10]方法并做適當改動,用蒸餾水配制蛋白質量濃度分別為20、100、100 g/L的蛋白溶液,考察不同溫度(20~100 ℃)、pH(4.0~12.0)、NaCl濃度(0.2~1.2 mol/L)對溶解性的影響,攪拌溶解30 min,5 000 r/min 離心15 min,采用雙縮脲法測定上清液蛋白濃度。
(3)表面疏水性測定
采用8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)作熒光探針的方法測定[11]。用濃度分別是0.2~1.2 mol/L的NaCl配制0.1 mg/mL的蛋白溶液,并配制10 mmol/L的ANS溶液。取蛋白溶液2 mL,加入10 μL的10 mmol/L ANS溶液混合均勻,使用熒光分光光度計測定混合液的熒光強度(F1),同時測定未添加ANS溶液的蛋白樣品熒光強度(F0),設定參數情況為激發波長380 nm、發射波長490 nm。
(4)乳化性測定
參照PEARCE等[12]的方法,配制1 g/L的蛋白溶液,添加不同體積分數的大豆油,使油相體積分數分別為20%、25%、30%、35%、40%、45%、50%,10 000 r/min 均質1 min后立即從底部取50 μL乳化液,用1 g/L 十二烷基硫酸鈉溶液稀釋100倍后混勻,在500 nm 處測定吸光度,選擇乳化性能較好時的油相分數作為固定油相體積分數。
固定乳化性能較好時的油相體積分數,配制不同質量濃度的蛋白溶液(1.0~9.0 g/L)與大豆油混合,根據以上方法,同樣選擇乳化性能較好時的蛋白濃度作為固定蛋白濃度。
同時選擇乳化性能較好時的油相體積分數和蛋白濃度配制蛋白溶液,用0.1 mol/L HCI或NaOH溶液調整pH值為4.0~10.0,與大豆油混合后測定乳化性能,乳化活性和乳化穩定性計算如公式(1)、公式(2)所示。

(1)
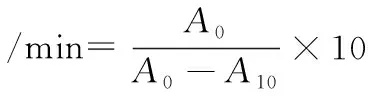
(2)
式中:DF,稀釋倍數;L,比色池光徑,cm;C,蛋白質量濃度,g/mL;φ,油的體積分數;A0,0 min時測得稀釋后的乳化液吸光值;A10,10 min時測得稀釋后的乳化液吸光值。
(5)起泡性測定
參照王青松等[13]的方法,配制不同質量濃度的蛋白溶液(1.0~9.0 g/L),分別取50 mL于100 mL的離心管中,高速渦旋振搖2 min后記錄體積為V0,放置15 min后的體積記為V1,起泡性及泡沫穩定性計算如公式(3)、公式(4)所示。

(3)
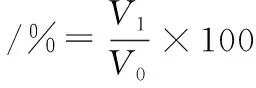
(4)
式中:V0、V1,泡沫體積,mL。
(6)持油性測定
參照王青松等[13]的方法,稱取0.5 g水溶性蛋白(m0)樣品,置于50 mL離心管中,稱重記錄為m1,分別將5~25 mL大豆油加入到離心管中,50 ℃振搖2 h,8 000 r/min離心10 min,除去上層油液后稱重記錄為m2,持油性計算如公式(5)所示。

(5)
式中:m0、m1、m2,質量,g。
(7)聚丙酰胺凝膠電泳分析
參照楊暉等[14]的方法,制備12%(體積分數)的分離膠,5%的濃縮膠,將不同熱處理后的蛋白溶液樣品與樣品緩沖液(2X)按2∶1比例混合,在沸水浴中加熱5 min,分別取10 μL蛋白Marker(10 kDa~200 kDa)和10 μL樣品注入上樣孔中,電泳初始時設置電流為15 mA,待溴酚藍跑到分離膠中部后,電流調至25 mA,當溴酚藍跑到底部綠色膠條下底端時,停止電泳,關閉電源,在培養皿中加入適量的考馬斯亮藍R-250染色1 h 后脫色,每30 min換一次脫色液,直至條帶清晰后用凝膠成像系統拍攝電泳圖譜后進行分析。
(8)差示掃描量熱法分析
取10 mg的蠶蛹水溶性蛋白固體樣品,置于專用鋁盒中壓片,以空鋁盒作對照,使用差示掃描量熱儀進行掃描,氮氣流速為20 mL/min,溫度掃描范圍為25~150 ℃,升溫速率為5 ℃/min。
(9)圓二色譜掃描
參照陳雪珂[15]的方法,測定條件:蛋白樣品質量濃度為1 mg/L,樣品槽光徑為0.1 cm, 在190~250 nm掃描,掃描速率1 nm/s,響應時間1 s,用緩沖液作為空白,累積次數3次。圖譜分析采用CDPRO軟件進行二級結構含量計算。
1.4 數據處理
每組數據均重復3次,用SPSS 19.0軟件對試驗數據進行顯著性和相關性分析,使用單因素方差分析(ANOVA)方法分析數據,P<0.05表示差異顯著,使用Origin 9.0軟件繪圖。
2 結果與分析
2.1 氨基酸分析
如表1所示,天冬氨酸與谷氨酸是蠶蛹水溶性蛋白氨基酸的主要成分,分別占7.09%、9.57%。蠶蛹水溶性蛋白氨基酸種類齊全,必需氨基酸含量占總氨基酸的含量的39%,蘇氨酸、纈氨酸、蛋氨酸、異亮氨酸、亮氨酸、苯丙氨酸與賴氨酸含量能滿足成人需求,其中賴氨酸含量為6.34 g/100g,蛋氨酸含量為2.42 g/100g,這2種氨基酸分別是谷物蛋白和大豆等油料作物蛋白的限制性氨基酸。因此,在日常膳食及產品開發時,可考慮將水溶性蠶蛹蛋白作為蛋白來源或與植物性蛋白復配的成分,補充賴氨酸和蛋氨酸的攝入。在非必需氨基酸中,谷氨酸(9.57 g/100g)含量最高,其次是天冬氨酸為7.09 g/100g、組氨酸為 5.90 g/100g、脯氨酸為6.61 g/100g。水溶性蠶蛹蛋白是一種營養價值較高的蛋白,這將有利于其在食品行業中應用。

表1 水溶性蛋白氨基酸組成Table 1 Amino acid analysis of water-soluble proteins
2.2 溶解性測定
2.2.1 溫度處理對溶解性及蛋白結構的影響
熱處理是食品加工過程中常見的加工方式,大部分蛋白在高溫熱處理會發生不可逆的熱變性,從而導致溶解度下降。如圖1-a所示,蛋白溶解度隨溫度升高呈先上升后下降趨勢,在50 ℃時,溶解度達到最大,之后開始緩慢下降,且溫度大于80 ℃之后顯著下降,結合圖1-b,在20~50 ℃,電泳條帶相差不大,60 ℃后水溶性蛋白的兩個主要電泳條帶逐漸變淺,100 ℃時蛋白條帶已經很淺,表明蛋白亞基被嚴重破壞,發生變性聚沉。采用差示掃描量熱法對水溶性蠶蛹蛋白進行分析,在熱分析圖譜上出現吸熱峰表示該點已處在蛋白質熱變性溫度區域,并且這個峰值對應的溫度即為該樣品的熱變性溫度[16-17]。如圖1-d所示,蠶蛹水溶性蛋白主要發生了3次熱變性,蠶蛹水溶性蛋白第1次熱變性的起始變性溫度為70 ℃左右,峰值變性溫度為76.8 ℃,結束變性溫度為80 ℃左右,直觀圖觀察顯示此時玻璃瓶中蛋白溶液出現明顯沉淀;第2次熱變性的起始變性溫度為100 ℃,峰值變性溫度為104.2 ℃,結束變性溫度為110 ℃,這個峰的出現可能與蛋白中含有的結合水有關;第3次熱變性的起始變性溫度為115 ℃,峰值變性溫度為122.3 ℃,結束變性溫度為140 ℃,這個峰相比于前兩個峰寬更明顯,可能與100 ℃電泳條帶中的剩余的少量亞基有關。蠶蛹水溶性蛋白可以耐受70 ℃,30 min的熱殺菌。因此在蛋白加工過程中,可對含有蠶蛹水溶性蛋白液體制品采用巴氏殺菌,提高產品的微生物安全性。

a-不同溫度溶解性變化;b-蛋白亞基的變化;c-溶液外觀變化;d-差示掃描量熱法掃描圖圖1 溫度對水溶性蠶蛹蛋白溶解度的影響Fig.1 Effect of temperature on solubility注:不同字母間表示差異顯著(P<0.05)(下同)
2.2.2 pH對溶解性及蛋白結構的影響
蛋白的溶解性與蛋白質的生理功能有關。如圖2所示,在pH 4.0~12.0,隨著pH的增加,溶解度呈顯著上升趨勢(P<0.05)。謝盛莉等[8]研究結果顯示蠶蛹水溶性蛋白的等電點為3.8,pH大于等電點,pH越高,蛋白質帶有的負電越多,其靜電排斥力和離子水化作用增加,導致蛋白質分子之間不易發生聚集,從而增加了蛋白質的溶解度[18]。因此,蠶蛹水溶性蛋白更適合在中性或弱堿性的條件下使用。
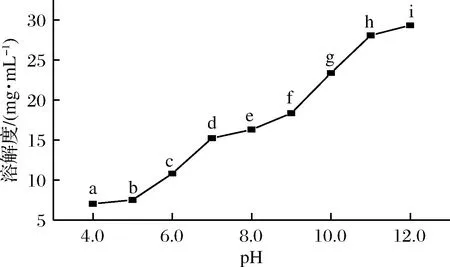
圖2 不同pH下溶解度的變化Fig.2 Solubility at different pH
蛋白質的二級結構可以通過圓二色譜(circular dichroism,CD)數據反映,一般蛋白質的CD光譜含有1個正峰(190 nm)和1個負槽(205~235 nm),其中,主鏈構象與負槽的形狀密切相關。α-螺旋結構在靠近192 nm有1個正的譜帶,在222 nm和208 nm處有2個負的峰譜帶;β折疊在216 nm附近有1個負譜帶,在185~200 nm有1個正譜帶,β轉角在206 nm附近有1個正譜帶[19]。如圖3-a所示,水溶性蛋白的CD譜圖在220 nm附近有強負吸收峰,是α螺旋的特征峰[20]。由圖3-b可知,在pH 4.0~9.0,隨著pH的增大,α-螺旋與β-折疊含量也逐漸增大,β-轉角和無規則狀態含量隨著pH的增大而減少,表明水溶性蛋白二級結構之間的有序結構增多。這一變化現象與蛋白的溶解度隨著pH的變化相一致,pH的增大促進了蛋白質溶解度的增加[20],蛋白質之間的空間距離也相應增大,暴露出較多的α螺旋結構。pH 9.0后,α-螺旋與β-折疊總含量出現下降趨勢,可能是在較強的堿性作用下維持這些結構的氫鍵及疏水作用力等部分被破壞,蛋白質有序度降低造成的。β-轉角和無規則卷曲含量增多,蛋白展開程度較小且蛋白間的斥力增加,蛋白溶解度保持上升趨勢。
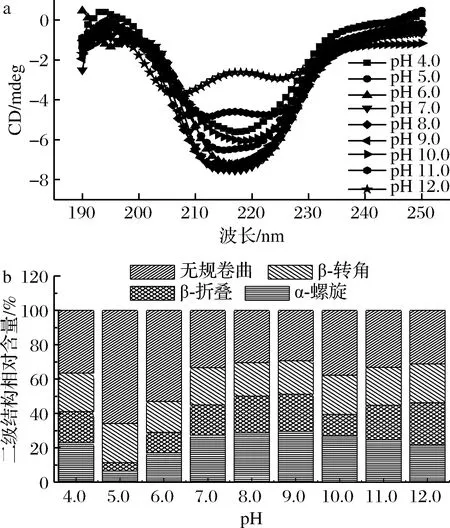
a-水溶性蛋白在不同pH下的圓二色譜圖;b-不同pH下蛋白二級結構的相對含量圖3 不同pH下的圓二色譜圖Fig.3 Circular dichromatograms at different pH
2.2.3 NaCl濃度對溶解性及蛋白疏水性的影響
由圖4-a可知,隨著NaCl濃度的增大,在0.2~1.0 mol/L內溶解度呈顯著上升趨勢(P<0.05),造成這一現象原因是隨著鹽濃度的增加,鹽類解離出來的離子與蛋白的解離基團離子相互作用增強,表面游離疏水基團減少,親水性基團暴露增多,導致蛋白溶解度增大;但NaCl濃度過大(超過1.0 mol/L),溶解度顯著下降,鹽離子解離出的離子與水分子結合,降低了蛋白與水分子之間的作用力,親水基團暴露較少,親水性減弱,導致溶解度下降[5]。
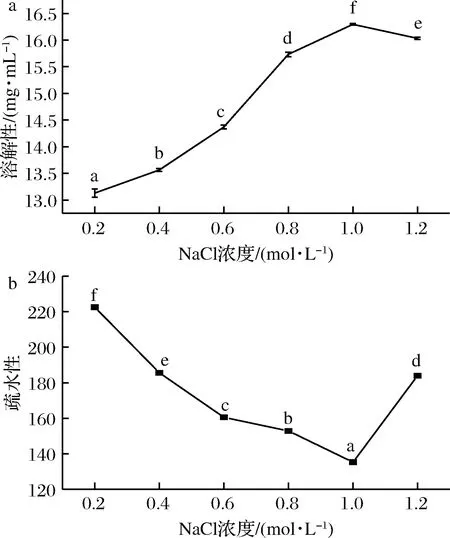
a-溶解性;b-疏水性圖4 不同鹽濃度下溶解度與表面疏水性變化Fig.4 Changes in solubility and surface hydrophobicity at different salt concentrations
蛋白質的表面疏水性與蛋白分子的內部結構、外界環境有很大關系[21]。在0.2~1.0 mol/L鹽濃度內,隨著NaCl濃度的增加,蠶蛹水溶性蛋白疏水值呈顯著下降趨勢,這一現象的原因是鹽離子與蛋白的解離基團離子相互作用增強,導致表面游離疏水基團減少,疏水性下降。NaCl濃度大于1.0 mol/L時,疏水值呈顯著上升趨勢,鹽離子解離出的離子不僅與蛋白的解離基團離子結合,還可以與水分子結合,使蛋白分子間的相互作用增大,親水性減弱,疏水性增強[5]。因此,在進行鹽溶性蛋白的溶解時,鹽濃度應不超過1.0 mol/L,防止鹽析現象的出現。
2.3 乳化性測定
2.3.1 油相體積分數對乳化性影響
乳化活性和乳化穩定性是評價蛋白質乳化性能的常用指標,與蛋白質分子的兩親結構、溶解度等因素有關[5,21]。如圖5所示,在油相體積分數為20%~35%,乳化活性隨油相體積增加呈顯著上升趨勢,可能是隨著油相體積分數的增加,形成的界面面積增大,蛋白分子暴露的基團更易吸附在油水界面,界面上蛋白吸附量增多造成的[21];油相體積分數為35%達到最大,表明蛋白乳化的油量最多;油相體積分數大于35%后乳化活性降低,可能是油相比例過大,體系中油滴之間的聚集增強[5],破壞了油水界面的相互作用,界面蛋白吸附數量減少,乳化活性降低。乳化穩定性在油相體積分數20%時達到最大,之后乳化穩定性隨油相體積分數的增加有不同程度的下降,油相體積分數的增加使油滴之間的聚集增強,破壞了油水界面的相互作用,界面上蛋白的吸附強度降低,穩定的乳化狀態會受到破壞。考慮到較好的乳化活性與穩定性,可選擇35%作為固定油相體積分數。
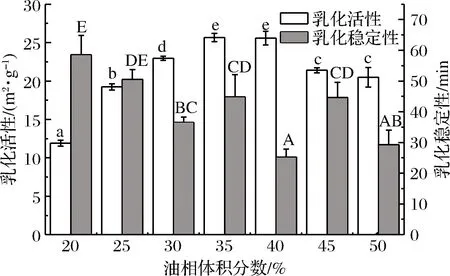
圖5 油相體積分數對乳化性能的影響Fig.5 Effect of oil phase volume fraction on emulsification performance注:圖中小寫字母代表油相體積分數對乳化活性的差異顯著、大寫字母代表油相體積分數對乳化穩定性的差異顯著(P<0.05)
2.3.2 蛋白濃度對乳化性的影響
蛋白濃度對乳化性有直接影響,如圖6所示,在油相體積分數一定的情況下,蛋白質量濃度由1.0 g/L上升到9.0 g/L時,乳化活性呈下降趨勢(P<0.05),蛋白質量濃度超過5.0 g/L時,乳化活性增幅不明顯。蛋白溶解度的增大引起蛋白濃度升高,溶解度與蛋白質表面電荷數有關[22],油相分數一定時,不同濃度下蛋白質所帶的電荷差異會對油水界面的穩定產生影響,引起界面蛋白吸附量和結合強度發生變化,界面蛋白吸附量和結合強度的下降導致乳化活性降低。乳化穩定性在蛋白質量濃度為1.0 g/L時最好,乳化穩定性下降是由于界面蛋白吸附強度降低引起,這與蛋白質本身的黏度、內部結構及表面電荷分布情況有關。綜合考慮有較好的乳化活性和乳化穩定性,可選擇1.0 g/L作為固定的蛋白濃度。

圖6 蛋白濃度對乳化性能的影響Fig.6 Effect of protein concentration on emulsification performance注:圖中小寫字母代表蛋白濃度對乳化活性的差異顯著、大寫字母代表蛋白濃度對乳化穩定性的差異顯著(P<0.05)
2.3.3 pH對乳化性影響
乳化活性與溶解度密切有關[22]。圖7所示,在pH 4.0~10.0,乳化活性隨著pH的增大呈顯著上升趨勢,乳化活性在pH 10.0時最大(P<0.05),蠶蛹水溶性蛋白溶解度隨著pH的增加而增加,親水性基團暴露增多,疏水作用降低,蛋白質分子向油-水界面擴張能力增強,界面面積增大,乳化活性增加[23]。乳化穩定性整體呈先上升后下降趨勢,蛋白等電點在pH 4.0左右,溶解度較低,乳化穩定性差[23];在pH值為5.0時,乳化穩定性達到最大值,蛋白結構相對展開,疏水基團暴露更多,乳化穩定性增強;隨著pH繼續增加,蛋白結構逐漸有序化,疏水集團包埋使界面蛋白吸附能力下降,乳化穩定性下降;在pH 10.0時蛋白結構重新展開,疏水基團暴露,乳化穩定性增加。因此,蠶蛹水溶性蛋白作為食品乳化劑時需要在弱堿性條件下進行。

圖7 pH對乳化性能的影響Fig.7 Effect of pH on emulsification注:圖中小寫字母代表pH對乳化活性的差異顯著、大寫字母代表pH對乳化穩定性的差異顯著(P<0.05)
2.4 起泡性的測定
起泡性與乳化性都是蛋白的表面性質,都與蛋白的兩親結構、溶解性相關。如圖8所示,隨著蛋白濃度的增加, 蛋白質起泡性呈先上升后下降趨勢,蛋白質量濃度在3.0 g/L時起泡性最高(P<0.05)。在1.0~3.0 g/L的蛋白質量濃度內,蛋白濃度適量增大促進水-空氣界面的生成,增強起泡能力;起泡性在蛋白質量濃度大于3.0 g/L時下降,原因是隨著蛋白濃度的繼續增大,親水基團數量增加的更多,泡沫形成能力下降。起泡穩定性隨著蛋白的濃度增大呈下降趨勢,穩定性在蛋白濃度為1.0 g/L時最高(P<0.05),這是由于隨著蛋白濃度的增加,蛋白分子之間通過非共價鍵重新形成更大的分子聚集體,水-空氣界面膜的穩定性下降,膜黏性和厚度變小,泡沫穩定性下降[24]。

圖8 蛋白濃度對起泡性的影響Fig.8 Effect of protein concentration on blistering property注:圖中小寫字母表示蛋白濃度對起泡性的差異顯著、大寫字母代表蛋白濃度對起泡穩定性的差異顯著(P<0.05)
2.5 持油性測定
持油性是指蛋白質與油脂相結合的能力,與蛋白質種類、來源、加工方法、溫度及油脂種類等有關[24-25]。如圖9所示,隨著油體積的增加, 蛋白質持油性呈升高后下降的趨勢,在5.0~15.0 mL內,持油性顯著上升(P<0.05),持油性在油體積15.0 mL時最大(3.9 g/g),之后持油性顯著下降(P<0.05)。蛋白質的持油性與其構象及親水親油集團的平衡密切關聯,持油能力主要與疏水基團暴露程度有關[26],油脂含量過高時,蛋白表面單位疏水基團會結合更多的油脂,蛋白分子與油脂之間整體結合力減弱,持油性下降。與大豆蛋白(1.53 g/g),腰果蛋白(2.84 g/g)的持油性相比[24],蠶蛹水溶性蛋白持油性較好。因此可以考慮將其作為持油劑應用于食品工業中。

圖9 大豆油體積對持油性的影響Fig.9 Effect of soybean oil volume on oil retention
3 結論
蠶蛹水溶性蛋白必需氨基酸種類豐富,天冬氨酸和谷氨酸是蠶蛹水溶性蛋白氨基酸的主要成分,蘇氨酸、纈氨酸、蛋氨酸、異亮氨酸、亮氨酸、苯丙氨酸和賴氨酸的含量可滿足成人需求,蠶蛹水溶性蛋白是一種營養價值較高的蛋白資源。
蠶蛹水溶性蛋白溶液在70 ℃條件下溶解度降低程度較小,可耐熱巴氏殺菌;在pH 4.0~9.0內,隨著pH的增大,α-螺旋與β-折疊含量也逐漸增大,溶解度因α-螺旋與β-折疊增加呈上升趨勢;在pH 9.0之后,α-螺旋與β-折疊總含量出現下降趨勢,較強的堿性,作用下維持這些結構的氫鍵及疏水作用力等部分被破壞,蛋白質有序度降低,β-轉角和無規則卷曲含量增多,但因蛋白展開程度不大且蛋白間的斥力增加,溶解度仍隨著pH的增加而增大。在0.2~1.0 mol/L的鹽濃度內,溶解度隨著鹽濃度增大呈上升趨勢,超過1.0 mol/L后因鹽析作用溶解度下降。
油相體積分數35%,蛋白質量濃度1.0 g/L,pH 10.0時蛋白乳化性能較好;蛋白質起泡性在蛋白濃度3.0 g/L時最高,泡沫穩定性在蛋白質量濃度1.0 g/L 時最高;蛋白質持油性最大達到3.9 g/g。本實驗結果為蠶蛹水溶性蛋白在食品工業中的進一步應用提供理論參考。

