蔗糖轉化酶SUC2分泌表達系統的改造
鄭聰聰,周海龍,趙晶晶,李憲臻,楊 帆
(1.大連工業大學 生物工程學院,遼寧 大連 116034;2.中國生物發酵產業協會,北京 100833)
0 引 言
菊糖是一種可以生產燃料乙醇的優質能源生物質。然而,自然界中只有極少數微生物可以直接轉化菊糖為乙醇[1-2]。釀酒酵母(Saccharomycescerevisiae)能夠高效轉化生物質生產乙醇,且易于培養、遺傳操作平臺成熟[3]。然而,絕大多數釀酒酵母菌株不能直接水解菊糖為可發酵糖[4-5]。有文獻表明,蔗糖轉化酶SUC2是釀酒酵母水解菊糖的關鍵酶,它的表達水平直接影響釀酒酵母水解菊糖產乙醇的能力[6]。目前,天然釀酒酵母菌株中SUC2的表達水平非常低,嚴重阻礙了菊糖基乙醇的工業化生產進程[7-8]。
釀酒酵母α交配因子(αF)是一種肽激素效應物,僅由α型單倍體細胞分泌,指引該細胞與相反配型的單倍體細胞進行接合[9]。α交配因子的前體進入細胞的分泌系統,并在分泌后期被胞內外蛋白質水解酶加工為成熟的αF[10]。國內外已有多項研究利用α交配因子的分泌信號肽融合目標蛋白以提高其分泌表達水平,如來自馬克斯克魯維酵母的菊糖酶和羧肽酶等,均取得了較好的效果[11-13]。
目前,還沒有文獻報告利用融合分泌信號肽有效提高釀酒酵母SUC2分泌水平。本實驗克隆獲得α交配因子的分泌信號肽編碼基因,并將其與SUC2編碼基因上游進行融合,隨后轉化至釀酒酵母進行分泌表達,旨在為理性改造釀酒酵母使其高效轉化菊糖產乙醇提供理論基礎。
1 材料與方法
1.1 材料與儀器
釀酒酵母S.cerevisiaeBY4741、EscherichiacoliDH10B,獲贈于大連化學物理研究所趙宗保研究員課題組。質粒pYC230-Suc2,中國科學院青島生物能源與過程研究所贈予。釀酒酵母重組菌BY-BS,本實驗室前期構建并保藏。PrimeSTAR HS DNA 聚合酶,250 bp DNA Marker,大連寶生物有限公司;DpnI,NEB公司。
酵母發酵液體YPD培養基:葡萄糖20.0 g/L,酵母浸粉10.0 g/L,蛋白胨20.0 g/L,pH 6.0;固體YPD培養基:瓊脂粉15.0 g/L其余同YPD液體培養基,根據需要補加200 μg/mL G418。LB液體培養基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化鈉10.0 g/L,pH 7.0;LB固體培養基:瓊脂粉15.0 g/L其余同LB液體培養基,根據需要補加100 μg/mL氨芐西林。
Eppendorf AG22331電擊融合儀、梯度PCR儀,德國艾本德股份有限公司;MD spectramax paradigm酶標儀,美谷分子儀器(上海)有限公司;DYY-11型電泳儀,北京市六一儀器廠。
1.2 方 法
1.2.1 引物設計
α交配因子的分泌信號編碼基因的克隆及基因融合表達載體的構建、鑒定所用引物均合成于大連寶生物有限公司。所使用的引物序列及功能如表1所示。

表1 引物序列及功能Tab.1 Sequences and functions of primers
1.2.2 α交配因子的分泌信號編碼基因的克隆
將αF分泌信號肽與部分Suc2基因融合片段共303 bp送往上海生工生物技術有限公司進行全基因合成,合成的片段被亞克隆至pUC57,構成pUC57-αF-Suc2。
1.2.3 融合有αF分泌信號肽的pYC-mSuc2分泌表達載體的構建
采用RF克隆策略[19]將釀酒酵母表達載體pYC230-Suc2上的Suc2天然分泌信號肽編碼序列替換為全基因合成的αF分泌信號肽基因片段(αFSP)。RF Ⅰ反應所用引物為pSF和pSR,以質粒pYC230-Suc2為模板,反應條件:94 ℃ 5 min,94 ℃ 30 s,53 ℃ 45 s,72 ℃ 30 s,30個循環,72 ℃ 10 min,4 ℃結束反應。采用凝膠回收試劑盒對RF Ⅰ擴增產物進行回收。RF Ⅱ反應體系:100 ng pYC230-Suc2,280 ng RF Ⅰ回收產物,5 μL 5×PrimerSTAR buffer,2.5 mol/L dNTPs,1.25 U PrimeSTAR HS DNA聚合酶,加水至總體積為25 μL。RF Ⅱ反應條件:94 ℃ 5 min,94℃ 30 s,65 ℃ 1 min,68 ℃ 9 min,15個循環(每個循環退火溫度降低1 ℃),之后,94 ℃ 30 s,55 ℃ 1 min,68 ℃ 9 min,20個循環,68 ℃ 15 min,4 ℃結束反應。
取9 μL RF Ⅱ反應產物,加入1 μLDpnI (10 U/μL),37 ℃消化5 h降解甲基化模板質粒。取2.5 μL消化產物電擊轉化至E.coliDH10B中,轉化菌液涂布于含終質量濃度為100 μg/mL氨芐西林的LB平板,挑選陽性克隆進行酶切驗證。酶切體系:0.5 μg質粒DNA,0.5 μLSalⅠ和0.5 μLSacⅠ(雙酶切)或0.5 μLPstⅠ(單酶切),1 μL 10×buffer,加水至體積為10 μL,37 ℃溫育2 h,1%瓊脂糖凝膠電泳對酶切產物鑒定。測序正確的質粒命名為pYC-mSuc2,如圖1所示。
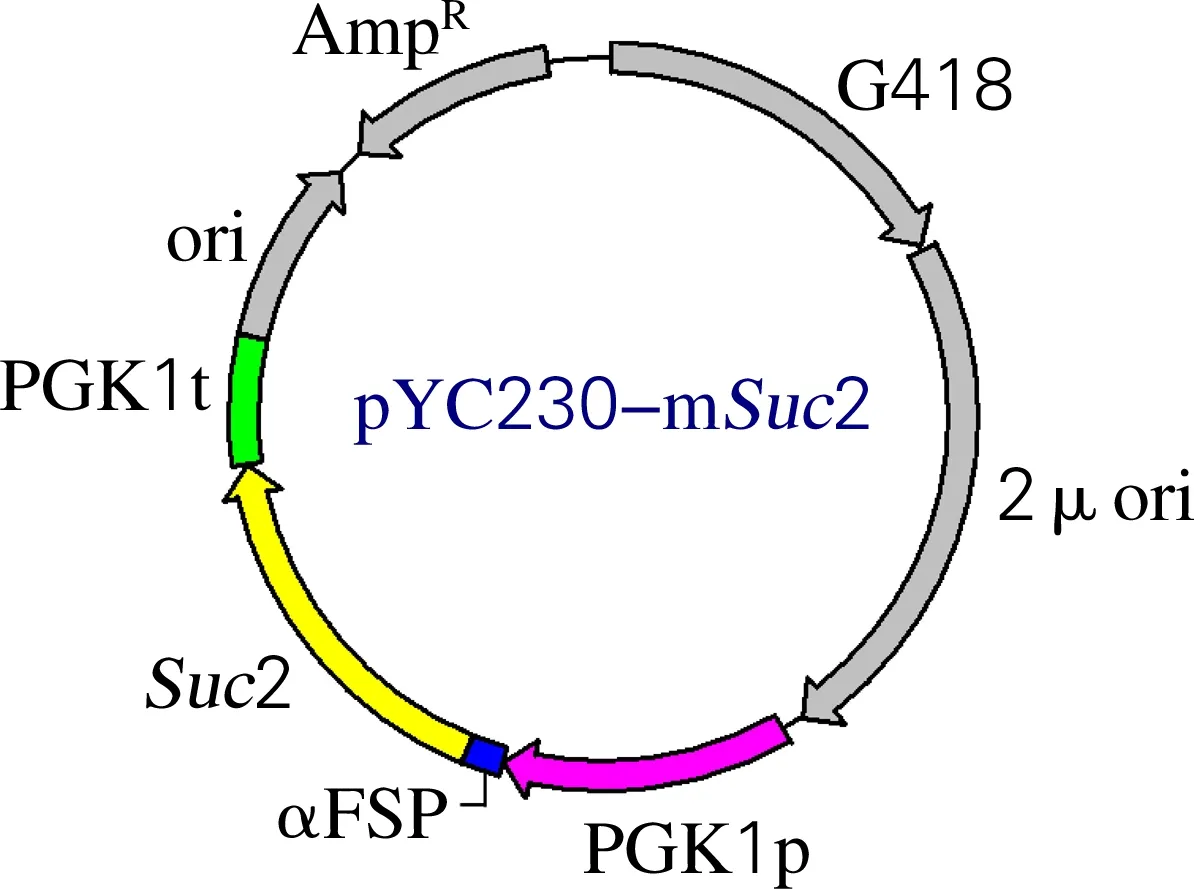
圖1 質粒pYC-mSuc2示意圖Fig.1 The map of plasmid pYC-mSuc2
1.2.4 分泌表達Suc2的重組釀酒酵母的構建
將鑒定正確表達的質粒pYC-mSuc2電擊轉化至S.cerevisiaeBY4741感受態細胞中,電壓為1 500 V。電擊結束后轉化菌液加入增加1 mol/L 山梨醇1 mL,于30 ℃溫育2 h后將轉化菌液涂布于含有200 μg/mL G418抗性篩選平板上,30 ℃培養至轉化子出現。挑取陽性轉化子提取質粒DNA并進行PCR鑒定。鑒定正確的重組釀酒酵母命名為BY-mS。
1.2.5 分泌表達SUC2的釀酒酵母重組菌株酶活測定
將鑒定正確的重組酵母單菌落接種于10 mL的YPD種子液中,以30 ℃、200 r/min的培養條件培養24 h。種子液按照體積比1∶100接種于YPD液體培養基,于30 ℃、200 r/min搖床培養48 h。發酵培養結束后測定菌體濃度,并將發酵液稀釋至OD600為4。1 mL稀釋后的發酵菌液5 000g、4 ℃離心10 min得到已稀釋后的發酵液上清,收集菌體重懸于1 mL 0.1 mol/L PBS緩沖溶液(pH 6.8)。
酶活測定方法:取50 μL重懸菌液或稀釋后的發酵液上清與450 μL菊糖或蔗糖底物(20 g/L,pH 5.0)混勻,50 ℃水浴反應15 min。沸水浴10 min 終止反應。采用DNS法測定反應釋放的還原糖[15]。
酶活定義:每分鐘水解菊糖或蔗糖釋放1 μmol 葡萄糖所需的酶量為1 U。
2 結果與討論
2.1 釀酒酵母α交配因子分泌信號肽編碼基因的全基因合成
由上海生工合成釀酒酵母α交配因子分泌信號肽編碼基因與Suc2部分編碼基因融合DNA片段被亞克隆至pUC57。構建的重組載體pUC57-αF-Suc2送TaKaRa大連寶生物公司測序,利用軟件DNAStar中的MegAlign程序將測序結果與Genebank提交的αF信號肽編碼序列和Suc2核苷酸序列進行比對,如圖2所示。比對結果表明,全基因合成的核苷酸序列完全正確。DNA序列長度為303 bp,其中α交配因子分泌信號肽編碼基因長度為60 bp。

圖2 全基因合成αF-Suc2基因融合片段與數據庫序列比對結果Fig.2 Sequence alignment of synthesized αF-Suc2 DNA compared with the gene data from Genebank
2.2 Suc2分泌表達載體及菌株的構建
以pUC57-αF-Suc2為模板,PCR擴增融合α交配因子分泌信號肽編碼基因與Suc2部分編碼基因融合片段αF-Suc2,瓊脂糖凝膠電泳結果如圖3所示。在300 bp附近擴增出一條特異性條帶,大小與αF-Suc2目的基因片段一致。將回收的PCR產物送至上海生工測序,測序結果經NCBI數據庫比對證明為αF-Suc2序列。

M,DNA marker;1,目的條帶圖3 PCR擴增融合片段αF-Suc2的電泳驗證結果Fig.3 Agarose gel electrophoresis results of αF-Suc2 fragment
為了構建釀酒酵母蔗糖轉化酶編碼基因Suc2的分泌表達載體,利用RF克隆策略將Suc2自身的分泌信號肽替換為α交配因子分泌信號肽。將RF克隆產物轉化至E.coliDH10B感受態細胞中,挑取陽性克隆進行質粒提取。對提取的質粒進行SalⅠ/SacⅠ雙酶切以及PstⅠ單酶切驗證。電泳結果如圖4所示,重組質粒經SalⅠ/SacⅠ雙酶切后顯示有大小為3 901和5 690 bp兩條特異性條帶,PstⅠ單酶切后顯示有大小為1 791和7 800 bp的兩條特異性條帶,與預測正確重組質粒的酶切結果基本一致。將酶切鑒定正確的質粒送上海生工測序,結果表明成功構建了蔗糖轉化酶分泌表達載體pYC-mSuc2。
將表達載體pYC-mSuc2轉化至S.cerevisiaeBY4741感受態細胞中,30 ℃靜置培養,挑取陽性克隆提取重組質粒并進行PCR鑒定,瓊脂糖凝膠電泳結果如圖5所示。擴增產生大小為300 bp的特異性條帶,與理論PCR驗證DNA產物大小基本一致。該結果表明成功構建了分泌表達蔗糖轉化酶的重組釀酒酵母BY-mS。
2.3 分泌表達SUC2的釀酒酵母重組菌株酶活力
將重組釀酒酵母BY-mS分泌表達SUC2的能力與未替換分泌信號肽的對照菌株BY-BS進行比較,結果如圖6和圖7所示。在發酵48 h條件下,BY-mS重組菌全細胞菊糖酶活力為2.6 U/mL、發酵液上清菊糖酶活力為3.4 U/mL,均顯著高于對照菌株BY-BS。BY-mS重組菌全細胞蔗糖酶活力為34.5 U/mL,顯著高于對照菌株BY-BS;而該菌株發酵液上清蔗糖酶酶活力為9.7 U/mL,與對照菌株無顯著性差異。結果表明,相對于SUC2自身的天然分泌信號肽,α交配因子分泌信號肽的融合能夠有效地提高SUC2在釀酒酵母中的分泌水平。

M,DNA marker;1,雙酶切結果;2,單酶切結果圖4 重組質粒pYC-mSuc2的Sal Ⅰ/Sac Ⅰ雙酶切以及 Pst Ⅰ單酶切驗證電泳圖Fig.4 Electrophoresis results of the recombinant plasmid pYC-mSuc2 digested by Sal Ⅰ/Sac Ⅰ and Pst Ⅰ

M,DNA marker;1~6,PCR鑒定結果圖5 轉化有pYC-mSuc2的釀酒酵母重組菌株鑒定結果Fig.5 PCR identification results of the recombinant strain transformed with plasmid pYC-mSuc2
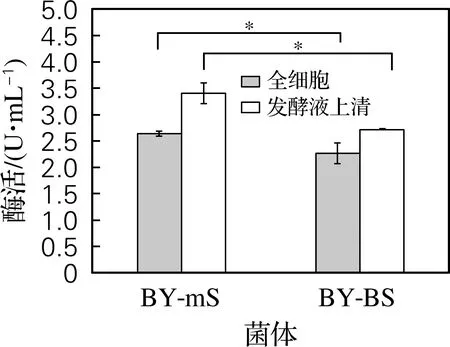
圖6 重組釀酒酵母BY-mS和BY-BS全細胞及發酵液上清菊糖酶活力比較Fig.6 Comparison of inulinase activities in the whole cells and fermentation supernatant of the recombinant strain BY-mS and BY-BS
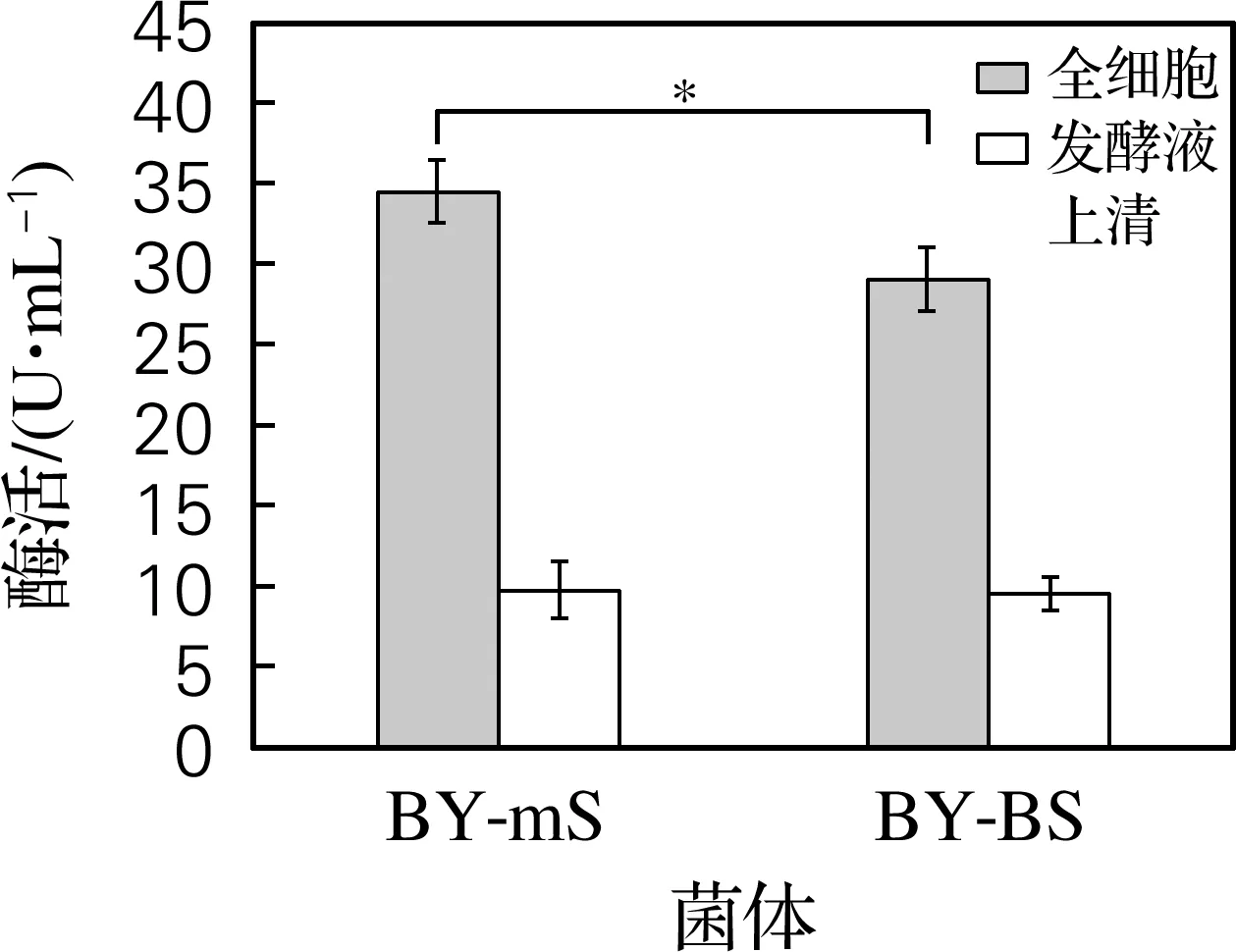
圖7 重組釀酒酵母BY-mS和BY-BS全細胞及發酵液上清蔗糖酶活力比較Fig.7 Comparison of sucrase activities in the whole cells and fermentation supernatant of the recombinant strain BY-mS and BY-BS
此外,從全細胞和發酵液上清的酶活力數據可以看出,SUC2在釀酒酵母細胞中表達后,能夠分泌到細胞壁和發酵液上清中。從不同分泌場所中的酶活差異可以推測出,SUC2分泌定位于細胞壁表面時的構象更加利于蔗糖酶活力的展示,而當SUC2分泌至發酵液上清中時,結構的變化導致菊糖酶活力更高。
3 結 論
全基因合成獲得釀酒酵母α交配因子分泌信號肽編碼基因,并將其融合至蔗糖轉化酶Suc2編碼基因的上游,實現了釀酒酵母中SUC2的分泌表達。當重組菌在發酵48 h時,相較于含有天然分泌信號肽的SUC2,α交配因子分泌信號肽能夠有效提高SUC2在釀酒酵母中的分泌表達水平,使得重組菌株展現出更高的蔗糖酶活力及菊糖酶活力。此時,SUC2分別分泌在細胞壁和發酵液上清兩個部位。當SUC2分泌在細胞壁時的構象,更加有利于展現蔗糖酶活力;而當SUC2分泌在發酵液上清時,更加有利于展現菊糖酶活力。

