原發性干燥綜合征相關肺囊性病變的影像學特點及危險因素探討
李德福,祝婷婷,龐穎△
原發性干燥綜合征(primary Sj?gren's syndrome,pSS)是一種進行性系統性自身免疫性疾病,其發病率僅次于類風濕關節炎[1]。該疾病以淋巴細胞浸潤為特征,多伴有口干、眼干及角結膜炎等癥狀,可累及全身各個器官及系統[2],主要靶器官是外分泌腺體(如唾液腺等)。肺部是常見腺外受累器官,10%~20%的pSS 患者可發展為肺部疾病[3]。其相關肺部疾病表現多樣,主要包括間質性肺疾病、氣道疾病、淋巴增生性疾病[4]。pSS 相關肺囊性病變(cystic lung disease,CLD)發生率較高[5],且多不可逆,嚴重者可造成患者肺功能損害。目前對于pSS患者肺囊性病變的CT特點所知甚少,單純針對pSS肺囊性變的危險因素研究也較少。本研究旨在評估pSS相關CLD 的胸部CT 特點及臨床危險因素,為早發現、早干預、降低患者肺部受損風險提供更多的參考依據。
1 對象與方法
1.1 研究對象 選取華中科技大學同濟醫學院附屬同濟醫院風濕免疫科與呼吸內科2012年1月1日—2019年12月30日住院的干燥綜合征(Sj?gren's syndrome,SS)患者1 228 例。納入標準:(1)符合2002年國際SS分類標準[6]或2016年美歐共識小組(AECG)的SS 分類標準[7]。(2)胸部CT 檢查患者肺部均有異常。排除標準:(1)繼發性干燥綜合征(secondary Sj?gren's syndrome,sSS)患者,如繼發于系統性紅斑狼瘡、類風濕性關節炎、硬皮病、皮肌炎等。(2)已有其他原因的肺部疾病患者,如肺部腫瘤、感染、慢性阻塞性肺疾病等。(3)未行胸部CT檢查或胸部CT檢查未見異常。最終共納入pSS相關胸部CT 異常患者181 例,其中女155 例(85.64%),男26 例(14.36%),年齡16~81 歲,平均(52.19±11.70)歲,病程1~480個月,中位病程36(12,84)個月。根據肺部有無囊性病變,將患者分為有囊性變組51 例(28.18%)和無囊性變組130 例(71.82%)。
1.2 一般資料 所有pSS 患者的臨床資料均從住院時電子病歷中獲取,包括性別、年齡、病程、主要癥狀和體征;實驗室檢查:C 反應蛋白(CRP)、白細胞計數(WBC)、抗核抗體(ANA)、抗SSA 抗體、抗SSB 抗體、抗Ro52 抗體、IgG、IgA、IgM、補體C3、補體C4 和類風濕因子(RF);肺功能測試(pulmonary function test,PFT)。
1.3 影像學評估 采用GE、Philips或東芝公司的64/128/256排螺旋CT掃描設備。患者均采取仰臥位吸氣后屏氣狀態進行掃描,掃描范圍上至肺尖,下至肺底。掃描參數:管電壓120 kV,管電流80~250 mA,層厚5 mm,螺距1.0,采用標準算法及骨算法重建,重建層厚1 mm;肺窗位-600 HU,窗寬1 600 HU;縱隔窗位40 HU,窗寬350 HU。CLD 定義為囊壁厚度1~4 mm的含氣病變[8],并根據Fleischner協會建議排除其他空腔病變[9],如空洞(壁厚>4 mm)、間隔旁肺氣腫(壁厚<1 mm 并位于胸膜下)、肺氣腫(無壁的擴大氣腔)、肺大皰(壁厚≤1 mm)。從我院RIS 系統工作站提取pSS患者的胸部影像資料,并由2名具有多年胸部診斷經驗的放射科醫生各自獨立閱片,結果有爭議時經協商確定。記錄CLD、磨玻璃影、實變影、結節、網格影、蜂窩影、支氣管壁增厚、支氣管擴張、馬賽克灌注、樹芽征等征象及分布情況,并對CLD的大小、分布及囊內特征做重點評估。部分CLD 患者進行了隨訪,隨訪時間平均20.72個月(范圍1~84個月)。
1.4 統計學方法 使用SPSS 25.0軟件包進行統計分析。連續變量以±s或M(P25,P75)表示,分類變量以例(%)表示。不符合正態分布連續變量組間比較采用Mann-Whitney U檢驗,符合正態分布連續變量采用獨立樣本t 檢驗,分類變量采用χ2檢驗或Fisher 確切概率法。CLD 的影響因素采用Logistic回歸分析,將臨床重要變量和單因素分析P≤0.1 的變量納入多因素Logistic回歸分析,P<0.05為差異有統計學意義。
2 結果
2.1 臨床特征及實驗室檢查 相比無囊性變組,有囊性變組的病程長,呼吸困難、口干癥狀患者的比例高,雷諾現象的比例較低(P<0.05)。2組間性別、年齡及發熱、咳嗽、氣促、胸悶等差異無統計學意義(P>0.05)。有囊性變組較無囊性變組RF、IgG、IgA、IgM 水平,抗Ro52 抗體和抗SSB 抗體陽性率較高(P<0.05),見表1。
2.2 PFT測試 行PFT的34例患者中,有囊性變組9 例,無囊性變組25 例。2 組間限制性通氣功能障礙、阻塞性通氣功能障礙、最大通氣下降等比例差異均無統計學意義,見表2。
2.3 CLD 影像特征及患者隨訪 CLD 呈散在隨機分布,在雙肺各葉及肺內外帶分布無顯著差異,囊性病變數目不一(約1~107 個),大小不等(直徑3.8~48.6 mm),以圓形為主,部分形態不規則,囊壁薄。大部分有CLD者伴隨磨玻璃影、結節、小葉間隔增厚或實變等影像表現,有囊性變組與無囊性變組間各項伴隨影像表現差異均無統計學意義(表3),僅有CLD 而不伴其他異常影像表現患者3 例(5.88%)。典型影像學表現見圖1、2。29例(56.86%)有CLD者進行了隨訪復查,復查胸部CT平均2.5次(1~10次)。其中26 例(89.66%)復查CLD 病灶無明顯變化,2 例分別于25個月和34個月后發現部分CLD病灶增大,見圖3。1 例患者68 個月后復查發現肺囊性病變數目稍增多。隨訪期內20 例(68.96%)肺囊性病變患者予以激素及免疫抑制治療。
2.4 pSS相關CLD多因素分析 以是否存在CLD為因變量(是=1,否=0),以性別(女性=1,男性=0)、病程、年齡、WBC、CRP、RF、IgG、IgA、IgM、C3、C4、ANA(陽性=1,陰性=0)、抗SSA 抗體(陽性=1,陰性=0)、抗SSB 抗體(陽性=1,陰性=0)、抗Ro52 抗體(陽性=1,陰性=0)為自變量,單因素Logistic 回歸分析發現抗Ro52 和抗SSB 抗體是pSS 相關CLD 的影響因素(P<0.05),見表4。以單因素分析中P≤0.1 的指標為自變量,包括RF、病程、抗SSA抗體、抗SSB抗體、抗Ro52 抗體(賦值與單因素分析情況相同,由于2組間WBC、IgA平均絕對值均在正常范圍內,因此在納入多因素分析時被排除在外),進行Logistic 多因素回歸分析,結果顯示抗SSB 抗體陽性是pSS 相關CLD的獨立危險因素(P<0.01),見表5。
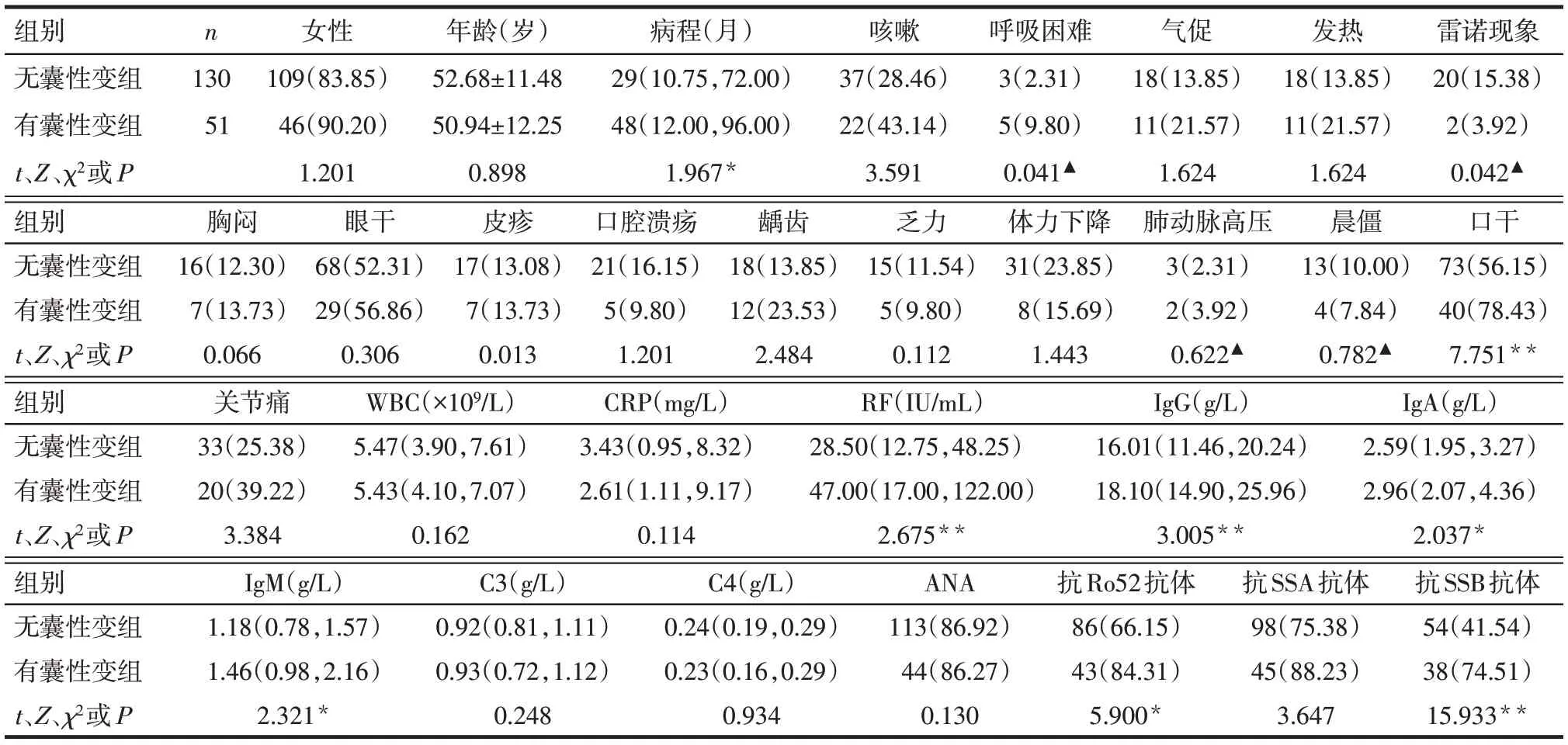
Tab.1 Clinical characteristics and laboratory test results of 181 patients with pSS表1 181例pSS患者的臨床特征和實驗室檢查結果

Tab.2 Pulmonary function test results of 34 pSS patients表2 34例pSS患者肺功能測試結果 例(%)
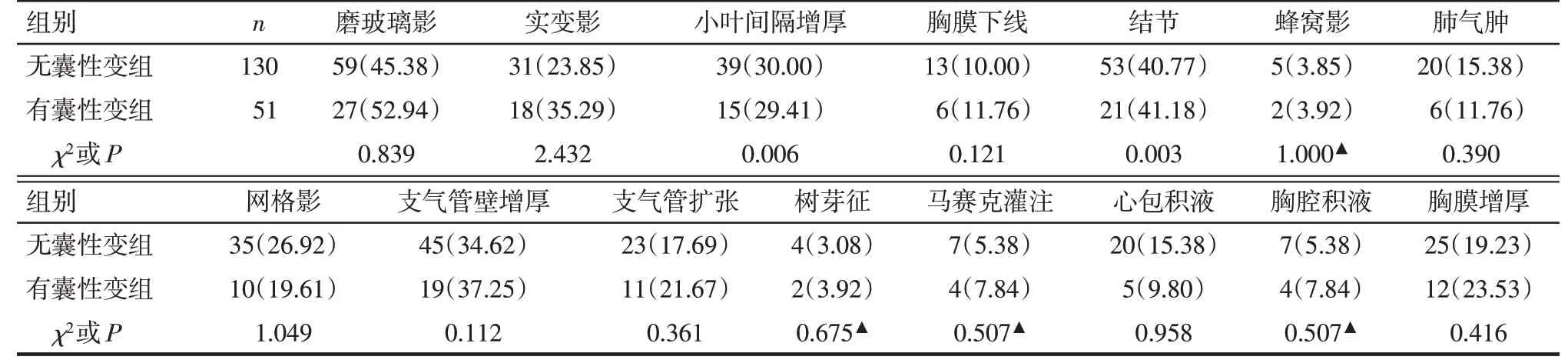
Tab.3 Image manifestations of chest CT in two groups of patients表3 2組患者肺部CT影像表現 例(%)
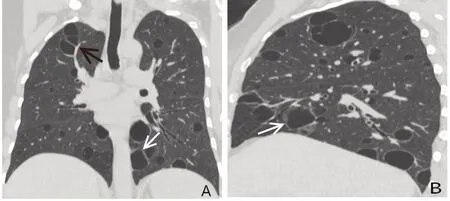
Fig.1 Imaging features of pulmonary cystic change in pSS圖1 pSS肺囊性改變的影像學表現
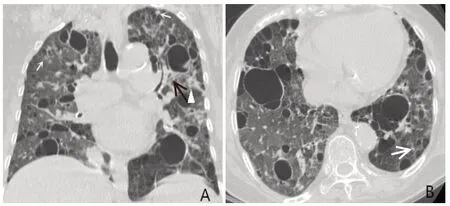
Fig.2 Cystic changes of the lung in pSS and its accompanying signs圖2 pSS的肺囊性改變及其伴隨征象
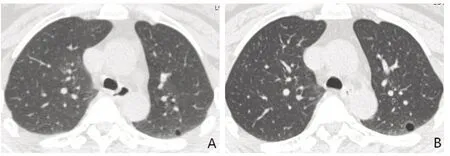
Fig.3 Cystic changes and follow-up CT images圖3 肺囊性變的CT隨訪
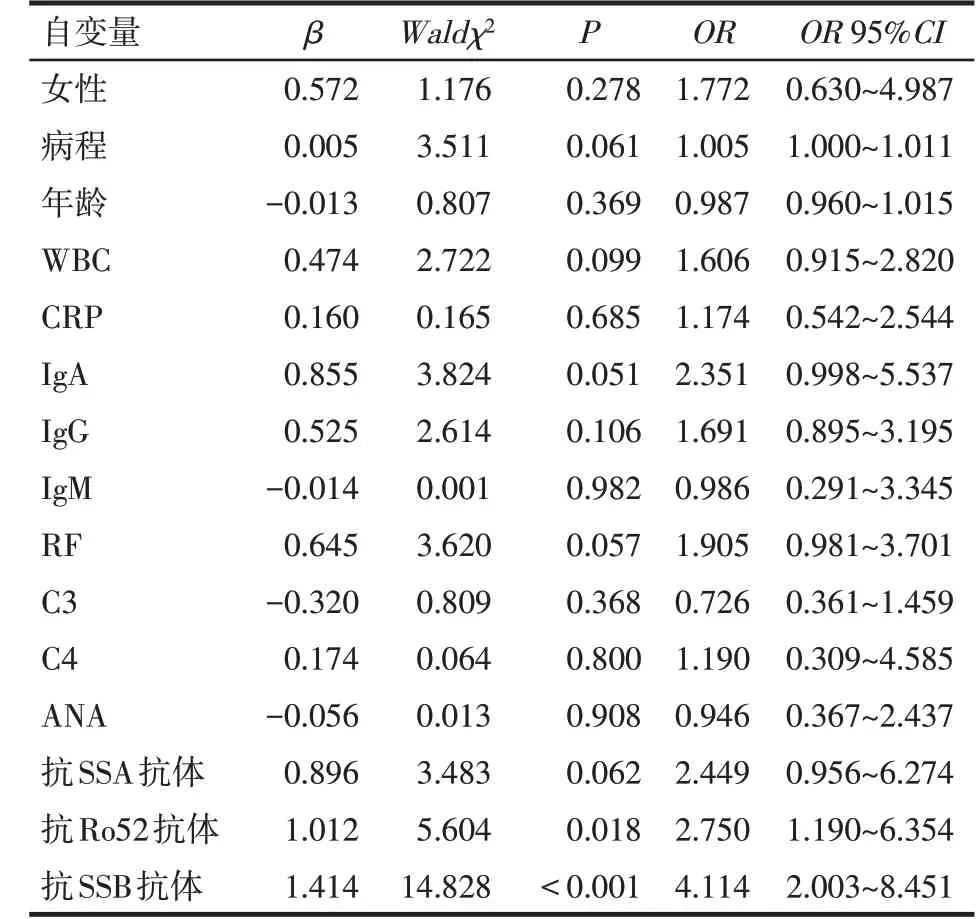
Tab.4 Analysis of risk factors of pulmonary cystic change of pSS表4 pSS肺囊性變單因素Logistic回歸分析
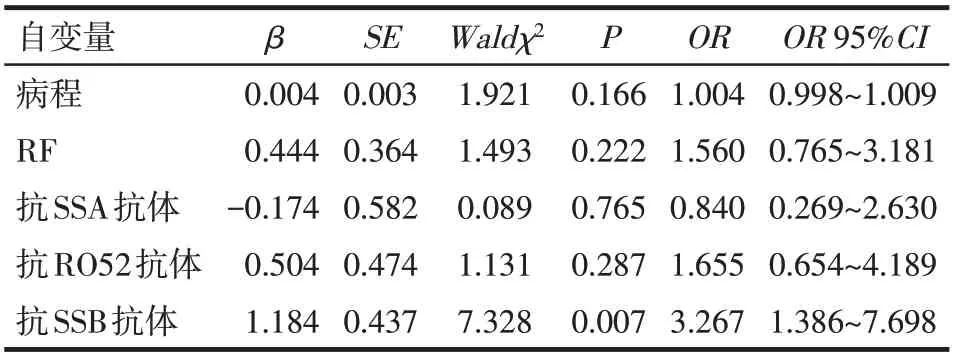
Tab.5 Logistic regression analysis of multiple factors in pulmonary cystic changes of pSS表5 pSS肺囊性變多因素Logistic回歸分析
3 討論
pSS的發病機制較為復雜,可能與遺傳、環境和激素因素有關,在遺傳易感背景下,環境和激素被認為能夠觸發這種自身免疫性疾病[10]。肺部pSS存在包括肺部囊性病變等一系列的病理改變[11]。pSS相關CLD的形成機制目前尚不清楚。有學者認為CLD可能是由止回閥機制引起的,在這種機制中,由于血管阻塞后細支氣管缺血或淋巴組織壓迫細支氣管導致其遠端空氣潴留和肺囊性病變形成[12];但也有學者認為可能與肺泡壁脆性有關[13]。pSS相關CLD危險因素的研究較少且研究結果不一致[8,14]。本研究通過對181 例pSS 的臨床癥狀、肺部CT 影像及實驗室檢查進行分析,證實口干、呼吸困難、抗SSB 抗體陽性、抗Ro52 抗體陽性及IgG、IgA、IgM、RF 值升高是較常見的特征,同時pSS 相關CLD 患者的病程較長。因此,臨床工作中對于長病程的pSS 患者應該全面評估是否有CLD。
pSS相關CLD發生率較高,多伴有磨玻璃影、微小結節及支氣管壁增厚等影像學改變[15],而單純囊性病變較少見(發生率約2.5%~9%)[8]。本研究CLD發生率為28.18%,與以往報道相符,其中單純囊性變5.88%,伴隨征象以磨玻璃影及微小結節多見。大部分報道CLD 以隨機分布為主,偶有以雙肺下葉或肺中區(研究者將肺等分為上、中、下三區)為主的報道[1,5,15]。本研究CLD呈隨機分布,與部分文獻[14]報道一致。
本研究根據29例有囊性變組的隨訪結果發現,絕大部分患者CLD 的數目、大小和內部結構基本穩定,僅2例體積增大,1例數目稍增多。pSS相關CLD動態觀察較少有變化,這可能是由于機體自限,免疫抑制阻止其發展的結果[8]。本研究中68.96%的pSS有肺囊性病患者在隨訪期間予以激素及免疫抑制治療,免疫抑制劑在某種程度上可能阻止了CLD發展,但CLD發展過程中免疫抑制的具體作用有待進一步研究。
目前未見直接證據表明CLD與PFT譜之間存在相關性[16]。本研究有囊性變組PFT以限制性肺通氣功能障礙較多見,其次是肺彌散量下降和最大通氣量下降,PFT 各項指標在有囊性變組與無囊性變組間無明顯差異,但本次研究PFT測試樣本量較小,可能會對結果產生影響。
抗SSA抗體和抗SSB抗體是pSS的標志性抗體,在50%~70%的pSS患者中存在,它們的表達可能與pSS 遺傳易感性有關[17],還可能與更嚴重和進展的病程相關[18]。Zhao 等[19]對我國483 例pSS 患者的臨床和免疫學特征研究后發現,抗SSB 抗體在肺受累患者中的檢出率很高,認為抗SSB 抗體可能是我國pSS 患者肺受累的預測因素。本研究發現pSS 肺受累抗SSB 抗體陽性率50.83%(92/181),低于上述報道,但有囊性變組抗SSB 抗體、抗Ro52 抗體陽性比例較高,多因素分析抗SSB抗體陽性是pSS相關CLD獨立危險因素。在評估SS 患者肺囊性變的危險因素的主要研究中,一項研究發現SS相關CLD的危險因素是高齡(OR=1.1,95%CI:1.0~1.16)、sSS(OR=12.1,95%CI:1.12~130.4)和抗SSA 抗體(OR=26.9,95%CI:1.44~93.61)[8];另一項研究發現pSS 相關CLD 與抗SSB 抗體(OR=12.76,95%CI:2.75~29.17)和淋巴增生性疾病(OR=6.02,95%CI:1.30~27.95)獨立相關[14]。此外,有研究發現SS相關CLD患者的抗SSB抗體陽性率較無囊性變者高[5]。然而,這三項研究都是基于小規模的試點研究,且在納入研究對象時,將sSS也納入了研究范疇,而本研究SS相關CLD患者例數相對較多,同時剔除了sSS 患者。納入病例數規模和研究對象范圍不同,可能是結果偏差的主要原因。
此外,本研究發現有囊性變組IgG、IgA、IgM、RF值較無囊性變組升高明顯,2 組補體C3、C4 水平無明顯差異。pSS 相關CLD 與IgG、IgA、IgM、RF 相關研究少見報道。Watanabe等[14]僅將IgG在pSS與sSS間進行比較,但2 組間差異無統計學意義。Lechtman等[5]發現低補體水平在SS相關肺囊性變組與無肺囊性變組間亦無明顯差異。這兩項研究除樣本量較小及研究對象不同外,各類免疫球蛋白或補體水平的數據也相對不完善,這可能使研究結果產生偏差。
綜上所述,pSS 相關CLD 有一定的肺部CT 影像特征,抗SSB抗體陽性是其獨立危險因素,對于該類患者,積極免疫治療可能有利于阻止肺囊性病變進展。

