硒酵母聯合維生素D對實驗性自身免疫甲狀腺炎大鼠甲狀腺相關激素及抗體的影響
侯麗萍,耿建林,谷巍,劉晴晴
自身免疫性甲狀腺炎(autoimmune thyroiditis,AIT)是臨床常見的器官特異性自身免疫性疾病,表現為甲狀腺腫大、咽部不適、頸部壓痛、吞咽困難等癥狀,給患者工作和生活造成一定的影響[1]。實驗性自身免疫性甲狀腺炎(experimental autoimmune thyroidits,EAT)動物模型與人類AIT 具有相同的病理基礎與臨床表現,是研究AIT 的重要工具[2]。硒是人體所必需的微量元素,硒缺乏可致機體免疫功能下降,補硒可降低AIT患者甲狀腺抗體水平,調節T細胞亞群平衡[3]。維生素D具有免疫調節作用,維生素D缺乏是多種自身免疫性疾病的重要影響因素之一[4]。硒和維生素D有利于改善AIT,兩者聯合應用可以提高機體自身免疫力。既往研究表明,絲裂原活化蛋白激酶(motigen-activated protein kinase,MAPK)通路廣泛參與細胞凋亡、增殖和分化等活動過程,與多種免疫性疾病有關[5]。本研究通過建立EAT 大鼠模型,評估硒酵母聯合維生素D 對EAT 相關激素和抗體的作用,探討其改善EAT的作用機制,為臨床治療AIT提供理論參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物 55 只SPF 級雌性SD 大鼠,5 周齡,體質量(130±10)g,購自上海杰思捷實驗動物有限公司,動物許可證號:SCXK(滬)2018-0004。飼養于SPF 級環境,溫度20~25 ℃、相對濕度45%~65%,光照12 h/黑暗12 h循環。實驗前適應性飼養3 d。
1.1.2 藥物、主要試劑和儀器 硒酵母片[國藥準字H10940161,50 μg(以每片70 mg硒酵母中含硒量計)]購自牡丹江靈泰藥業有限公司,維生素D3注射液(國藥準字H31021404,1 mL∶7.5 mg)購自上海通用藥業股份有限公司,豬甲狀腺球蛋白(pTG)、磷酸緩沖鹽溶液(PBS),完全弗氏佐劑(CFA)、不完全弗氏佐劑(IFA)均購自美國Sigma 公司,大鼠游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)酶聯免疫吸附法(ELISA)檢測試劑盒均購自南京建成生物工程研究所,促甲狀腺激素(TSH)、甲狀腺球蛋白抗體(TGAb)、甲狀腺過氧化物酶抗體(TPOAb)ELISA試劑盒均購自武漢基因美生物科技有限公司,大鼠干擾素-γ(IFN-γ)、白細胞介素(IL)-4 ELISA試劑盒均購自美國R&D公司,反轉錄試劑盒購自日本TOYOBO 公司,PCR 試劑盒購自美國KAPA Biosystems 公司,兔抗大鼠p38MAPK、p-p38MAPK、環氧合酶-2(COX-2)單抗,辣根過氧化物酶標記的羊抗兔IgG 均購自美國Cell Signaling Technology 公司,ELX8000酶標儀、電泳儀購自美國Bio-rad公司,PCR儀購自瑞士Roche公司。
1.2 方法
1.2.1 EAT 大鼠模型建立及分組 將10 mg pTG 溶解于5 mL PBS 中,再與5 mL CFA 混合,充分乳化,制成抗原含量為1 g/L的pTG乳化劑備用;稱體質量后采用隨機數字表法抽取45 只大鼠參與建模,pTG 乳化劑按1 mL/kg 體質量于大鼠足墊及背部皮下多點注射,每周1 次,連續2 周,為初次免疫。2 周后采用同法加強免疫:取pTG 與IFA 混合充分乳化制成乳化劑備用,pTG 乳化劑按1 mL/kg 體質量于大鼠皮下多點注射,每周1 次,連續4 周。大鼠造模期間避光,不限量飲用0.05%碘化鉀水。加強免疫2 周后,建模大鼠眶靜脈取血1 mL/只,檢測血清TPOAb 水平,TPOAb 滴度≥60 IU/mL 為建模成功[6]。其余10 只大鼠為對照組,前2 周按1 mL/kg 體質量皮下多點注射CFA 和PBS等體積混合的乳化劑,后4周按1 mL/kg 體質量皮下多點注射IFA 和PBS 等體積混合的乳化劑。建模成功大鼠(40只)采用隨機數字表法分為模型組、硒酵母組、維生素D組和硒酵母組+維生素D聯合組(聯合組),每組10只。
1.2.2 給藥方法 加強免疫4周后進行藥物干預,將40片硒酵母片碾碎溶于100 mL生理鹽水,配制成20 g/L硒酵母溶液備用。對照組和模型組:生理鹽水灌胃(10 mL/kg,1次/d)+腹腔注射生理鹽水(0.67 mL/kg,隔天1次)。硒酵母組:硒酵母溶液灌胃(10 mL/kg,1次/d)+腹腔注射生理鹽水(0.67 mL/kg,隔天1次);維生素D組:生理鹽水灌胃(10 mL/kg,1次/d)+腹腔注射維生素D3注射液(0.67 mL/kg,隔天1 次);聯合組:硒酵母溶液灌胃(10 mL/kg,1次/d)+腹腔注射維生素D3注射液(0.67 mL/kg,隔天1次)。各組均連續給藥6周。
1.2.3 血清FT3、FT4、TSH、TGAb、TPOAb、IFN-γ、IL-4 檢測 末次干預后禁食12 h,腹主動脈采血5 mL 置于離心管中靜置1 h,3 000 r/min 離心10 min(離心半徑12 cm)取上清,-20 ℃保存。取保存血清,按照ELISA試劑盒說明書測定血清FT3、FT4、TSH、TGAb、TPOAb、IFN-γ、IL-4,用酶標儀在450 nm 波長測量各樣品孔吸光度值,繪制標準曲線,計算待測樣品各指標濃度。
1.2.4 甲狀腺病理學形態觀察 采血完畢處死大鼠并置于載物臺上,充分暴露頸部,分離雙側甲狀腺組織,左側甲狀腺置于10%中性福爾馬林固定72 h,右側甲狀腺置于液氮中保存備用。取固定甲狀腺組織約1.5 cm×1.5 cm×0.3 cm,脫水浸蠟包埋,切成5 μm薄片,脫蠟,常規蘇木精-伊紅染色法(HE)染色,中性樹膠封固后置于光鏡下觀察。
1.2.5 甲狀腺組織中p38MAPK、COX-2 mRNA相對表達量檢測 取液氮保存的甲狀腺組織80 mg,研磨后Trizol法提取總RNA,測定RNA 純度及濃度,取適量RNA 為模板,按照反轉錄試劑盒說明書反轉錄cDNA,進行實時熒光定量PCR(qPCR)擴增。反應體系:上、下游引物各1 μL,2 μL 模板cDNA,10 μL SYBR Premix ExTaq Ⅱ(2×),加雙蒸水至總體積20 μL。反應條件:94 ℃預變性30 s;94 ℃變性5 s,55 ℃退火30 s,35個循環。以β-actin為內參基因,采用2-ΔΔCt法計算目的基因的相對表達量,每個樣本做3次,取Ct平均值。引物序列見表1。
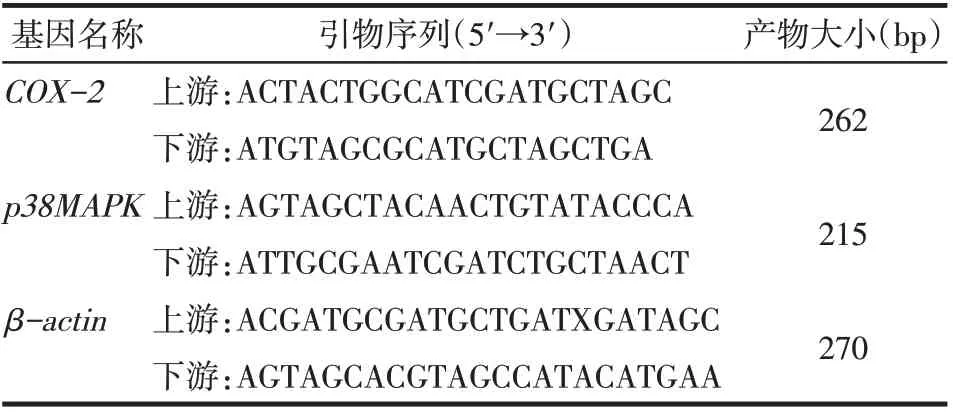
Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.2.6 甲狀腺組織中p38MAPK、p-p38MAPK、COX-2蛋白相對表達量檢測 取液氮保存甲狀腺組織80 mg,加入裂解液冰上孵育30 min,提取組織總蛋白,BAC法測定蛋白濃度,稀釋蛋白樣品,蛋白變性,上樣。100 V電泳2 h,轉至硝酸纖維素膜,5%脫脂牛奶搖床封閉2 h,加入稀釋的一抗p38MAPK(1∶1 000)、p-p38MAPK(1∶1 000)、COX-2(1∶1 000)和βactin(1∶1 000)4 ℃搖床過夜,洗膜,加入辣根過氧化物酶標記的二抗(1∶5 000),室溫搖床封閉2 h,加ECL試劑反應后壓片、顯影、定影,采用Image J軟件分析灰度值,與β-actin內參灰度做比值進行分析。
1.3 統計學方法 采用SPSS 22.0 統計學軟件進行數據分析,計量資料均以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較采用SNK-q 檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組血清FT3、FT4、TSH、TGAb、TPOAb 水平比較 與對照組相比,模型組、硒酵母組、維生素D組和聯合組FT3、FT4、TSH、TGAb、TPOAb水平均升高(P<0.05);與模型組比較,硒酵母組、維生素D組、聯合組FT3、FT4、TSH、TGAb、TPOAb水平均降低(P<0.05);與硒酵母組、維生素D組比較,聯合組FT3、FT4、TSH、TGAb、TPOAb水平均降低(P<0.05);硒酵母組與維生素D組FT3、FT4、TSH、TGAb、TPOAb水平比較,差異無統計學意義(P>0.05)。見表2。
Tab.2 Comparison of serum levels of FT3,FT4,TSH,TGAb and TPOAb between five groups of rats表2 5組大鼠血清FT3、FT4、TSH、TGAb、TPOAb水平比較 (n=10,±s)
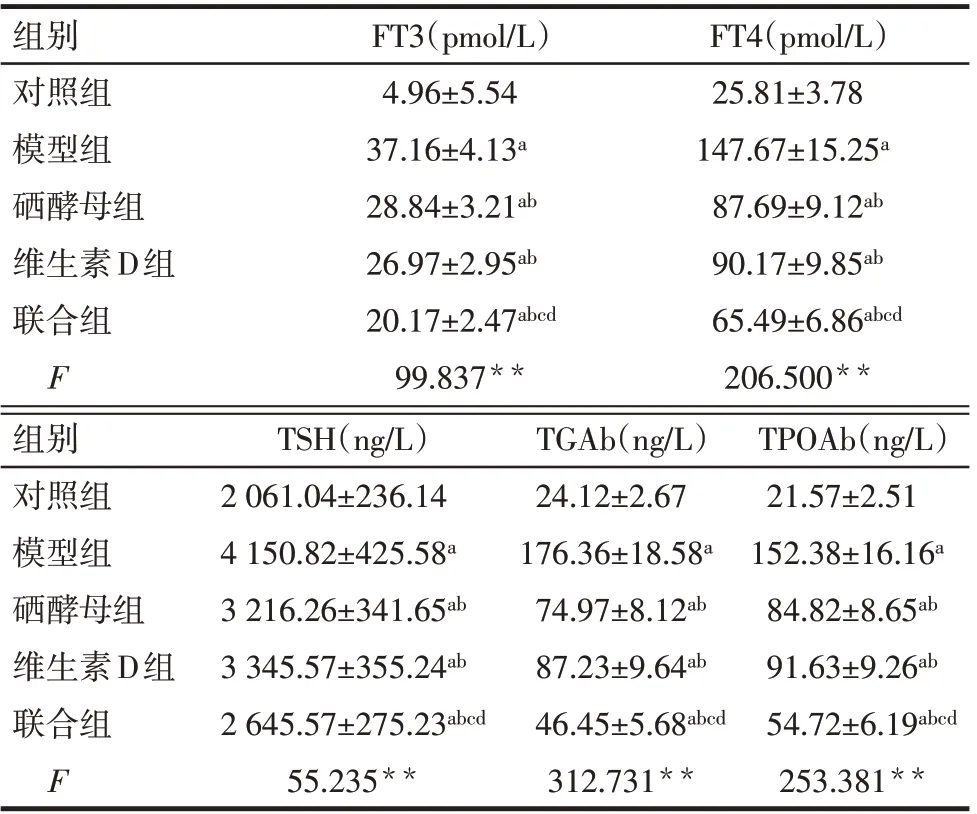
Tab.2 Comparison of serum levels of FT3,FT4,TSH,TGAb and TPOAb between five groups of rats表2 5組大鼠血清FT3、FT4、TSH、TGAb、TPOAb水平比較 (n=10,±s)
**P<0.01;a與對照組比較,b與模型組比較,c與硒酵母組比較,d與維生素D組比較,P<0.05
組別對照組模型組硒酵母組維生素D組聯合組F FT3(pmol/L)4.96±5.54 37.16±4.13a 28.84±3.21ab 26.97±2.95ab 20.17±2.47abcd 99.837**FT4(pmol/L)25.81±3.78 147.67±15.25a 87.69±9.12ab 90.17±9.85ab 65.49±6.86abcd 206.500**組別對照組模型組硒酵母組維生素D組聯合組F TSH(ng/L)2 061.04±236.14 4 150.82±425.58a 3 216.26±341.65ab 3 345.57±355.24ab 2 645.57±275.23abcd 55.235**TGAb(ng/L)24.12±2.67 176.36±18.58a 74.97±8.12ab 87.23±9.64ab 46.45±5.68abcd 312.731**TPOAb(ng/L)21.57±2.51 152.38±16.16a 84.82±8.65ab 91.63±9.26ab 54.72±6.19abcd 253.381**
2.2 各組甲狀腺病理組織學形態 HE染色結果顯示,對照組可見甲狀腺濾泡排列規則緊密,膠質豐富分布均勻,濾泡間無淋巴細胞浸潤,無纖維化。模型組甲狀腺濾泡結構嚴重破壞,形態不規則,部分濾泡萎縮,膠質稀少且分布不均,濾泡間可見大量淋巴細胞浸潤,周圍可見纖維組織增生。硒酵母組和維生素D組濾泡形態較完整,可見部分濾泡結構破壞,膠質減少,濾泡間可見淋巴細胞浸潤,與模型組比有一定改善。聯合組濾泡形態大部分較規則,膠質較多,濾泡間可見少量淋巴細胞浸潤,濾泡破壞及淋巴細胞浸潤較模型組有顯著改善。見圖1。
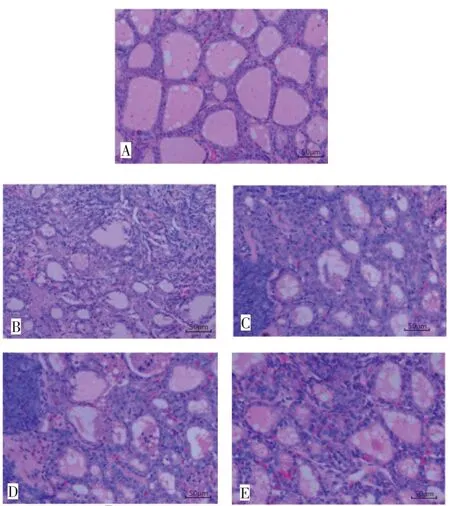
Fig.1 Comparison of histopathological changes of thyroid gland between five groups of rats(HE,×200)圖1 5組大鼠狀腺組織病理學變化比較(HE,×200)
2.3 各組大鼠血清IFN-γ、IL-4、IFN-γ/IL-4水平比較 與對照組比較,模型組、硒酵母組、維生素D組、聯合組IFN-γ、IFN-γ/IL-4水平均升高,IL-4水平均降低(P<0.05);與模型組比較,硒酵母組、維生素D組、聯合組IFN-γ、IFN-γ/IL-4 水平均降低,IL-4 水平均升高(P<0.05);與硒酵母組、維生素D組比較,聯合組IFN-γ、IFN-γ/IL-4水平均降低,IL-4水平升高(P<0.05);硒酵母組與維生素D 組IFN-γ、IL-4、IFN-γ/IL-4 水平比較,差異無統計學意義(P>0.05)。見表3。
Tab.3 Comparison of serum levels of IFN-γ,IL-4 and IFN-γ/IL-4 between five groups of rats表3 5組大鼠血清IFN-γ、IL-4、IFN-γ/IL-4水平比較(n=10,±s)
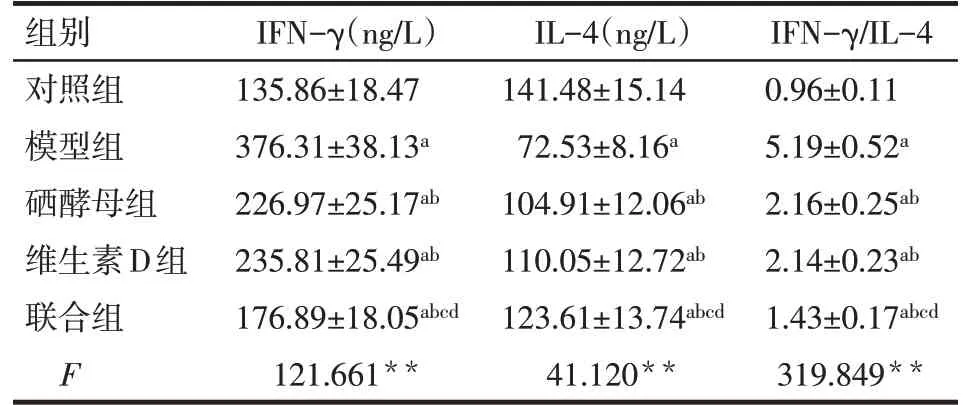
Tab.3 Comparison of serum levels of IFN-γ,IL-4 and IFN-γ/IL-4 between five groups of rats表3 5組大鼠血清IFN-γ、IL-4、IFN-γ/IL-4水平比較(n=10,±s)
**P<0.01;a與對照組比較,b與模型組比較,c與硒酵母組比較,d與維生素D組比較,P<0.05
組別對照組模型組硒酵母組維生素D組聯合組F IFN-γ(ng/L)135.86±18.47 376.31±38.13a 226.97±25.17ab 235.81±25.49ab 176.89±18.05abcd 121.661**IL-4(ng/L)141.48±15.14 72.53±8.16a 104.91±12.06ab 110.05±12.72ab 123.61±13.74abcd 41.120**IFN-γ/IL-4 0.96±0.11 5.19±0.52a 2.16±0.25ab 2.14±0.23ab 1.43±0.17abcd 319.849**
2.4 各組大鼠甲狀腺組織中p38MAPK、COX-2 mRNA 水平比較 與對照組比較,模型組、硒酵母組、維生素D組、聯合組COX-2 mRNA相對表達量均升高(P<0.05);與模型組比較,硒酵母組、維生素D組、聯合組COX-2 mRNA 相對表達量均降低(P<0.05);與硒酵母組、維生素D組比較,聯合組COX-2 mRNA 相 對 表 達 量 均 降 低(P<0.05)。 各 組p38MAPK mRNA 相對表達量比較差異無統計學意義(P>0.05)。見表4。
Tab.4 Comparison of p38MAPK and COX-2 mRNA levels in thyroid tissues between five groups of rats表4 5組大鼠甲狀腺組織中p38MAPK、COX-2 mRNA水平比較 (n=10,±s)
Tab.4 Comparison of p38MAPK and COX-2 mRNA levels in thyroid tissues between five groups of rats表4 5組大鼠甲狀腺組織中p38MAPK、COX-2 mRNA水平比較 (n=10,±s)
**P<0.01;a與對照組比較,b與模型組比較,c與硒酵母組比較,d與維生素D組比較,P<0.05
組別對照組模型組硒酵母組維生素D組聯合組F p38MAPK 1.00±0.00 1.08±0.12 1.03±0.11 1.05±0.12 1.07±0.11 0.972 COX-2 1.00±0.00 1.96±0.15a 1.57±0.13ab 1.65±0.15ab 1.28±0.12abcd 3.067**
2.5 各組大鼠甲狀腺組織中p38MAPK、pp38MAPK、COX-2 蛋白水平比較 與對照組比較,模型組、硒酵母組、維生素D 組、聯合組pp38MAPK、COX-2 蛋白相對表達量均升高(P<0.05);與模型組比較,硒酵母組、維生素D 組、聯合組p-p38MAPK、COX-2蛋白相對表達量均降低(P<0.05);與硒酵母組、維生素D 組比較,聯合組pp38MAPK、COX-2 蛋白相對表達量均降低(P<0.05);硒酵母組與維生素D 組p-p38MAPK、COX-2蛋白相對表達量比較差異無統計學意義(P>0.05)。各組p38MAPK 蛋白相對表達量比較差異無統計學意義(P>0.05)。見表5、圖2。
Tab.5 Comparison of p38MAPK,p-p38MAPK and COX-2 protein levels in thyroid tissues between five groups of rats表5 5組大鼠甲狀腺組織中p38MAPK、p-p38MAPK、COX-2蛋白水平比較 (n=10,±s)
Tab.5 Comparison of p38MAPK,p-p38MAPK and COX-2 protein levels in thyroid tissues between five groups of rats表5 5組大鼠甲狀腺組織中p38MAPK、p-p38MAPK、COX-2蛋白水平比較 (n=10,±s)
**P<0.01;a與對照組比較,b與模型組比較,c與硒酵母組比較,d與維生素D組比較,P<0.05
組別對照組模型組硒酵母組維生素D組聯合組F p38MAPK 1.06±0.11 1.05±0.12 1.07±0.10 1.10±0.11 1.09±0.10 0.367 p-p38MAPK 0.15±0.02 0.98±0.13a 0.73±0.08ab 0.76±0.07ab 0.28±0.04abcd 202.732**COX-2 0.21±0.02 0.95±0.10a 0.63±0.07ab 0.67±0.08ab 0.32±0.05abcd 180.331**
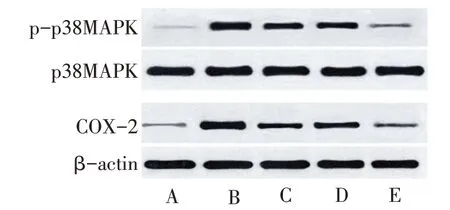
Fig.2 Comparison of p38MAPK,p-p38MAPK and COX-2 protein levels in thyroid tissues between five groups of rats圖2 5組大鼠甲狀腺組織中p38MAPK、p-p38MAPK、COX-2蛋白水平比較
3 討論
甲狀腺是人體最大的內分泌器官,由濾泡上皮細胞組成,其主要功能是合成甲狀腺激素,調節機體平衡。AIT 是器官特異性自身免疫性疾病,由于機體異常識別自身抗原,引起淋巴細胞侵入并攻擊甲狀腺組織,從而導致甲狀腺功能受損。目前臨床治療AIT 多為甲狀腺激素的替代治療,但激素替代療法無法阻止甲狀腺的破壞,且易合并其他自身免疫性疾病[7]。因此,尋找新的治療方法對早期干預AIT有重要意義。硒在甲狀腺組織中具有重要作用,通過補硒治療,可有效緩解AIT病情[8]。維生素D及其代謝產物對于自身免疫類疾病有良好的調節作用,可以阻止AIT 病理發展[9]。故本研究選取常用的補硒制劑硒酵母片及維生素D3注射液,觀察其對EAT的緩解作用,探討其作用機制。
FT3、FT4、TSH 主要反映甲狀腺功能是否異常,TGAb、TPOAb 則是甲狀腺自身抗體,在AIT 發病過程中有重要作用,是反映甲狀腺自身免疫病的特異性指標。本研究中模型組大鼠表現出典型EAT 癥狀,經治療后,HE染色顯示硒酵母組、維生素D組及聯合組甲狀腺組織病理形態都較模型組有顯著改善,其中聯合組改善效果最明顯;同時與模型組比較,硒酵母組、維生素D 組及聯合組血清FT3、FT4、TGAb、TPOAb 水平顯著下降,其中以聯合組下降最明顯,提示硒酵母和維生素D 能有效抑制EAT 的進展。Pirola 等[10]發現補硒治療可顯著降低AIT 患者患者TPOAb 水平,有效緩解病情。Krysiak 等[11-12]發現AIT 患者服用維生素D 后,TPOAb 滴度、TSH、TGAb 水平較未服用者顯著降低。本研究與上述研究結果相一致,表明硒和維生素D 均可有效改善EAT大鼠癥狀,減輕甲狀腺組織損傷,保護甲狀腺功能,且兩者聯合應用效果更好。
AIT 發生與Th1/Th2 細胞失衡存在密切關系,AIT 發展過程中以Th1 細胞因子優勢表達,其中IFN-γ 是Th1 細胞的特征分子,本研究中模型組大鼠IFN-γ/IL-4 明顯升高,提示處于Th1/Th2 細胞失衡狀態,與既往研究結果相符[13-14]。MAPK 信號通路在炎癥反應過程中起重要作用,p38MAPK是其重要成員,當細胞受到各種因素刺激時可以磷酸化形成p-p38MAPK,p-p38MAPK 引起核轉錄因子κB 活化,進而促進白細胞介素等炎癥因子表達,p38MAPK 作為上游調節因子,調節下游COX-2 表達,COX-2 表達增加刺激炎癥因子產生,介導全身炎癥反應[15]。本研究發現,經治療后,硒酵母組、維生素D 組及聯合組IFN-γ/IL-4 顯著下降,COX-2 mRNA 及蛋白、p-p38MAPK 蛋白表達顯著下降,提示硒酵母和維生素D可顯著調節Th1/Th2細胞失衡,可能是通過下調p38MAPK 及COX-2 表達從而抑制MAPK信號通路發揮調節作用。
綜上所述,硒酵母聯合維生素D 可有效改善EAT大鼠癥狀,減輕甲狀腺組織損傷,保護甲狀腺功能,其機制可能是通過抑制MAPK 信號通路調節Th1/Th2平衡來發揮調控作用。

