葉黃素通過SIRT1/NLRP3信號通路提高人視網膜色素上皮細胞存活率的機制研究
萬芳,馬利方
糖尿病是一種與糖代謝異常相關的嚴重代謝綜合征,可引起血管、心臟、神經、眼、肝臟和腎臟等多種組織和器官的慢性損傷和功能障礙。其中,糖尿病視網膜病變(diabetic retinopathy,DR)和黃斑病變是糖尿病的微血管并發癥,可致視力永久性受損乃至失明[1]。視網膜色素上皮細胞(retinal pigment epithelial cells,RPECs)在視網膜中具有許多重要的功能,包括光感受器外段的吞噬作用、類視黃醇的異構化以及各種代謝和神經營養支持功能[2],并與視網膜病變密切相關。血糖過高是DR 發病的關鍵因素。研究表明,高糖可誘導促炎性細胞因子過度生成,同時可增加細胞內活性氧(reactive oxygen species,ROS)的產生,從而誘導炎癥反應與氧化應激反應[3-5]。葉黃素,又稱植物黃體素,是一種類胡蘿卜素,在蔬菜、水果、花卉等植物中廣泛存在[6],也是存在于人眼視網膜黃斑區的主要色素[7]。葉黃素具有防止光氧化和光破壞的保護作用,被認為是一種有效的抗氧化劑。據報道,葉黃素具有多種藥理特性,包括抗氧化[8-9]、抗炎[10]和抗癌[11-12]等。此外,葉黃素還能通過調節抗氧化活性等信號通路來預防因衰老誘發的視網膜功能下降[13],但目前尚不清楚葉黃素是否對DR 起治療作用。本研究以RPECs 為研究對象,旨在探討葉黃素對高濃度葡萄糖環境中RPECs的潛在影響,包括炎癥因子的表達、ROS的產生及其分子機制,為葉黃素治療DR提供理論依據。
1 材料與方法
1.1 細胞株、主要試劑與儀器 人視網膜色素上皮細胞ARPE-19 購于武漢普諾賽生命科技有限公司。RPMI-1640培養基(美國Thermo公司,C22400500BT),胎牛血清(FBS,以色列BI 公司,04-001-1-A),葉黃素(美國Sigma 公司,07168),CCK-8 試劑盒(北京博奧森生物技術有限公司,BA00208),RNA 提取試劑盒(美國Thermo 公司,12183020),實時熒光定量聚合酶鏈式反應(qPCR)試劑盒(武漢優博生物技術有限公司,DN001),腫瘤壞死因子-α(TNF-α)酶聯免疫吸附試驗(ELISA)試劑盒(ab181421)、白細胞介素(IL)-1β ELISA試劑盒(ab100562)、IL-6 ELISA試劑盒(ab46027)、IL-18 ELISA 試劑盒(ab215539)均購自英國Abcam 公司,5-(和-6)-氯甲基-2,7-二氯二氫熒光素二乙酸酯(CMH2DCFDA)探針(美國Sigma公司,D6883)。CO2培養箱(日本SANYO公司,MCO-15AC),倒置顯微鏡(CX41)、激光共聚焦顯微鏡(日本Olympus公司),核酸蛋白檢測儀、qPCR儀(美國Thermo 公司),SDS-PAGE 微型凝膠電泳及轉膜設備(美國BIO-RAD 公司),全自動化學發光圖像分析系統(上海天能科技有限公司,Tanon-5200),低溫高速離心機(德國Sartorius公司,3k30),Multiskan酶標儀(美國Thermo公司)。
1.2 方法
1.2.1 實驗分組 為確定葡萄糖對RPECs 活性的影響及處理條件,在ARPE-19細胞培養基中添加不同濃度的葡萄糖,即15、30、60、90 mmol/L 葡萄糖組,并設對照組(未添加葡萄糖),最終確定在后續實驗中使用的葡萄糖處理組被命名為葡萄糖組;為確定葉黃素對RPECs 活性的影響及處理條件,在葡萄糖組ARPE-19 細胞培養基中添加不同濃度的葉黃素,即5、10、20 μmol/L 葉黃素組、葡萄糖組(未添加葉黃素)和對照組(未添加葉黃素和葡萄糖),最終確定在后續實驗中使用的葉黃素處理組被命名為葉黃素組。
1.2.2 細胞培養 ARPE-19 細胞復蘇后,使用添加10%FBS、1%青霉素/鏈霉素的RPMI-1640 培養基,置于5%CO2、飽和增濕、37 ℃恒溫培養箱中培養。約1~2 d換液1次,細胞生長融合至85%時,使用0.25%胰蛋白酶消化細胞,用完全培養基終止消化后,以1∶3 比例傳代,取對數生長期的4~6代細胞用于實驗。實驗前,將ARPE-19 細胞在37 ℃、1%FBS的RPMI-1640培養基中培養12 h。
1.2.3 CCK-8檢測細胞增殖活性 在96孔板中接種ARPE-19 細胞懸液(每孔100 μL,約5 000 個細胞),置于37 ℃、5%CO2培養箱中培養。24 h 后,向各孔中加入10 μL 不同濃度的葡萄糖溶液、葉黃素溶液,并設置空白對照組,每組設4 個平行復孔。將培養板置于培養箱孵育48 h 后,每孔加入10 μL CCK-8溶液,加液過程中避免產生氣泡。培養板放培養箱孵育2 h 后,用酶標儀測定450 nm 處的吸光度(A)值。計算公式:細胞存活率(%)=[A(加藥)-A(空白)]/[A(對照)-A(空白)]×100%。
1.2.4 ELISA 檢測炎性細胞因子水平 將ARPE-19 細胞以(1.0~1.5)×104個/mL 的密度接種在96 孔板中,并在37 ℃、5%CO2培養箱中培養。12 h后,收集培養基,使用ELISA試劑盒,根據說明書對培養基中TNF-α、IL-1β、IL-18 和IL-6 的含量進行測量。
1.2.5 CM-H2DCFDA 探針法檢測細胞內ROS 水平 在用細胞滲透性CM-H2DCFDA 孵育ARPE-19 細胞后,檢測細胞內的ROS 水平。檢測原理為:在ROS 存在的條件下,CMH2DCFDA 將轉化為2’,7’-二氯熒光素(DCF)。將細胞以(1.0~1.5)×107個/mL 的密度接種在6 孔板中。30 mmol/L 葡萄糖或24.4 mmol/L 甘露醇處理細胞12 h 后,添加10 μmol/L CM-H2DCFDA 和1 μg/L DAPI,在不含FBS 的RPMI-1640 培養基中培養20 min。使用添加10%FBS 的RPMI-1640 培養基清洗細胞后,用激光掃描共焦顯微鏡進行拍攝。在6個隨機視野中測量熒光強度,并使用Image J 1.41進行分析。
1.2.6 qPCR檢測mRNA水平 收集各組ARPE-19細胞,使用RNA提取試劑盒提取細胞總RNA,并使用核酸蛋白檢測儀測定RNA的質量和濃度。使用逆轉錄試劑盒將mRNA合成為cDNA后,分別使用SIRT1與NLRP3的特異性引物進行PCR擴增,反應體系為:cDNA 1 μL,上下游引物各1 μL,2×Green Mix 10 μL,去離子水7 μL。反應條件設置為:94 ℃2 min;94 ℃10 s,58 ℃15 s,72 ℃10 s,40個循環。以GAPDH為內參,使用相對定量2-ΔΔCt法計算各組ARPE-19細胞中SIRT1與NLRP3的相對表達水平。SIRT1引物:上游5'-GGAGCAGATTAGTAGGCGGC-3';下游5'-CCTCAGCGCCATGGAAAATG-3',產物大小80 bp。NLRP3引物:上 游5'-GGCAACACTCTCGGAGACAA-3' ;下 游5'-GGAAAGATCCCAGCAGCAGT-3',產物大小126 bp。GAPDH引物:上 游5'-GTCAAGGCTGAGAACGGGAA-3' ;下 游5'-GCCTTCTCCATGGTGGTGAA-3',產物大小146 bp。
1.3 統計學方法 使用GraphPad Prism 6.0 進行統計分析。所有數據均為4 次獨立重復實驗的平均值,以x±s表示,多組間比較采用單因素方差分析,組間多重比較采用Tukey-Kramer檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 高濃度葡萄糖誘導對ARPE-19 細胞增殖活性的影響 15、30、60、90 mmol/L 葡萄糖組和對照組ARPE-19 細 胞 存 活 率 分 別 為(92.10±3.60)% 、(69.06±1.83)%、(44.22±0.73)%、(42.18±0.68)%和(96.20±2.39)%,多組間比較差異有統計學意義(F=566.072,P<0.01)。15 mmol/L葡萄糖組與對照組比較差異無統計學意義(P>0.05),而30、60 與90 mmol/L 葡萄糖組較對照組顯著降低(P<0.05)。選取30 mmol/L葡萄糖作為高糖實驗濃度。
2.2 高濃度葡萄糖對ARPE-19細胞炎癥因子、ROS水平及細胞存活率的影響 葡萄糖組IL-1β、IL-6、IL-18、TNF-α 和ROS 水平均顯著高于對照組(P<0.05),而細胞存活率低于對照組(P<0.05),見表1。
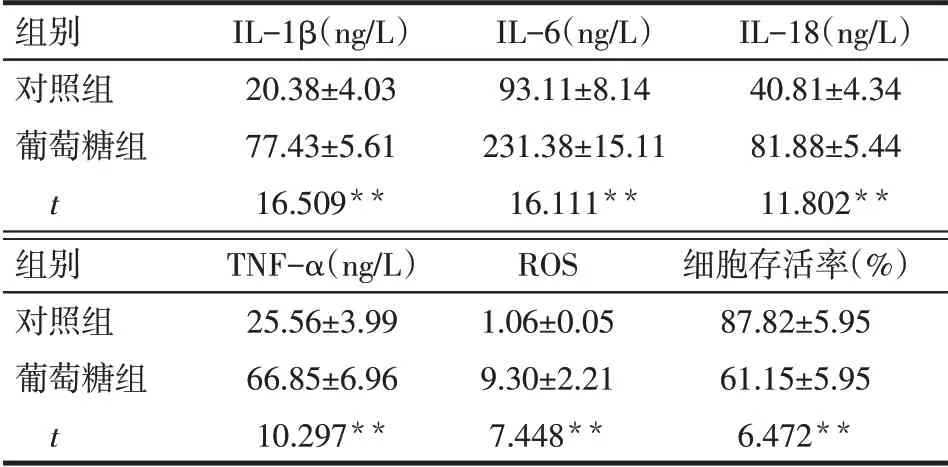
Tab.1 Comparison of inflammatory factors,ROS levels and cell viability between glucose treatment group and control group表1 對照組與葡萄糖組炎癥因子、ROS水平及細胞存活率的比較 (n=4,x±s)
2.3 葉黃素對ARPE-19細胞炎癥因子、ROS水平的影響 與葡萄糧組相比,5 μmol/L 的葉黃素處理無法改善細胞內炎性細胞因子水平和ROS 水平(P>0.05)。10 μmol/L葉黃素組與葡萄糖組相比較,僅細胞內的ROS 水平顯著降低(P<0.05)。20 μmol/L 葉黃素組較葡萄糖組IL-1β、IL-6、IL-18、TNF-α 和ROS 水平均顯著降低(P<0.05),見表2。選取20 mmol/L葉黃素作為后續實驗濃度。
2.4 葉黃素對ARPE-19 細胞SIRT1/NLRP3 信號通路和細胞存活率的影響 與對照組相比,葡萄糖組細胞中的NLRP3mRNA 表達水平顯著升高,細胞存活率降低(P<0.05),而SIRT1mRNA 表達水平差異無統計學意義(P>0.05)。與葡萄糖組比較,葉黃素組SIRT1mRNA 表達水平和細胞存活率顯著上調,而NLRP3mRNA 表達水平顯著下調(P<0.05),見表3。
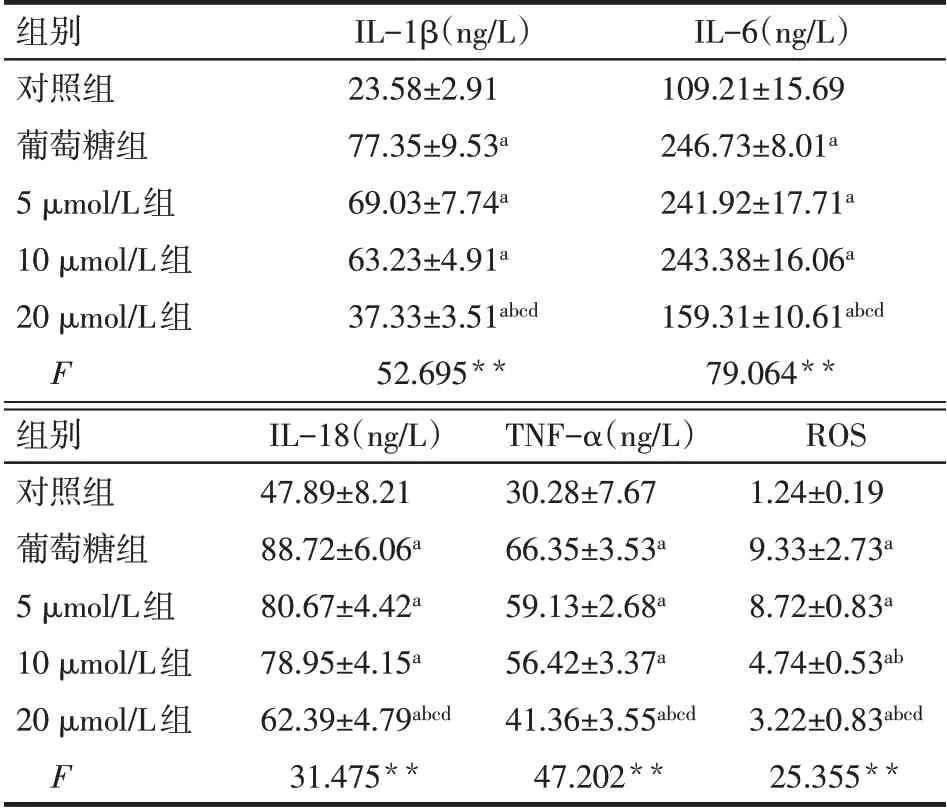
Tab.2 Comparison of inflammatory factors and ROS levels between the five groups表2 各組中炎癥因子和ROS水平的比較(n=4,x±s)
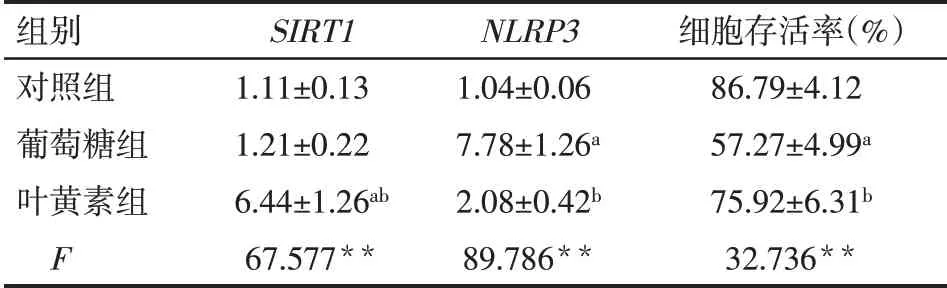
Tab.3 Comparison of SIRT1,NLRP3 mRNA and cell viability between the three groups表3 各組中SIRT1、NLRP3 mRNA和細胞存活率的比較(n=4,x±s)
3 討論
3.1 高濃度葡萄糖促進RPECs 炎癥因子產生 DR已經成為糖尿病最常見的微血管并發癥之一,其中RPECs功能障礙被認為與DR的發病密切相關[14-15]。其病理機制可能是高血糖誘發視網膜炎癥和氧化應激,導致RPECs 活性顯著降低,誘導細胞凋亡發生[16-17]。DR 患者普遍存在炎性細胞因子水平顯著增加的情況[18]。研究發現,高濃度的葡萄糖會增加RPECs中炎性細胞因子的產生[19-20]。與上述報道一致,本研究結果表明,高糖處理人視網膜色素上皮細胞ARPE-19 可以誘導細胞TNF-α、IL-1β、IL-6 和IL-18分泌顯著增加。
3.2 氧化應激調控炎癥反應 過氧化應激是炎癥反應的重要誘發因素。在人類多種炎癥疾病中均可以觀察到高水平的ROS 生成,細胞處于過氧化應激狀態,誘導炎癥反應發生。糖尿病時高血糖狀態下的多種合并癥,包括糖尿病足,神經、腎、骨骼、心血管等系統的并發癥均與過氧化應激及炎癥反應密切相關[21-23]。本研究顯示,高血糖誘導RPECs 過氧化應激與炎性細胞因子表達顯著增高,與既往在糖尿病患者視網膜病變的研究結果一致[24]。
SIRT1是Sirtuin家族成員之一,可以通過調控線粒體的生物合成等調節細胞內ROS 水平[25]。而NLRP3是炎癥小體家族成員,可以通過激活促炎性細胞因子IL-1β 等誘發炎癥反應,促進炎性細胞凋亡[26]。SIRT1在多個組織中被證明可以負調控NLRP3[27-28],但是兩者在RPECs 中的關系還未被揭示。本研究結果表明,SIRT1可以抑制NLRP3的激活,從而改善高糖環境中RPECs的活性。
3.3 葉黃素提高RPECs活性 有證據表明,葉黃素對人體健康尤其是眼的健康具有多種有益作用[29]。葉黃素可以預防和改善與年齡有關的黃斑疾病。本研究表明,葉黃素可以通過激活SIRT1降低氧化應激水平,下調NLRP3表達,抑制炎性細胞因子,改善RPECs活性。盡管當前研究僅在細胞水平上證明了葉黃素對高糖環境中RPECs 活性的改善作用,但是既往已經有小鼠或大鼠模型研究證明,補充葉黃素可顯著改善視網膜的血運重建,提高視力,并對光損傷有明顯保護作用,其可能的機制是淬滅氧自由基以及抑制脂質的過氧化[30-32],這與體外細胞水平研究結果一致。
綜上所述,高濃度葡萄糖在RPECs 中通過激活過氧化應激與炎癥反應降低RPECs 活性,葉黃素可以通過SIRT1/NLRP3通路改善細胞內氧化應激與炎性細胞因子水平,提高高糖環境RPECs活性,本研究結果為DR提供了一種潛在治療策略。

