秦嶺太白山不同林帶土壤微生物呼吸速率及其影響因素
胡 汗,馬寰菲,白紅英,郭垚鑫,任成杰,趙發珠,*
1 陜西省地表系統與環境承載力重點實驗室,西安 710127
2 西北大學城市與環境學院,西安 710127
3 西北大學生命科學學院,西安 710127
4 西北農林科技大學,楊凌 712100
土壤呼吸(RS)是陸地生態系統碳循環的重要環節,也是土壤碳庫向大氣輸出碳的主要途徑[1]。通過土壤呼吸,土壤每年向大氣排放的碳達到68—98 Pg[2],大約是全球化石燃料燃燒所排放的碳的10倍[3]。而森林土壤作為陸地生態系統中最大的有機碳庫(約800—1200 Pg C),其含量約占全球土壤碳庫的40%[4-5],大約是大氣碳庫的1.2倍,植被碳庫的2倍,在全球的碳循環中起到關鍵作用[6-7]。因此,即使森林的土壤呼吸發生微小的變化,都會對大氣中CO2含量和全球的碳平衡產生重大影響[8-9]。降低森林土壤的有機碳排放,增加其固碳能力無疑是研究者目前面對的重要課題[10-11]。
土壤呼吸主要由微生物呼吸和根系呼吸產生[12]。研究表明,根系呼吸提供的CO2在土壤呼吸中占30%—50%[13],但是由于抑制根系呼吸會導致植被冠層光合作用的減弱[14],并且微生物呼吸對溫度等環境因子的變化更為敏感,因此降低土壤的碳排放的關鍵在于抑制土壤微生物呼吸。微生物作為土壤中最活躍的部分,其呼吸作用具有非常明顯的時間與空間上的差異性[15]。較多研究結果表明微生物呼吸是由土壤溫度、土壤濕度、土壤類型等諸多因素的共同控制[16-17]。例如,Stielstra[18]認為土壤溫度和濕度是影響微生物呼吸的重要因子;Liu[19]的研究表明土壤中微生物群落結構的差異會影響微生物呼吸的大小。并且Sinsabaugh[20]的研究證實微生物所分泌的胞外酶是影響微生物呼吸的一個重要因素。但是胞外酶種類繁多,性質迥異,不同類型的胞外酶只能催化其特定的底物水解[21],并且酶活性對溫度的敏感性較高,溫度對酶活性的影響也會輻射到微生物呼吸上[22]。例如,β-N-乙酰氨基葡萄糖酶(β-N-Acetyl-glucosaminidas,簡稱NAG)是用于催化幾丁質水解的末端反應,而在15—35 ℃上其活性持續增加,從而幾丁質在35 ℃時會得到最充分的水解;而β-葡萄糖苷酶(β-glucosidase,簡稱BG)則用于催化結構性的葡萄聚糖水解的末端反應,其活性在25 ℃相對較高,從而葡萄聚糖在25 ℃時水解較為充分[23]。盡管目前對于微生物呼吸變化及其影響因素在眾多生態系統已有所研究報導[24-25],然而在森林生態系統中關于胞外酶變化引起的微生物呼吸及控制溫度等氣候因子后對于微生物呼吸大小的研究鮮見。因此,通過對不同植被帶的土壤進行長期室內培養,闡明土壤微生物呼吸在溫度上的變化規律及其調控因子,探究不同溫度下胞外酶對土壤微生物呼吸的潛在影響,從而揭示在胞外酶驅動下的土壤碳循環特征,為準確預測全球未來氣候變化趨勢提供理論基礎。
太白山作為秦嶺的主峰,是我國南北氣候分界線,也是長江與黃河兩大水系的分水嶺。太白山生物多樣性豐富、植被固碳功能潛力巨大,是我國森林生態系統的典型代表,為開展森林土壤呼吸的研究提供天然的實驗平臺[26];同時太白山擁有著完整的植被帶梯度,特別是海拔1500—2800 m的土壤均為灰棕壤,這也為研究土壤呼吸的空間異質性提供有利條件[27]。本研究選取太白山北坡的不同海拔梯度的植被帶(銳齒櫟林Quercusalienavar.acuteserrata、遼東櫟林Quercusliaotungensis、紅樺林Betulaalbo-sinensis、牛皮樺Betulaalbo-sinensisvar.septen-trionalis)的0—10 cm表層土壤,在不同的溫度下(15、25、35)分別進行恒溫恒濕培養,本研究目標是(1)闡明土壤微生物呼吸在溫度上的變化規律及其調控因子;(2)土壤微生物量、胞外酶在不同溫度下隨著培養時間的變化趨勢;(3)探究在不同溫度下胞外酶和微生物量對土壤微生物呼吸的潛在影響。
2 材料與方法
2.1 研究區概況以及土壤取樣
研究地位于陜西省秦嶺腹地太白山(107°22′—107°51′E,33°49′—34°05′N)。太白山是秦嶺的最高峰,最高海拔3771.2 m,屬于溫帶季風氣候,植被類型豐富,具有完整的植被垂直帶譜,年平均溫度13 ℃,北坡年平均降雨量694.2 mm,主要集中在夏季[27]。我們選取4個沿海拔梯度分布完整、林帶明顯的不同典型垂直植被林帶,分別是屬于落葉闊葉林帶的銳齒櫟(1800 m以下)和遼東櫟(1800—2200 m)與屬于落葉小葉林帶的紅樺林(2200—2500 m)和牛皮樺林(2500—2700 m),且該樣地土壤類型均為以灰棕壤為主[26]。
于2018年7月在太白山北坡選取銳齒櫟林、遼東櫟林、紅樺林、牛皮樺林植被帶上地形、地貌、坡度、坡向基本一致的典型樣地(表1)。在每個海拔高度設置3個25 m×25 m的地塊,每個地塊位于其優勢喬木種附近。具體取樣步驟如下:在每一塊地的棄土層被清除后,用內徑5 cm的螺旋鉆采集10個“S”形相同深度(0—10 cm)的土樣,然后將10個復樣均勻混合,組成一個土樣。在4個海拔高度共采集了12個土壤樣本,每個樣本通過2 mm 的篩網,以清除植物根系和其他碎片。每次使用螺旋鉆后,用無菌紙擦去螺旋鉆和篩網上的殘留物,以避免樣品污染。取完所有樣品后,將每個土壤樣品分為4個部分:第一部分土壤樣品立即送至實驗室測定土壤濕度;第二部分存儲在帶冰袋的便攜式培養箱中,然后送至實驗室,調節至其原始濕度后,在RXM-280A培養箱中以其原位海拔的溫度進行預培養;第三部分儲存在4 ℃冰箱中進行微生物生物量分析;剩余部分在室溫下風干,以確定土壤的基本理化性質。
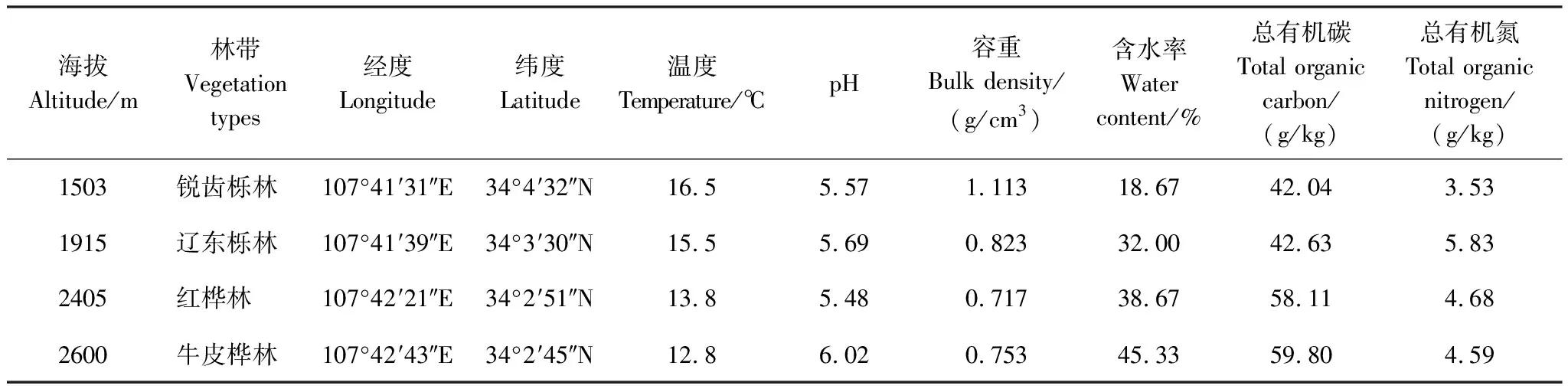
表1 取樣地土壤理化性質
2.2 土壤微生物呼吸及其相關環境因子的測定
將土壤在RXM-280A培養箱中以土壤各自的原位海拔的溫度(表1)進行預培養7 d,然后將土壤以500 g一份,每個林帶稱取18份,共72份,置于培養瓶中。將其均分為3組,調節至60%田間持水量,分別置于15、25、35 ℃下的RXM-280A培養箱進行培養,每個林帶每組有6份,包括測量瓶與取樣瓶(3組重復)。使用Li-8100碳通量測量儀在8點—10點測量土壤呼吸,于1—20 d每天測量一次,于20—47 d每3天測量1次,于47—72 d每5天測量1次。
在1 d、20 d和72 d從取樣瓶中取出土壤,測量相關環境因子指標。土壤濕度是通過對在105 ℃下干燥至恒定質量的土壤樣品進行稱重來測定的;土壤溫度通過便攜式溫度探針測定;土壤pH值是使用Metrohm702自動酸堿滴定儀在1:2.5土壤:水懸浮液以電位法測定;采用環刀法測定土壤容重;使用氯仿熏蒸-K2SO4提取和過硫酸鉀消化法估算土壤微生物生物量碳、氮、磷(MBC、MBN、MBP);采用微孔板熒光法測量土壤中β-N-乙酰氨基葡萄糖酶(β-N-Acetyl-glucosaminidase,EC 3.2.1.52,NAG)、β-葡萄糖苷酶(β-glucosidase,EC 3.2.1.21,BG)、β-木糖苷酶(β-D-xyloside xylohydrolase,EC 3.2.1.37,BX)、纖維二糖水解酶(Cellobiohydrolase,EC 3.2.1.91,CBH)、酸性磷酸酶(Acid phosphatase,EC 3.1.3.2,ACP)、亮氨酸氨基肽酶(Leucine arylamidase,LAP)的活性。
2.3 數據分析
微生物量與胞外酶在不同培養時間下的差異性是通過單因素方差分析(One-way ANOVA)所得。在不同溫度下的土壤呼吸與微生物量和胞外酶的相關性是采取逐步回歸方程進行分析。以上分析均在SPSS中完成。
為了探究微生物呼吸對變暖的響應,我們使用以下方程式計算Q10的值,它表示溫度升高10 ℃,微生物呼吸速率的相對變化的比例[28]:
式中,Ch和Cl分別表示在高溫(Th)和在低溫(Tl)時微生物累積呼吸量。
為了探索不同林帶的土壤微生物在不同溫度下,隨著培養時間的增長,如何調節元素利用效率,我們使用以下方程式計算了TerN和TerP,它將測定的胞外酶活性和微生物量聯系起來以闡明土壤當前的養分限制[29-31]:
式中,BG表示β-葡萄糖苷酶的酶活性,LAP表示亮氨酸氨基肽酶的酶活性,NAG表示β-N-乙酰氨基葡萄糖酶的酶活性,ACP表示酸性磷酸酶的酶活性,MBC、MBN、MBP分別表示微生物量碳、微生物量氮、微生物量磷的量。n0表示lnBG對ln(NAG+LAP)的標準主軸回歸分析(Standardized major axis,SMA)所得的方程的截距,p0表示lnBG對ln ACP的標準主軸回歸分析所得的方程的截距。標準主軸回歸分析是在Rstudio中完成。
3 結果討論
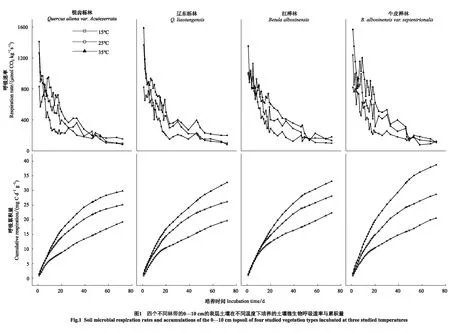
3.1 不同海拔與溫度對土壤微生物呼吸的影響
如圖1所示,在不同的溫度與海拔下,土壤微生物呼吸速率隨著培養時間的增加而減少,呼吸累積量隨著培養時間的增加而增大。微生物呼吸的初始速率在四個林帶上無顯著性差異;在不同的溫度上出現顯著性差異(P<0.05),微生物初始呼吸速率出現35 ℃>25 ℃>15 ℃的現象。在1—20 d期間,微生物呼吸速率處于波動狀態,并在波動中快速下降;在20—72 d期間,微生物呼吸速率隨著培養時間緩慢下降,然后趨于平穩。在20 d與72 d時的微生物呼吸速率相比于初始值平均下降了68%與90%。銳齒櫟林、遼東櫟林和紅樺林在46 d的時候出現在15 ℃與25 ℃下微生物呼吸速率相等的現象,而牛皮樺林是在49 d時出現;紅樺林與牛皮樺林出現25 ℃和35 ℃下的微生物呼吸速率相等的現象的時間是53 d,銳齒櫟林在58 d時出現,遼東櫟林未出現該現象。從相同的溫度看,四個林帶的72 d的呼吸累積量都出現35 ℃>25 ℃>15 ℃的現象;從相同的林帶看,15 ℃與25 ℃的72 d的呼吸累積量無顯著性差異,35 ℃上出現顯著性差異(P<0.05),呼吸累積量出現35 ℃>25 ℃>15 ℃的現象。
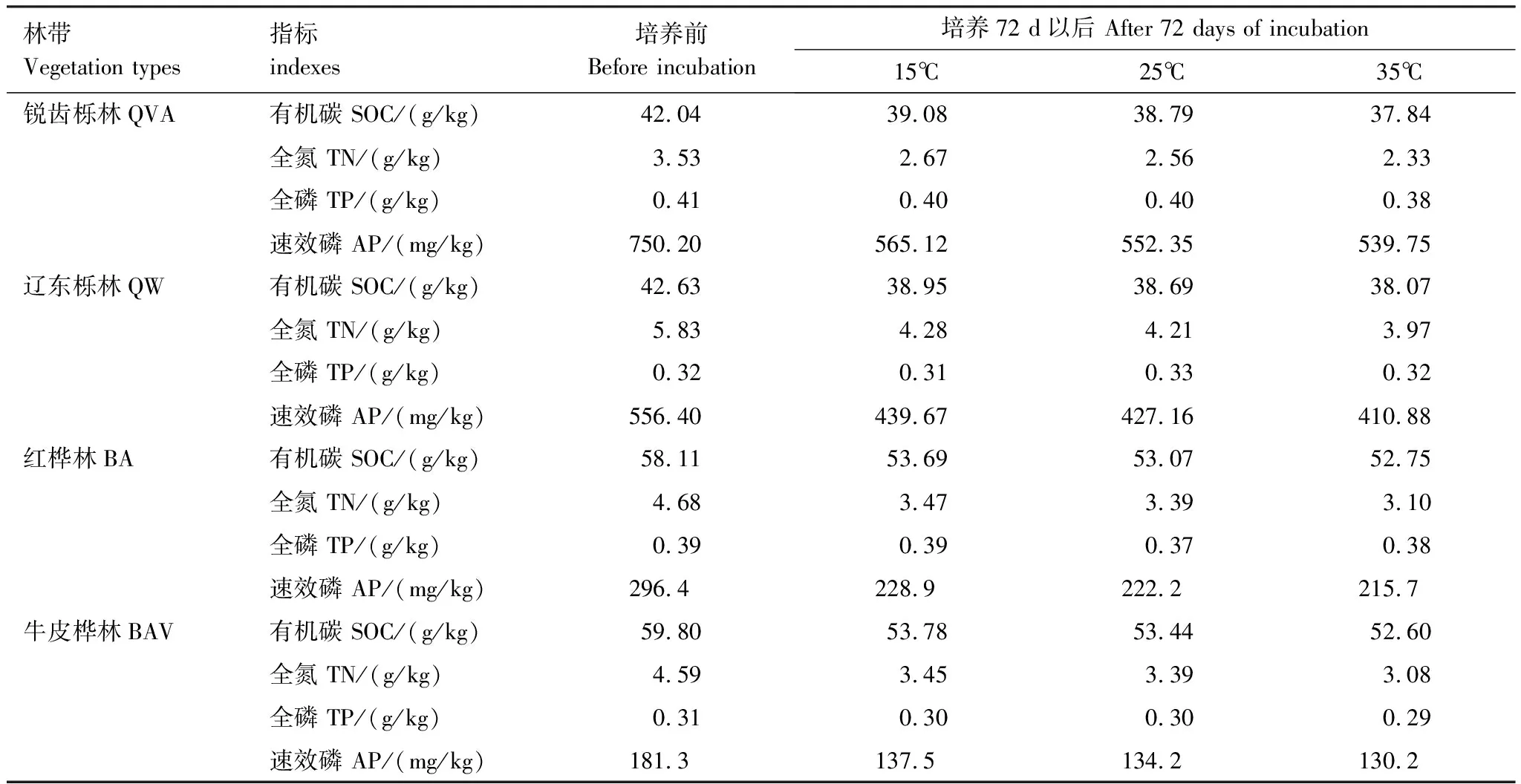
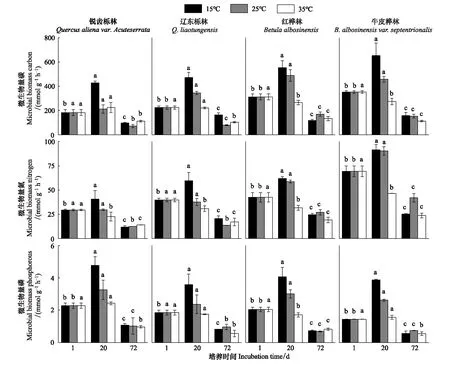
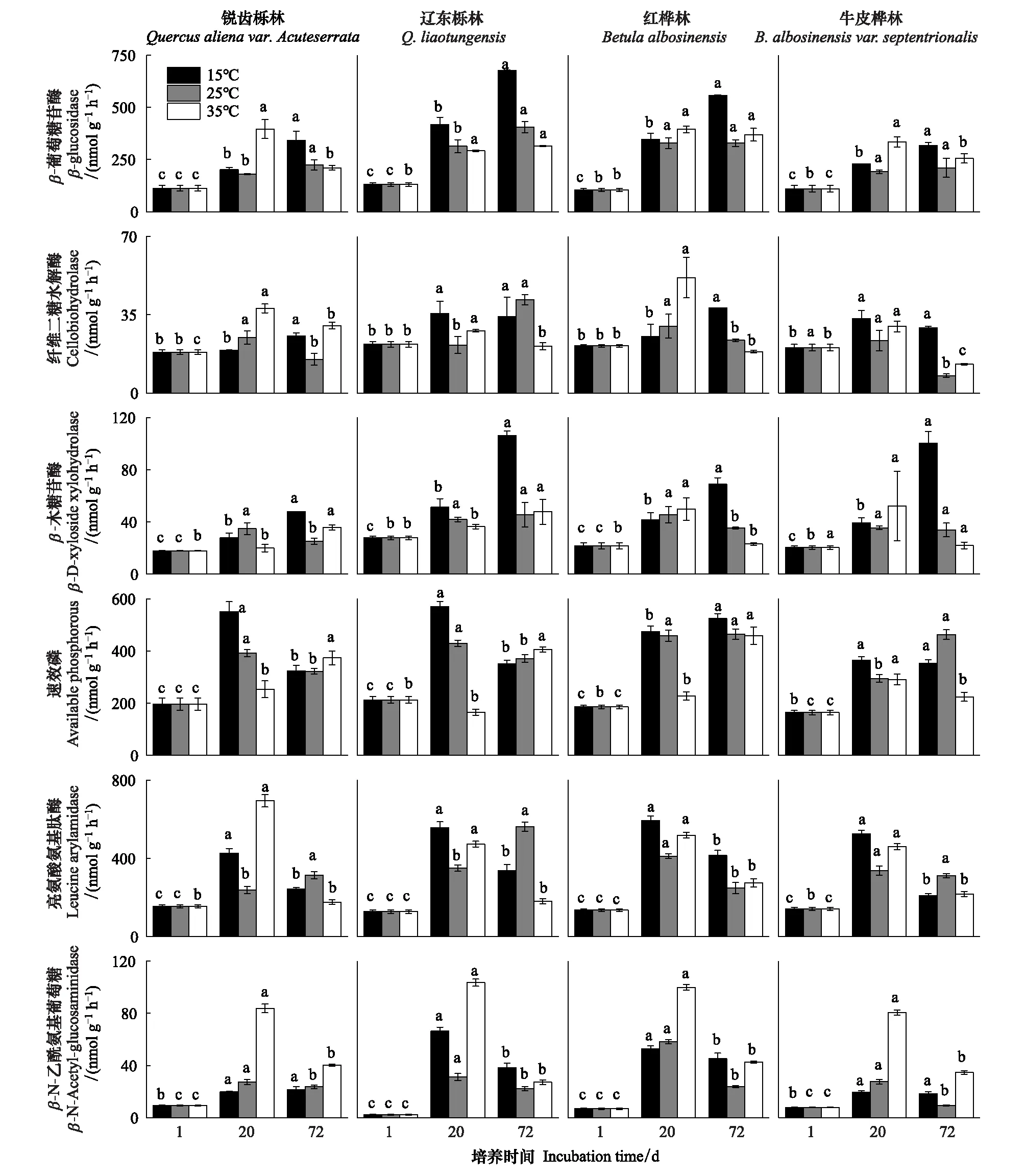
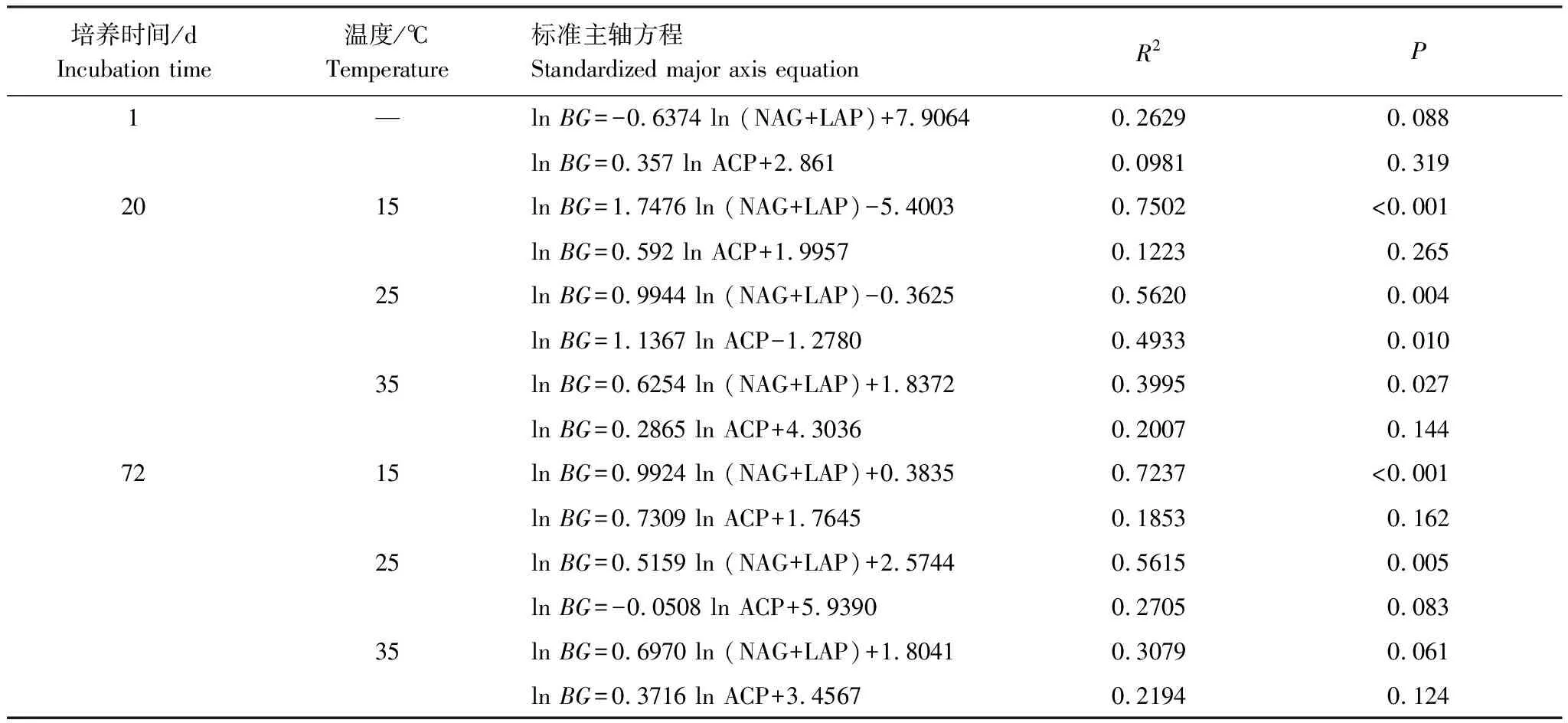
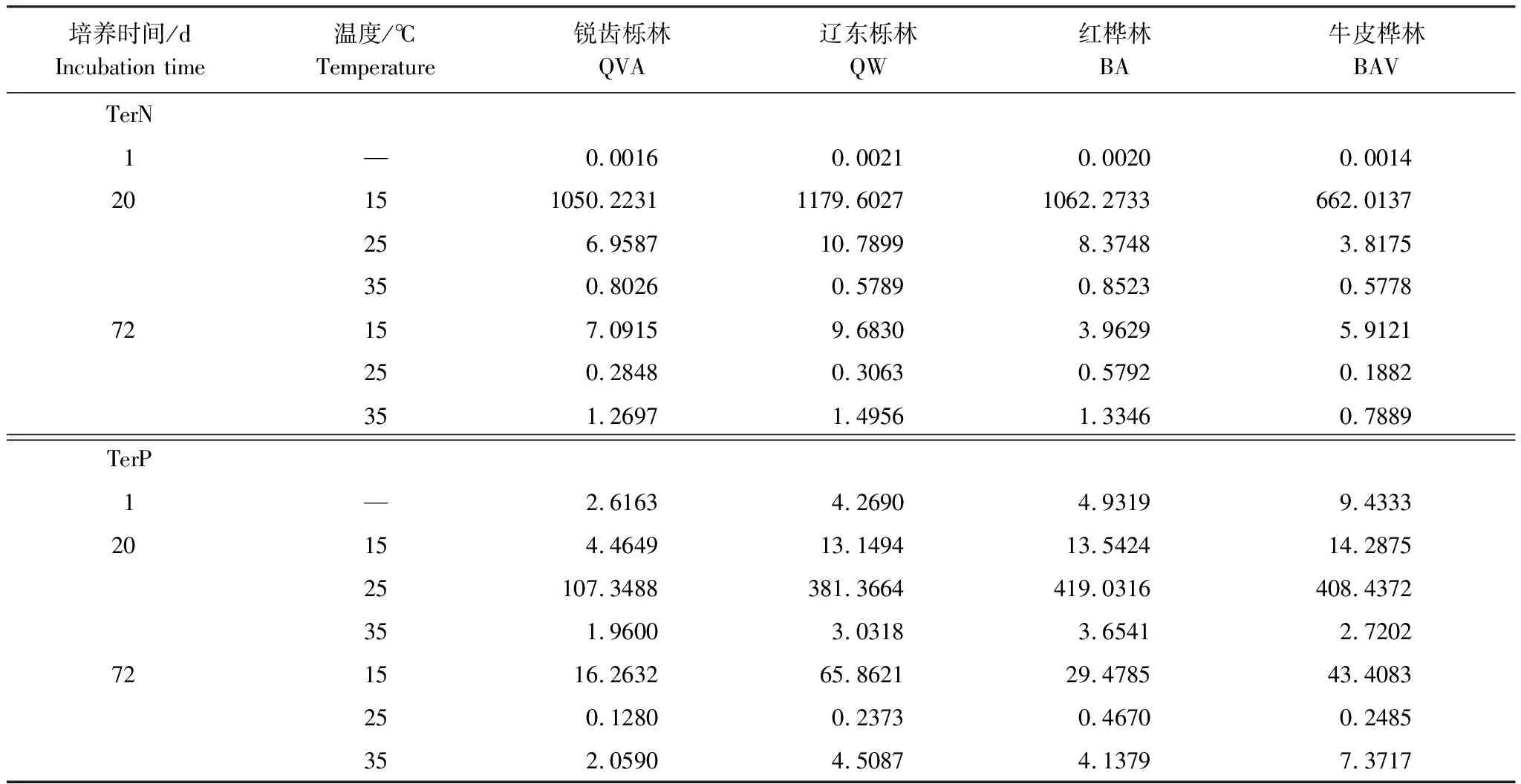
由表2可知,在相同的海拔中,T1Q10(T1表示15 ℃與25 ℃的溫差)與T2Q10(T2表示25 ℃與35 ℃的溫差)存在顯著性差異(P<0.05),出現T2Q10 表2 4個不同林帶土壤微生物呼吸溫度敏感系數Q10 由表3可知,4個不同林帶的土壤經過15、25、35℃條件下72 d的培養,其有機碳相較于初始土壤有機碳含量,平均下降了8.34%、9.09%、10.50%,其中牛皮樺林下降最明顯;其全氮相較于初始土壤全氮含量,平均下降了25.41%、27.24%、33.14%;全磷基本沒有變化;速效磷與其初始值相比,平均下降了30.35%、33.94%、38.06%。 表3 不同林帶土壤基礎指標在培養前后的變化 隨著培養時間的增加,MBC、MBN和MBP在15 ℃時出現單峰趨勢(先增加后下降),而在25 ℃下,除去銳齒櫟林與遼東櫟林的MBN,其余也均呈現單峰趨勢。在35 ℃下,銳齒櫟林和遼東櫟林的MBC、MBP和牛皮樺的MBP外,其余均表現為下降趨勢。 與MBC初始值相比較,20 d的MBC在15 ℃與25 ℃下平均上升101.8%、38.9%,而在35℃下平均下降3.8%;72 d的MBC在三個溫度下都處于下降狀態,溫度由低到高分別下平均下降47.9%、56.9%、54.4%。與MBN初始值相比較,20 d的MBN在15 ℃與25 ℃下平均上升41.3%、15.9%,而在35 ℃下平均下降25.9%;72 d的MBN在15 ℃、25 ℃和35 ℃下,各自平均下降53.3%、49.6%、57.3%。與MBP初始值相比較,20 d的MBP在15 ℃與25 ℃下平均上升117.9%、50.1%,而在35 ℃下平均下降1.6%;72 d的MBP在15 ℃、25 ℃和35 ℃下,各自平均下降58.4%、54.7%、62.2%。(圖2) 圖2 不同培養階段中不同林帶的土壤微生物量碳氮 在相同培養時間和相同溫度下,不同的胞外酶活性也表現出不同的趨勢。在20 d時,6種胞外酶在15 ℃下,相比較于其各自的初始值在1.22—6.99倍之間;在25 ℃下,各林帶平均增長了1.26—19.3倍;而35 ℃下,其最大增幅達40.49倍,最小增幅有-23.2%;其中,NAG、LAP、ACP增幅比較明顯。而72 d的6種胞外酶相比較于其各自的初始值,在15 ℃下分別平均增長了1.55—6.82倍;而在25 ℃與35 ℃時,6種胞外酶的增幅在1.06—6.57倍之間。在整個培養過程中,NAG的增幅最大,CBH的增幅最小(圖3)。 圖3 不同培養階段中不同林帶的土壤中的胞外酶活性 由表4可知,在15 ℃下,MBP對微生物呼吸速率極顯著相關(P<0.01),BG對其顯著相關(P<0.05)。在25 ℃下,微生物呼吸速率的最大影響因子是MBP(P<0.01),其次是BG(P<0.05)。在35 ℃下,BG與MBC同時對微生物呼吸有極顯著影響(P<0.01),MBP也存在顯著相關(P<0.05)。在銳齒櫟林和遼東櫟林中,BG對微生物呼吸速率極顯著相關(P<0.01),其中BX對銳齒櫟林的微生物呼吸速率也存在顯著相關(P<0.05)。而在紅樺林與牛皮樺林中,ACP是對微生物呼吸速率的唯一極顯著影響因子(P<0.01)。 表4 微生物量和胞外酶活性對土壤微生物呼吸的逐步回歸方程 由表5、表6可知,隨著培養時間的延長,TerN在15℃和25℃下存在先增加后下降的趨勢,在35℃下呈現持續上升的趨勢;TerP在15℃下出現持續上升的趨勢,在25℃下出現先上升后下降的趨勢,在35℃下出現先下降后上升的趨勢。 表5 不同溫度下土壤酶活性關系的標準化主軸分析 表6 不同溫度下不同林帶的不同培養時間時間的TerN和TerP 本研究發現,高溫在短期內會促進土壤微生物呼吸,但是在長期培養會減緩土壤微生物呼吸。大量研究發現[32-34],在自然培養過程中,增溫在短期內會促進土壤呼吸。但是在長期增溫實驗中,土壤呼吸出現了不同的趨勢,如Melillo對美國Harward森林的土壤實驗中出現在增溫在前6年促進土壤呼吸,在后4年抑制土壤呼吸的現象[35];而他在美國Corvallis原始森林的實驗中發現增溫一直在促進土壤呼吸[36]。在本實驗中,出現高溫培養與低溫培養的土壤呼吸速率相等的現象是在50 d左右出現,相比于Melillo的實驗時間有極大的提前,可能主要原因是本實驗為恒溫恒濕且無外源碳的輸入情況下進行的,碳被消耗無法得到補充,而上述實驗是處于自然界中的增溫培養實驗,有大量的外源碳輸入,次要原因是研究區樣地與上述實驗的培養地存在極大的空間上的差異。土壤有機碳、全氮、速效磷在培養72 d以后都出現了明顯的下降趨勢,并且出現了高溫培養比低溫培養下降幅度更大的現象,這與土壤呼吸速率的趨勢相符合,出現該現象可能的原因是高溫使得土壤酶處于較高的活性,加速了對土壤中氮磷元素的吸收以供微生物生長繁殖,因此土壤有機碳中被分解以供給其能量[36]。有研究認為[37-38],土壤中的碳有不同的存在形式,不穩定的有機碳與比較穩定的碳化合物在轉化的過程中都會在酶的作用下成小分子碳(如葡糖糖多糖等),從而被微生物吸收利用產生CO2。高溫使大量活性較高、不穩定的大分子有機碳在培養前期被消耗,所以表現出高溫在前期促進土壤呼吸。而隨著培養時間的增加,土壤中的易被分解的組分被消耗,難礦化的組分不斷累積,反而使高溫培養的土壤中活性碳與惰性碳的比值不如低溫培養,從而表現出高溫會在長期減緩土壤呼吸速率。而對于不同林帶而言,土壤呼吸速率無顯著性差異(P>0.05)。而根據施政[39]與劉賢德[40]等觀點,在自然中溫度的變化是土壤呼吸速率在空間上的變化的唯一的顯著的主導因子。由于本研究已經控制溫度,消除了溫度變化的影響,所以上述現象,與施政等研究結果并不矛盾。土壤全磷在經過72 d的培養之后含量幾乎不變,可能是由于磷元素只是在土壤中作不同磷組分之間的轉化,并沒有以氣體的形式散失。 較多對溫帶或亞熱帶的土壤的研究認為,Q10隨著溫度的升高而降低[41-42],這與本研究的實驗結果相符合;也有研究認為,Q10隨著溫度的升高而升高,這些研究大部分出自與高緯度地區[43];還有研究認為,Q10與溫度的變化無明顯影響[44],出現差異的現象可能是與土壤類型、凋落物的輸入或者微生物群落的差異有關。在本研究中,T1Q10與T2Q10的平均值分別是2.39和2.17,符合Raich[45]在全球文獻綜述中報道的中值(2.40),也在Coucheney E[46]和Xu Z[47]等人在現場和實驗室測量的Q10值的范圍之內。但是本研究中的Q10可能會被高估,因為根據Zhu[48]等人的觀點:恒定溫度下的Q10值高于日變化溫度。而且在長期培養過程中,由于缺乏新鮮的碳輸入,土壤微生物群落組成發生了變化。在培養過程中土壤中不穩定碳的耗竭增加了有機碳的惰性,從而導致基于C質溫假設的Q10值增加。盡管如此,Q10也不是恒定的[49],有些研究可以表明通過使用周期性變化的溫度可以克服恒溫的缺點[50-51]。因此,未來在評價土壤微生物呼吸的Q10時,應采用周期性變化的溫度進行實驗。 本研究發現,土壤微生物呼吸的變化受到微生物量與胞外酶的影響,而微生物與胞外酶在不同的培養時間與不同溫度上有明顯差異。MBC、MBN與MBP在15℃與25℃培養過程中出現單峰趨勢(先增加后降低),增加的原因可能是1—20 d微生物利用土壤中的養分進行生長繁殖,降低的原因可能在20—72 d中土壤中養分在持續不斷的消耗,導致微生物大量死亡或休眠。Anderson[52]認為呼吸反映了整個微生物群落的活性,包括休眠和未休眠狀態的微生物群體。土壤中微生物大部分處于休眠狀態,只有一小部分對呼吸有貢獻。而我們的結果表明在35℃中,MBC、MBN與MBP在培養過程中出現下降趨勢,可能是由于土壤微生物不能適應高溫的環境,大量的微生物在培養開始的前20 d就已經逐漸死亡或進入了休眠狀態。 有研究認為[38],土壤中的碳可以分為3個部分,最活躍的碳的代表成分是不穩定或可溶解的碳化合物(糖或氨基酸);比較穩定的碳的代表成分是非木質化的纖維素和半纖維素;穩定的碳的代表成分是木質素。一般木質素需要成百上千年才能被完全分解[53],所以本實驗未將木質素視為可以被微生物分解利用的碳源,而不穩定或可溶性碳化合物基本不需要酶就可以直接被為微生物利用,所以酶主要影響的是以纖維素和半纖維素為代表的不能直接被微生物利用但是可以在酶作用下被分解為可被微生物利用的碳源。 通過表4可以看出,BG是影響土壤呼吸最顯著的胞外酶。而ACP在紅樺林與牛皮樺林中對微生物呼吸極顯著相關,可能的原因是紅樺林和牛皮樺林的土壤速效磷過少。BG和CBH參與了對土壤中纖維素的降解,CBH主要用于將纖維素水解成纖維二糖,BG作用于已經被CBH分解后的有機物(如纖維二糖),將其水解成微生物可用碳源(如葡萄糖多糖)[54]。在15℃與25℃下,BG的活性隨著培養時間的增加而增加,而MBC呈現單峰趨勢;在35℃時,BG出現單峰趨勢,與MBC的持續下降的趨勢并不符合。換言之,在微生物量碳減少的情況下,BG的活性仍然在增加,說明了在72 d時,由BG分解纖維素所得的碳已經成為不滿足微生物生長繁殖所需。木聚糖(半纖維素的構成)是一種較難分解的碳源,主要由BX參與進行分解[54]。在本研究中,BX在15℃下出現持續上升趨勢,說明了在15℃下由BX分解半纖維素所得的碳已經成為不滿足微生物生長繁殖所需;而在25℃和35℃下,在72 d與20 d相比較,BX沒有明顯的變化,說明了在25℃和35℃中,72 d時由BX分解半纖維素所得的碳已經成為微生物重要的碳源之一。 Sinsabaugh等人曾提出Metabolic Theory of Ecology理論,微生物可以通過釋放過量元素和調節其生理能力(如元素利用效率)來保留限制元素,從而更好的將其生物量與環境資源想匹配[55-56]。微生物代謝從凈養分固定(養分限制)到凈養分礦化(能量限制)的轉換可以用閾值元素比(Ter)來描述,Ter值偏高代表著更高的能量利用效率,Ter值偏低代表著更高的養分利用效率[20]。NAG與LAP參與了土壤的N循環,NAG在甲殼質和其他b-1,4-連接的葡萄糖胺聚合物的降解中起著重要作用,類似于BG在纖維素降解中的作用,而LAP作用于多肽N末端的亮氨酸和其他疏水氨基酸[57-58]。TerN在15℃和25℃下存在變化非常明顯的先增加后下降的趨勢,表明了在15℃和25℃的培養過程中,氮的利用效率先下降后上升。即在培養前期,N是限制土壤微生物生長的因素,而在后期微生物可以用的N比C更為富余。而在35℃下,TerN一直在上升且變化范圍較大,說明N的利用效率在一直下降,即可認為土壤一直處于N限制中。而且TerN(20 d)/TerN(1 d)遠大于TerN(72 d)/TerN(20 d),說明了土壤中大部分易吸收、易分解的N在1—20 d里已經被利用,出現該現象可能的原因是NAG作為N分解的終端酶之一,在35℃下已具備很高的活性[59]。ACP參與了土壤的P循環,主要參與了磷酸多糖與磷酸酯的水解,為微生物提供可利用的磷源[60]。TerP雖然在15℃下出現持續上升的趨勢,但是變化范圍較小,3個時間段的TerP比較接近,TerP(20 d)/TerP(1 d)稍小于TerP(72 d)/TerP(20 d),說明了土壤中的P是在逐漸的、平緩的被ACP所分解,因此可以認為不存在P限制;TerP在25℃下出現先上升后下降的趨勢,且變化范圍較大,即可以認為在培養前期,P是限制土壤微生物生長的因素,而在后期P相較于C有較多富余,出現該現象可能的原因是25℃下微生物量更大,需要吸收更多的P來維持其生長繁殖;TerP在35℃下出現先下降后上升的趨勢,而且TerP(72 d)與TerP(1 d)相差不大,表明P一直不是限制微生物生長的因素,且20 d時有明顯的富余,出現該現象可能的原因是ACP在35℃下已具備很高的活性[61],可以為微生物生長繁殖提供足夠的P。在本研究中,由于室內培養和野外系統之間的環境存在較大差異,可能會出現測量出的微生物量偏高和酶活性偏低[30],在一定程度上降低了關于不同溫度下影響土壤呼吸的因素討論的效力。其原因可能是由于室內培養保持了合適且恒定的溫度與濕度,使得土壤微生物迅速生長繁殖,加快了土壤有機碳的消耗。并且由于目標土壤不存在與外界的能量、養分的交流,因此在隨著培養時間的延長,室內培養相較于野外培養存在著土壤微生物種群的變化更迭更加頻繁的問題[62]。 (1)在無碳源輸入的恒溫恒濕培養中,高溫在短期內會促進土壤微生物呼吸,而在長期會減緩土壤微生物呼吸。對于太白山(溫帶森林)的土壤而言,Q10隨著溫度的升高而降低。 (2)在培養過程中,土壤有機碳和全氮一直減少,15 ℃和25 ℃下微生物量先增多后減少,35 ℃下微生物量一直減少,BG是影響土壤呼吸最顯著的胞外酶。 (3)培養72 d以后,由BG所分解的碳已不能滿足微生物生長繁殖所需;在25℃和35℃下,由BX所分解的碳已成為生物生長繁殖重要碳源之一。 (4)在15℃和25℃下,N是培養前期限制土壤呼吸的因素,C是后期限制因素;在35℃下,N一直是限制土壤呼吸的因素。 (5)在15℃和35℃下,土壤呼吸不存在P限制;在25℃的培養前期,P是限制土壤呼吸的因子,而在培養后期不存在P限制。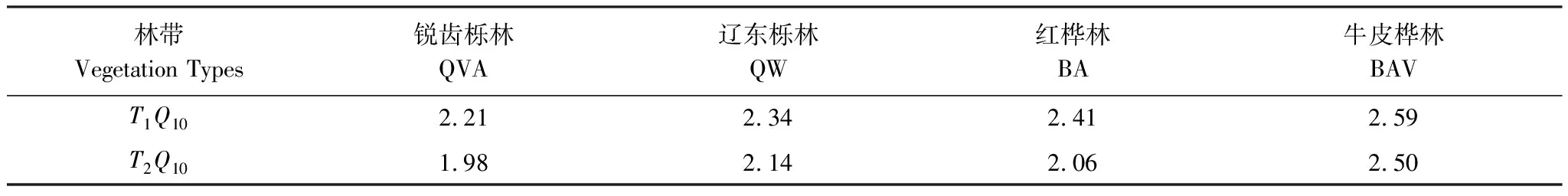
3.2 土壤理化性質與胞外酶在不同培養時間的差異
3.3 微生物量與胞外酶對微生物呼吸的影響

4 討論
4.1 土壤呼吸、土壤理化性質與Q10在不同林帶與溫度上的差異性
4.2 微生物量與胞外酶對土壤呼吸的影響
5 結論

