小麥TaGSK5基因的克隆與表達分析
張令慧,張沛沛,劉媛,陳濤,王彩香,程宏波,楊德龍
(1.甘肅省干旱生境作物學省部共建國家重點實驗室培育基地,甘肅 蘭州 730070;2.甘肅農業大學生命科學技術學院,甘肅 蘭州 730070)
小麥(Triticumaestivum)是我國四大主糧作物之一,主要分布在北方雨養農業區.隨著全球氣候的變化,淡水資源日益匱乏,土壤鹽漬化加劇,小麥在發育時期更易遭受干旱、低溫、干熱風、鹽漬化等非生物脅迫,致使小麥生長發育異常,產量和品質顯著下降[1].為應對各種非生物脅迫的危害,小麥在長期的進化過程中形成了一系列的生理生化調控機制[2-4].許多基因在小麥非生物逆境脅迫應答中發揮著重要的作用[5-6].因此,深入發掘優異的抗逆基因,解析其生物學功能,對小麥抗逆分子遺傳改良具有重要意義.
糖原合成激酶(glycogen synthase kinase 3/shaggy like kinase,GSKs)是一類保守的絲氨酸/蘇氨酸蛋白激酶家族[7],在響應植物非生物脅迫和參與植物生長發育調控方面起重要作用.近幾年,GSKs基因相繼在擬南芥(Arabidopsisthaliana)[8]、苜蓿(Medicagosativa)[9]、棉花(Gossypiumspp.)[10]和水稻(Oryzasativa)[11]中被發現與克隆.研究發現,GSK家族成員蛋白的激酶結構域高度保守的[12],在水稻和擬南芥GSK-like激酶結構域的結構相似性達75%[13].GSKs能夠磷酸化多個下游底物來發揮生物學功能[14].BR信號通路的GSK3的同系物BIN2是通過磷酸化和去磷酸化控制BR信號傳導下游的轉錄因子BRZ1和BES1/BZR2來阻止信號轉導,通過負向調節作用進而誘導其他生化反應[15],而擬南芥ASKa是通過激活Glu-6-磷酸脫氫酶(G6PD)來調節應激耐受性[16].植物中的GSKs是一個多基因家族[17],在擬南芥中已經鑒定出10個GSKs家族成員[18],水稻中包含9個[19].進化分析表明,植物GSKs家族成員可分為Ⅳ個亞家族[20],其中已經被鑒定的第Ⅳ亞家族基因AtSK11[21]、OsGSK5[22]和MsK4[9]受非生物脅迫誘導并且具有激酶活性.在擬南芥中,AtSK11受NaCl、干旱、ABA、熱誘導上調表達[21],研究發現高鹽脅迫能夠快速誘導糖原合成激酶MsK4上調表達[9].水稻OsGSK5通過調節碳水化合物的代謝平衡從而調高了植物對鹽脅迫的耐受性[22].上述研究表明,植物GSKs的第Ⅳ亞家族成員在逆境脅迫響應中發揮重要作用.然而,截止目前有關小麥GSK基因的克隆和響應非生物脅迫的研究尚未見報道.因此,本研究擬克隆小麥TaGSK5基因并對其序列進行生物信息學分析和表達分析,以期為進一步研究小麥TaGSK5基因生物學功能提供理論依據.
1 材料與方法
1.1 試驗材料
選取隴中1號為供試材料,該品種適宜在甘肅蘭州和隴東地區、寧夏固原地區、陜西延安地區的旱地冬麥區種植.隴中1號在本實驗室基地種植抗旱效果較好.
1.2 處理方法
挑選籽粒大小一致、圓潤飽滿的隴中1號小麥種子置于培養皿上,4 ℃黑暗處理2 d后置于人工氣候室內,在光照強度為62.5 μmol/(m2·s),光周期為16 h/8 h,溫度為25 ℃條件下進行培養.待幼苗長至兩葉一心時(14 d),對小麥幼苗進行非生物脅迫處理.將采用水培法培養的小麥幼苗置于20% PEG-6000溶液和200 mmol/L的NaCl的溶液中培養,分別在處理后0、1、3、6和12 h的時間點采集小麥幼苗各組織,液氮速凍后,-80 ℃超低溫保存備用.
1.2.1TaGSK5基因cDNA的引物設計 以水稻OsGSK5的cDNA為參考序列(XP_015633107),在小麥數據庫網站(http://202.194.139.32/blast/viroblast.php)中檢索其在小麥中的同源基因,通過序列比對獲得小麥TaGSK5的4個同源候選基因,命名為TaGSK5-1A,TaGSK5-4A,TaGSK5-5B及TaGSK5-5D.利用Primer premier 5.0軟件設計通用引物進行小麥隴中1號的TaGSK5基因擴增:引物序列為TaGSK5-F(5′→3′):CAATCAGCTAGGAGATGGCGTA和TaGSK5-R(5′→3′):CACCCACACAAAGCTACAGCT,引物由生工生物工程(上海)股份有限公司合成.


1.2.4 生物信息學分析 運用ExPASy-ProtParam對小麥TaGSK5的二級結構及蛋白的理化性質進行預測;運用ExPASy-ProtParam構建TaGSK5蛋白的三級結構;使用WoLFPsort (www.gens cript.com/wolf-psort.html)預測TaGSK5的亞細胞定位;在NCBI網站搜索不同物種的GSK同源蛋白并利用DNAMAN軟件進行氨基酸序列比對;使用STRING(https://string-db.org/cgi/input)預測TaGSK5蛋白的互作網絡;采用MEGA 7.0軟件構建小麥、水稻、擬南芥、苜蓿、大麥和粗山羊草等8個物種GSK同源蛋白的系統進化樹;在WheatExp(https://wheat.pw.usda.gov/ WheatExp/)數據庫下載小麥不同組織(根、莖、幼穗、葉和籽粒)TaGSK5基因的表達譜數據,利用TBtools軟件繪制表達譜數據熱圖.
2 結果與分析
2.1 TaGSK5基因cDNA的克隆及基因結構
以小麥隴中1號葉片的cDNA為模板,使用特異性引物TaGSK5-F和TaGSK5-R擴增目的片段,擴增產物經電泳檢測,在1 200 bp左右出現1個特異性條帶(圖1).將目的條帶回收純化、轉化大腸桿菌,挑選陽性克隆測序驗證.測序結果與中國春的4條序列進行比對.結果表明,不同單克隆菌的序列信息與1A、4A、5B和5D染色體上中國春釋放的序列信息相一致,將其命名為TaGSK5.所得到的4個TaGSK5基因cDNA序列,分別位于小麥的1A、4A、5B和5D的染色體上,故將其分別命名為TaGSK5-1A、TaGSK5-4A、TaGSK5-5B和TaGSK5-5D.通過基因結構分析發現,TaGSK5的4個部分同源基因都編碼426個氨基酸且均由12個外顯子和11個內含子組成(圖2).
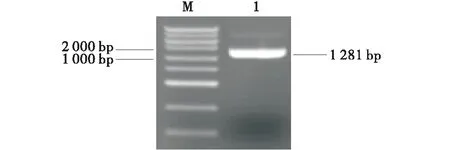
M:DL5000 DNA marker;1:TaGSK5基因的擴增產物.M:DL5000 DNA marker;1:The amplification products of TaGSK5 gene.圖1 TaGSK5基因cDNA序列擴增Figure 1 The cDNA amplificated products of TaGSK5 gene
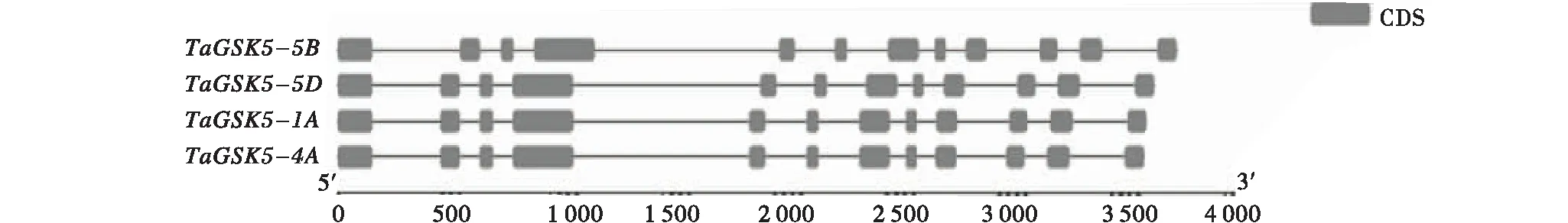
圖2 TaGSK5的基因結構Figure 2 The gene structure of TaGSK5
2.2 TaGSK5基因編碼的氨基酸序列比對及進化樹分析
使用DNAMAN對小麥TaGSK5與水稻(XP_015633107)、苜蓿(AF432225)和擬南芥(At1g 09840)的氨基酸序列進行多重比對(圖3),結果表明,小麥TaGSK5的4個同源基因氨基酸相似性達到99.43%,4個物種間的同源性在70%以上,TaGSK5與水稻相似性較高(>90%),與苜蓿和擬南芥的同源性較低.他們的GSK激酶(88-375)結構域高度相似,其中的功能基序TREE、CDFGSAK和SYICSR的序列較一致,表明TaGSK5蛋白在進化過程中具有較強的保守性.進化分析表明,TaGSK5的4個部分同源基因和粗山羊草處于同一個分支(圖4),說明祖先種來源于粗山羊草.
2.3 TaGSK5蛋白二級及三級結構預測
通過(http://bioinf.cs.ucl.ac.uk/)在線軟件預測了TaGSK5的4個同源蛋白的二級結構組成,結果表明這4個蛋白二級結構的比例均由α-螺旋、無規則卷曲、延伸鏈和β-折疊構成(表1).TaGSK5-5B、TaGSK5-5D、TaGSK5-4A和TaGSK5-1A蛋白的二級結構α-螺旋分別占36.71%、36.71%、36.85%和37.32%,無規則卷曲分別占42.72%、40.24%、42.02%和40.85%,延伸鏈分別占15.26%、16.24%、15.73%和15.49%,β-折疊分別占6.34%、6.82%、5.40%和6.34%.通過(https://web.expasy.org/protparam/)在線軟件構建TaGSK5蛋白的三級結構,因TaGSK5的4個同源蛋白的氨基酸序列高度相似,同源建模選用的蛋白模型相同,故使用TaGSK5-5B蛋白序列構建三級結構(圖5).由圖5可知,TaGSK5-5B蛋白的結構兩端是由少部分的β-折疊,中間是α-螺旋由無規則卷曲串聯起來的空間結構,主要是以α-螺旋和β-折疊形成的特殊結構來行使激酶功能.
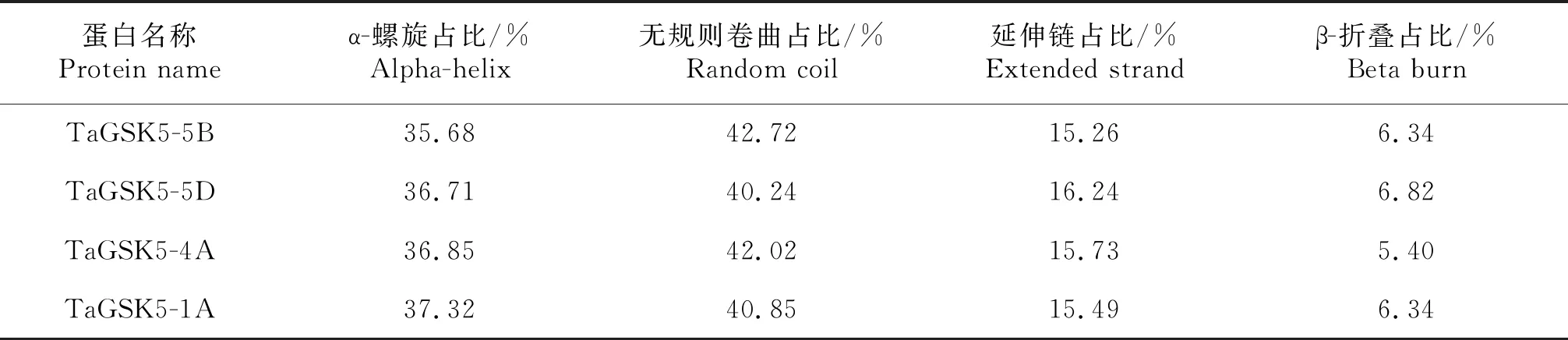
表1 TaGSK5蛋白的二級結構預測
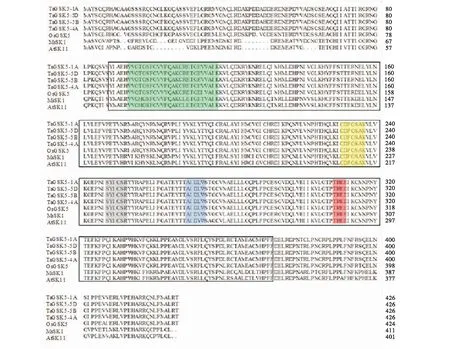
黑色方框:GSK蛋白激酶催化結構域;綠色背景:ATP結合位點;黃色背景和灰色背景:分別為高度保守基序CDFGSAK和SYICSR,僅存在于絲氨酸/蘇氨酸蛋白激酶GSK-3亞家族成員;紅色背景:植物中的保守基序TREE.Black box:GSK protein kinase catalytic domain;Green background:ATP binding site;Yellow and gray backgrounds shows highly conserved motifs CDFGSAK and SYICSR,respectively,which are only present in the members of the GSK-3 subfamily of serine/threonine protein kinases;Red background:TREE is the conservative motif in plants.圖3 小麥TaGSK5與其他物種同源蛋白的氨基酸序列比對Figure 3 Alignments of amino acid sequences of wheat TaGSK5 with homologous proteins of other species
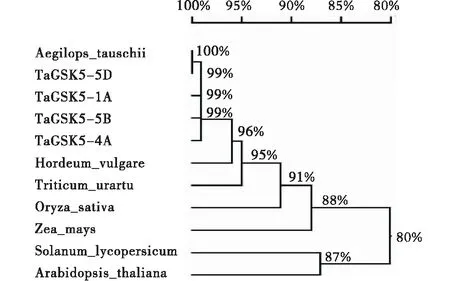
圖4 小麥與其他物種GSK蛋白的進化分析Figure 4 Phylogenetic tree of GSK from wheat and other species
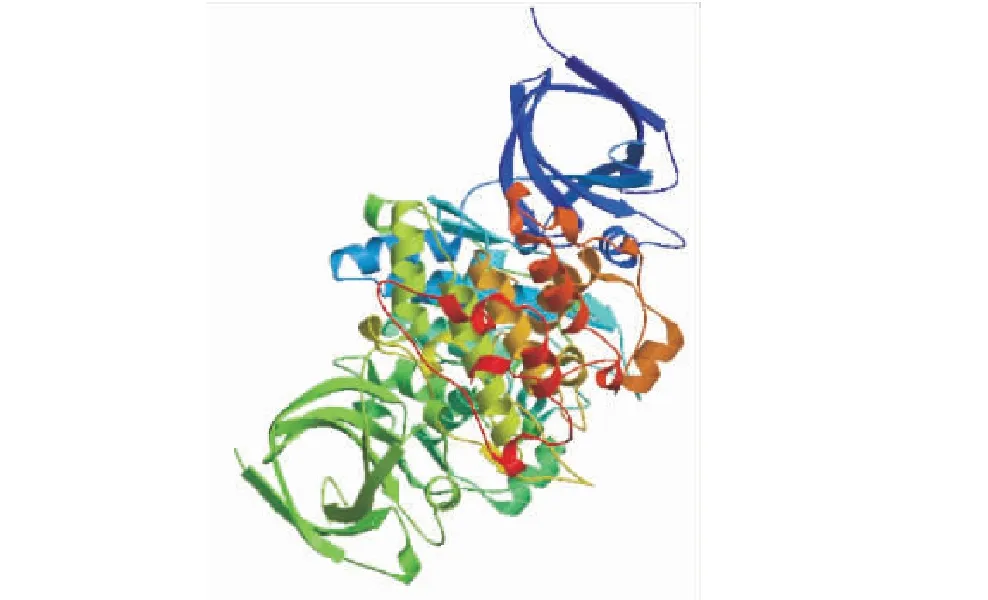
圖5 TaGSK5蛋白的三級結構圖Figure 5 Prediction of the tertiary structure of TaGSK5
2.4 TaGSK5蛋白的理化性質、親疏水性及磷酸化位點分析
利用EXPASY-ProtParam在線網站預測TaGSK5蛋白的理化性質(表2).結果顯示,這4個同源蛋白的理化性質非常接近.TaGSK5-5D、TaGSK5-5B、TaGSK5-4A和TaGSK5-1A的等電點非常接近,等電點分別為8.53、8.57、8.79和8.54;分子量分別為48 226.51、47 602.69、48 237.52和48 314.58.通過EXPASY-ProtParam網站預測TaGSK5蛋白質的親疏水性,親水性的氨基酸明顯多于疏水性蛋白,表明TaGSK5蛋白質為親水性蛋白(圖6).利用EXPASY-ProtParam網站預測小麥TaGSK5蛋白磷酸化位點,發現TaGSK5蛋白有絲氨酸位點13個、蘇氨酸位點8個、酪氨酸位點6個.表明該蛋白可能通過不同的磷酸化底物實現基因的調控功能(圖7).
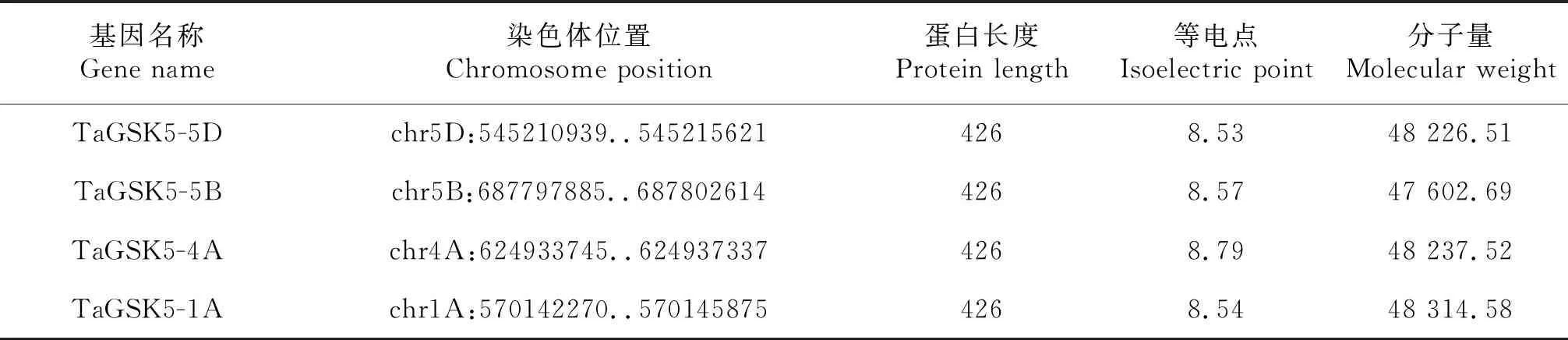
表2 TaGSK5基因編碼的蛋白質的理化性質
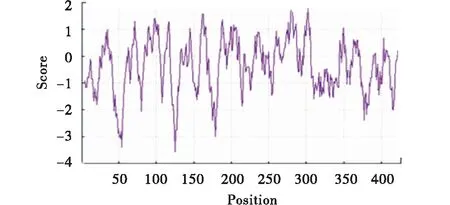
垂直線零點以下代表相對的親水區,零點以上為疏水區.The vertical line below the zero point represents the relative hydrophilic area,and the vertical line above the zero point represents the hydrophobic area.圖6 TaGSK5蛋白的親疏水性預測Figure 6 Prediction of hydrophilicity and hydrophobicity of TaGSK5
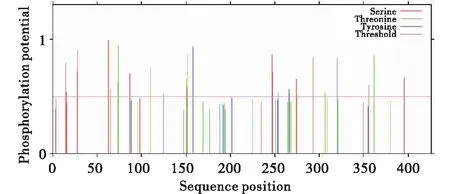
圖7 TaGSK5蛋白磷酸化位點預測Figure 7 Prediction of phosphorylation site of TaGSK5
2.5 TaGSK5蛋白的亞細胞定位及互作蛋白網絡
利用WOLFPSORT在線軟件預測分析TaGSK5蛋白亞細胞定位,這4個同源蛋白主要分布在細胞質、細胞核、線粒體和過氧化物酶體中,但在細胞核和線粒體中的比例較高(表3),且TaGSK5蛋白沒有信號肽結構,表明該蛋白不屬于分泌蛋白.利用STRING在線軟件對TaGSK5的互作蛋白預測(圖8)發現,與TaGSK5互作的蛋白中有4個絲氨酸/蘇氨酸特異性蛋白磷酸酶、2個cGMP依賴性蛋白激酶、1個具有Kelch樣重復結構域的蛋白磷酸酶、1個PKG_like.1-ACG激酶和1個蛋白磷酸酶.
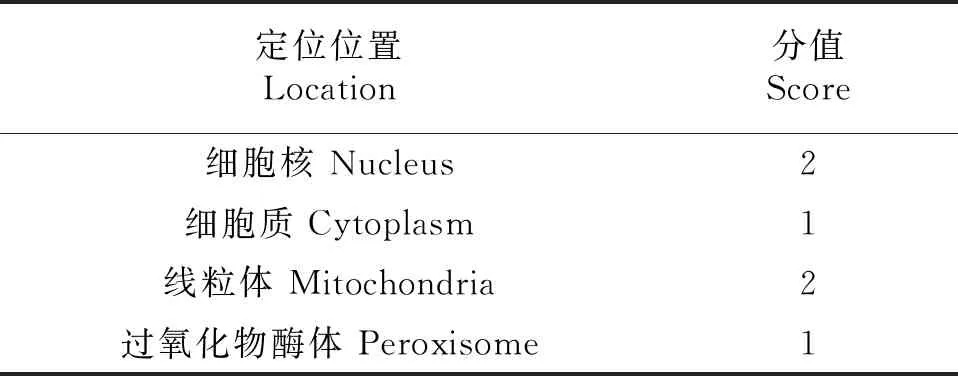
表3 TaGSK5的亞細胞定位預測
2.6 TaGSK5基因的表達特性分析
通過分析WheatExp數據庫中TaGSK5基因在不同組織的表達譜數據,發現TaGSK5基因在小麥不同組織中均有表達,莖和穗中表達高于其他組織,在穗中的表達量最高(圖9).通過qRT-PCR檢測發現,小麥幼苗在干旱脅迫處理0~6 h時該基因表達量顯著下調,在6~12 h時該基因的表達量上升.在NaCl處理下TaGSK5基因的表達量沒有發生顯著變化(圖10).
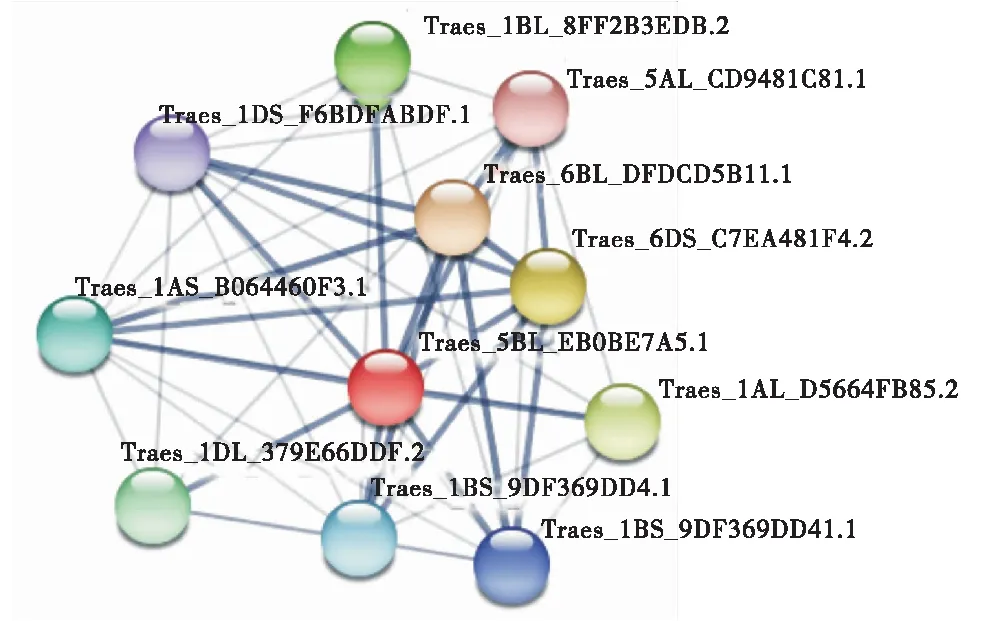
Traes_1DL_379E66DDF.2和Traes_1BL_8FF2B3EDB.2:拓撲異構酶1相關因子1;Traes_1AS_B064460F3.1、Traes_1DS_F6BDFABDF.1和Traes_1BS_9DF369DD41.1:Kelch重復域的蛋白磷酸酶;Traes_6BL_DFDCD5B11.1:AGC_PKA / PKG_like.1-ACG激酶;Traes_5AL_CD9481C81.1:絲氨酸/蘇氨酸蛋白磷酸酶;Traes_6DS_C7EA481F4.2:蛋白磷酸酶2C;Traes_1AL_D5664FB85.2,Traes_1BS_9DF369DD4.1與Traes_1BS_9DF369DD41.1:含八糖肽或四三肽重復(TPR)的蛋白質.Traes_1DL_379E66DDF.2 and Traes_1BL_8FF2B3EDB.2:Topoisomerase 1 related factor 1;Traes_1AS_B064460F3.1,Traes_1DS_F6BFABDF.1 and Traes_1BS_9DF369DD41.1:Kelch repeat domain protein phosphatase;Traes_6BL_DFDKG_PKGC5B11.1:AGC_PKA / PKG_like.1-ACG kinase;Traes_5AL_CD9481C81.1:serine/threonine protein phosphatase;Traes_6DS_C7EA481F4.2:protein phosphatase 2C;Traes_1AL_D5664FB85.2,Traes_1BS_9DF369DD4.1 and Traes_1BS_9DF369DD41.1:proteins containing octa-glycopeptide or Tetratrieptide Repeat (TPR) domain.圖8 TaGSK5蛋白的互作網絡Figure 8 Interaction network of TaGSK5

G:籽粒;L:葉片;R:根部;S:穗部;ST:莖部.G:Grain;L:Leaf;R:Root;S:Spike;ST:Stem.圖9 TaGSK5基因在不同組織中的表達量Figure 9 TaGSK5 gene expression in different tissues
3 討論
糖原合酶激酶3(GSK3)是一種絲氨酸/蘇氨酸激酶,是一種多功能激酶[7].大多數已經被克隆出的GSK基因參與非生物脅迫響應[22-23].本研究從小麥隴中1號中克隆了4個TaGSK5的cDNA序列,序列長度1 281bp.在水稻中,OsGSK5包含12個內含子和11個外顯子[6],與在本研究中TaGSK5的4個同源基因的基因結構一致.他們所編碼的蛋白無論從基因結構、理化性質還是蛋白結構域都高度相似[22].氨基酸序列比對顯示,TaGSK54個部分同源基因所編碼的蛋白的序列相似性達98%,與擬南芥、水稻和苜蓿中同源基因具有很高的相似性[9,11,21].本研究發現小麥TaGSK5的4個部分同源基因的激酶結構域高度保守,其中TREE結構域在不同物種中都存在[11].最近研究發現,GSK激酶結構域在不同植物中的功能基序高度相似,擬南芥bin2-1突變體出現矮化的表型是由于TREE基序突變,抑制了GSK蛋白激酶的活性所引起[11],表明功能基序在植物中激活激酶活性及蛋白功能的發揮具有作用.
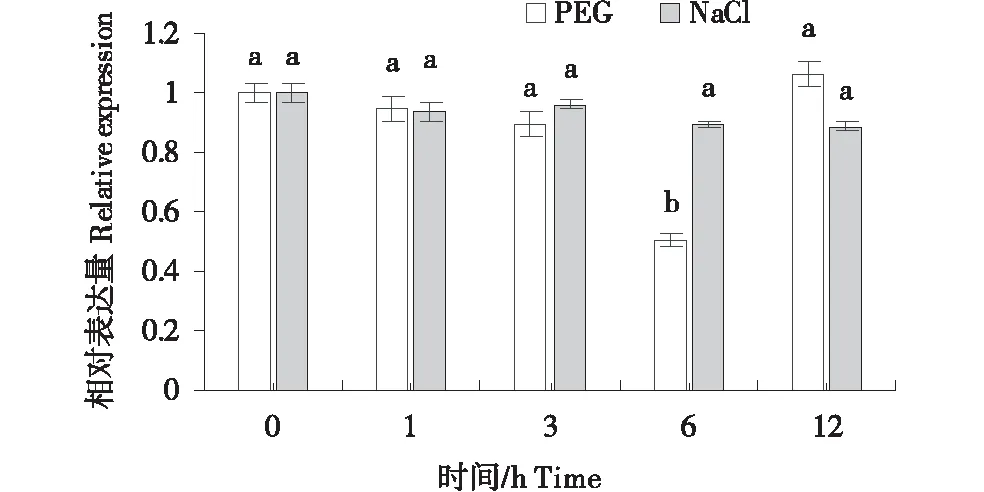
A:PEG處理;B:NaCl處理.圖柱上不同字母表示差異顯著(P<0.05).A:PEG treatment;B:NaCl treatment.Different letters on the bar indicate significant differences (P<0.05).圖10 在PEG和NaCl處理下TaGSK5的差異表達量Figure 10 Differential expression of TaGSK5 under PEG and NaCl treatment
進一步研究表明,GSK基因通過磷酸化下游蛋白來調控植物的生理過程[23-24].在水稻中的OsSK22介導OsBZR1磷酸化從而調控BR信號通路[25],本研究預測出TaGSK5蛋白有13個絲氨酸、8個蘇氨酸和6個酪氨酸磷酸化位點,推測小麥TaGSK5蛋白通過磷酸化下游底物來調控不同的生物學過程.基因表達譜分析顯示,TaGSK5在小麥的根、莖、葉和穗中均有表達,但在不同組織間的表達水平存在顯著差異,其中在莖和穗中的表達量較高,而在葉和根中表達量較低.不同物種GSK基因在非生物脅迫處理下基因表達量也不盡相同.Wang等[10]報道了棉花中的第四亞家族成員GhSK42在鹽脅迫處理下沒有顯著性的變化,而苜蓿MsK4和水稻OsGSK5過表達后分別提高了苜蓿和水稻對非生物脅迫的耐受性[9,22],本研究發現TaGSK5基因在干旱脅迫下表達量逐漸降低,而在鹽脅迫下表達量沒有顯著變化.結果說明,不同植物中的GSK5基因在非生物脅迫中的響應機制不盡相同,本研究推測小麥TaGSK5基因負調控小麥耐旱性.關于該基因在非生物脅迫中的具體調控機制,還有待于進一步的研究.
4 結論
本研究克隆出的小麥TaGSK5基因,包含4個部分同源基因,其基因結構、保守結構域及蛋白的理化性質非常相似.TaGSK5基因在不同組織具有不同表達模式,在干旱脅迫TaGSK5下調表達,不響應鹽脅迫,研究結果為進一步探究小麥TaGSK5基因的功能提供了理論依據.

