基于TLR4/MyD88/TRIF通路探討芪參合劑對耐藥肺炎克雷伯菌膿毒癥大鼠的固有免疫調節機制①
王宜艷 陳 偉 (上海中醫藥大學附屬龍華醫院,上海 200032)
膿毒癥是重癥監護病房(intensive care unit,ICU)中最常見的重癥疾病之一,有著高發病率和高死亡率[1]。迄今為止,尚無針對膿毒癥的特異性療法。近年來肺炎克雷伯菌(Klebsiellapneumoniae,K.p)逐漸成為引起臨床感染的常見致病菌,更是引起膿毒癥的主要致病菌[2]。研究表明,其分離率和耐藥率逐年上升,ICU中K.p耐藥性更是普遍高于非ICU科室,導致ICU膿毒癥的治療難度進一步提高[3-4]。因此只有尋求新的治療方法才可能改善患者的預后,中醫藥在治療膿毒癥方面具有獨特優勢[5]。前期實驗證實芪參合劑對耐藥K.p膿毒癥大鼠的器官功能有保護作用,初步表明可能是通過調節固有免疫實現的。但芪參合劑對耐藥K.p膿毒癥大鼠固有免疫調節的具體機制尚不明確,本文在整體實驗的基礎上,結合分子生物學檢測,探討芪參合劑防治膿毒癥的新靶點,為膿毒癥的臨床治療提供新的實驗依據。
1 材料與方法
1.1材料
1.1.1實驗動物 健康SPF級雄性SD大鼠40只,6~8周齡,體重180~230 g,購自上海西普爾-必凱實驗動物有限公司,合格證號:2008001683615,許可證號:SCXK(滬)2013-0016,飼養于上海金山公共衛生臨床中心實驗動物部動物生物安全二級(ABSL-2)動物房。實驗大鼠均分籠飼養,自由飲水,室溫(20±2)℃,相對濕度為55%~65%,光照適度,通風潔凈。
1.1.2藥物 中藥復方芪參合劑農本方顆粒由生黃芪30 g、炙黃芪30 g、丹參30 g、川芎15 g組成,購自上海中醫藥大學附屬龍華醫院中藥房。配制成生藥濃度為1 g/ml的藥液,提前配制分裝于4℃保存備用。
1.1.3菌株來源 K.p臨床耐藥菌株(編號:A0222561)為上海中醫藥大學附屬龍華醫院重癥監護病房膿毒癥患者痰培養標本,由檢驗科鑒定贈予,僅對替加環素和多黏菌素E敏感。
1.1.4儀器與試劑 基因擴增儀(Applied Biosysterm公司,ViiA7Real-time PCR);酶標儀(美國Biotek公司,Synergy H4);電泳儀基礎電源、制膠架、電泳轉印槽(Bio-Rad公司);紅外成像系統(美國LI-COR公司,2800);谷丙轉氨酶(alanine pminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、尿素氮(blood urea nitrogen,BUN)及肌酐(creatinine,Cre)試劑盒(南京建成);TAK242試劑(APExBIO公司,A3850);反轉錄試劑盒(日本TaKaRa公司,RR037A);擴增試劑盒(日本ToYoBo公司,QPK-201);TLR4小鼠單克隆抗體(Santa Cruz公司,sc-293072);MyD88兔多克隆抗體(CST公司,4283s)、beta-actin兔單克隆抗體(CST公司,4970s);TRIF兔單克隆抗體(Abcam公司,ab180689);NF-κB p65兔多克隆抗體(Servicebio公司,GB13142-1);大鼠IL-6、TNF-α、MIP-2 ELISA、CXCL1 ELISA試劑盒(上海西唐生物)。
1.2方法
1.2.1細菌懸液制備 平板劃線復蘇細菌后,挑取單個獨立菌落至LB肉湯,置于37℃恒溫空氣搖床,220 r/min振蕩過夜(15~18 h),培養至對數生長期后,麥氏比濁法估算LB肉湯細菌懸液的細菌濃度,最后將細菌懸液離心(4℃、4 000 r/min、15 min)棄上清,無菌PBS重懸稀釋至1×109CFU/ml用于接種[6]。
1.2.2耐藥K.p膿毒癥大鼠模型的建立 造模參照文獻[7]中描述的方法進行。大鼠稱重,3%戊巴比妥鈉30 mg/kg麻醉,無菌條件下,在頸部皮膚切4~5 mm垂直切口,暴露氣管,模型組、芪參合劑組及TAK242組大鼠用1 ml注射器吸取0.1 ml細菌懸液進行氣管內注射,空白組注射0.1 ml生理鹽水。縫合皮膚,接種后將大鼠垂直放置,左右輕輕搖晃大鼠約30 s,以便菌液快速布散遷移至肺泡。將其置于溫和光控鼠籠[(20±2)℃,12 h光/暗循環]中,允許其自由進食飲水。
1.2.3分組及給藥方法 將40只大鼠隨機分為空白組、模型組、芪參合劑組和TAK242組,10只/組。空白組與模型組造模6 h后每日灌胃給予生理鹽水0.2 ml/只,芪參合劑組造模6 h后以9.375 g/(kg·d)灌胃給予芪參合劑,TAK242組造模6 h后以3 mg/kg腹腔注射給予TAK242,1次/d,干預3 d后取材[8]。
1.2.4大鼠支氣管肺泡灌洗液(bronchoalveolar lav-age fluid,BALF)炎癥因子及血清生化指標檢測 根據文獻[9]方法略加調整收集BALF,獲取的BALF于4℃、800 r/min離心10 min,收集上清液并分裝,-80℃保存用于細胞因子檢測,檢測步驟嚴格按照ELISA試劑盒說明書進行。采用頭皮針和無菌非抗凝采血管進行腹主動脈采血,針尖斜面向下,進針30°左右,朝向心端方向刺入腹主動脈采血,室溫靜置2 h,4 000 r/min離心10 min,輕輕吸取上層血清,分裝,-80℃保存備用。ALT、AST、BUN、Cre試劑盒進行血液生化指標檢測,操作方法嚴格遵循試劑盒說明書進行。
1.2.5qRT-PCR檢測肺組織中TLR4、TRIF、MyD88、NF-κB p65 mRNA表達 3%戊巴比妥鈉以30 mg/kg麻醉大鼠,腹主動脈取血致死后取肺組織。稱取肺組織,100 mg/只,組織快速研磨機(60 Hz,120 s)勻漿。按照試劑盒說明書,采用 TRIzol法抽提總 RNA,NanoDrop 2000檢測RNA樣本濃度和純度,逆轉錄合成cDNA。反轉錄條件為37℃ 15 min,85℃ 5 s。qRT-PCR過程使用ToYoBo公司的SYBR?Green Realtime PCR Master Mix試劑盒,所有操作嚴格按照試劑盒使用說明書進行,采用QuantStudioTMReal-Time PCR Software進行數據分析,溶解度曲線評估PCR引物的可靠性,2-ΔΔCt法計算目的基因相對于內參基因β-actin的倍數比較基因的相對表達差異。β-actin內參引物由上海品時繞生物科技有限設計合成;其余引物由上海閃晶分子生物科技有限公司設計合成,引物序列見表1。
1.2.6Western blot檢測肺組織中TLR4、TRIF、MyD88蛋白表達 稱取肺組織100 mg/只,試劑盒測定蛋白濃度,以60 μg/10 μl調整蛋白濃度,加入1×SDS-PAGE蛋白上樣緩沖液,100℃水浴加熱 10 min 進行蛋白變性后分裝置于-80℃保存備用。

表1 目的基因引物序列
取等量蛋白進行 SDS-PAGE 電泳,300 mA 70 min冰上轉膜, 5%脫脂牛奶-1‰TBST室溫搖床封閉2 h,TBST室溫搖床洗膜10 min×4次,加入一抗于4℃搖床孵育過夜。再次洗膜后與相應二抗室溫搖床孵育1 h,再次洗膜3次后加Millipore顯影液,LI-COR紅外成像系統顯影。以β-actin為內參,Image J軟件計算目標蛋白帶灰度值。
1.2.7免疫組化法檢測肺組織中NF-κB p65蛋白表達 肺組織制作石蠟切片,脫水、微波抗原修復,PBS洗滌3次,滴加3%H2O2暗盒孵育30 min,PBS洗滌3次,滴加山羊血清室溫封閉60 min,滴加相應一抗,4℃孵育過夜,PBS洗滌10 min×4次,滴加二抗,室溫孵育60 min,PBS洗滌10 min×4次,DAB顯色3~6 min,自來水沖洗,蘇木素復染3 min,0.1%的HCl中分化數秒,自來水洗3次,氨水返藍,梯度酒精脫水,二甲苯透明,中性樹膠封片、烤片、顯微鏡鏡檢,圖像采集分析。
1.2.8ELISA檢測大鼠肺組織TNF-α、IL-6、MIP-2、CXCL1水平 準確稱取肺組織100 mg/只,全自動樣品快速研磨機獲得組織勻漿,5 000 r/min離心5 min,上清用于TNF-α、IL-6、MIP-2、CXCL1的檢測。所有細胞因子嚴格按照ELISA試劑盒說明書進行。
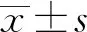
2 結果
2.1BALF炎癥因子檢測結果及血清生化指標檢測結果 表2結果表明,與空白組相比,模型組大鼠BALF中TNF-α、IL-6水平明顯升高,差異有統計學意義(P<0.01)。表3結果表明,與空白組相比,模型組大鼠肝腎功能均出現明顯損傷,血清ALT、AST、BUN、Cre水平明顯高于空白組,差異有統計學意義(P<0.01)。
2.2芪參合劑對大鼠肺組織TLR4通路基因mRNA表達的影響 與空白組相比,模型組、芪參合劑組和TAK242組大鼠肺組織TLR4、MyD88、TRIF、NF-κB p65 mRNA表達明顯升高,差異具有統計學意義(P<0.01)。與模型組相比,芪參合劑組和TAK242組大鼠肺組織TLR4、MyD88、TRIF、NF-κB p65 mRNA表達均降低,差異具有統計學意義(P<0.01),見表4。
2.3芪參合劑對大鼠肺組織TLR4、TRIF、MyD88蛋白表達的影響 與空白組相比,模型組大鼠肺組織中TLR4、MyD88、TRIF蛋白表達明顯升高,差異具有統計學意義(P<0.01),芪參合劑組和TAK242組與空白組相比,TLR4、MyD88、TRIF蛋白表達差異無統計學意義(P>0.05)。與模型組相比,芪參合劑組和TAK242組大鼠肺組織中TLR4、MyD88、TRIF蛋白表達均降低,差異具有統計學意義(P<0.01),見圖1。
2.4芪參合劑對大鼠肺組織NF-κB p65蛋白表達的影響 空白組NF-κB p65顯示弱陽性免疫反應,主要在胞漿中可見淡棕色較均勻的陽性染色,胞核中極少或無陽性染色。而模型組NF-κB p65呈強陽性反應,可見大量陽性細胞,胞漿和胞核中均可見明顯的深棕黃色強陽性染色,表現出明顯的細胞核異位,提示NF-κB p65蛋白已活化。芪參合劑組和TAK242組陽性染色強度較模型組明顯減弱,但與空白組相比仍明顯增強,可見部分核染呈棕黃色的細胞,且染色不均勻,見圖2。

圖1 大鼠肺組織TLR4、TRIF、MyD88 Western Blot結果Fig.1 Results of TLR4,TRIF,MyD88 Western blot in lung tissue of ratsNote:1.Blank group;2.Model group;3.Qishen mixture group;4.TAK242 group.

表2 大鼠BALF中TNF-α、IL-6水平比較
2.5芪參合劑對大鼠肺組織細胞因子水平的影響 與空白組相比,模型組、芪參合劑組和TAK242組大鼠肺組織中TNF-α、IL-6、MIP-2、CXCL1水平明顯升高,差異具有統計學意義(P<0.01)。與模型組相比,芪參合劑組和TAK242組大鼠肺組織中TNF-α、IL-6、MIP-2、CXCL1水平明顯降低,差異具有統計學意義(P<0.01),見表5。

圖2 大鼠肺組織NF-κB p65免疫組化結果(DAB顯色,×400)Fig.2 Immunohistochemical results of NF-κB p65 in lung tissue of rats (DAB coloring,×400)

表3 大鼠血清生化指標比較

表4 大鼠肺組織TLR4、TRIF、MyD88、NF-κB p65 mRNA表達比較

表5 大鼠肺組織TNF-α、IL-6、MIP-2、CXCL1水平比較
3 討論
炎癥和免疫反應是膿毒癥的重要特征,在組織損傷、多系統器官功能衰竭和膿毒癥死亡的發病機制中發揮重要作用[10]。TLR4對病原體的快速識別在引起膿毒癥患者固有免疫應答中發揮關鍵作用[11]。LPS、TLR4信號轉導促使促炎細胞因子家族大量合成和釋放,其中TNF-α和IL-6最為顯著。趨化因子CXCL1和MIP-2也可通過MyD88依賴性途徑合成,MIP-2還可由TRIF依賴性途徑直接合成,TLR4通過MyD88依賴性和TRIF依賴性2種途徑確保免疫細胞產生高水平的CXCL1和MIP-2,導致強烈的嗜中性粒細胞募集反應,在宿主固有免疫防御微生物感染中至關重要[12]。雖然由細菌引發的炎癥反應對于根除細菌病原體是必需的,但過度的炎癥反應對宿主有害,會造成嚴重的組織損傷。因此,抑制TLR4通路的過度激活、保證有效的固有免疫反應對膿毒癥治療可能具有決定性優勢。
TAK242是一種環己烯衍生物,是TLR4信號的小分子抑制劑,可以選擇性地與TLR4的TIR結構域中的Cys747結合,通過破壞TLR4與其接頭分子相互作用抑制TLR4信號轉導[13]。目前已明確TAK242可減少多種炎癥介質,如NO、TNF-α、IL-1、IL-6、IL-10、IL-1β、MIP-2等的產生以及降低LPS攻擊后小鼠的致死率[14-15]。此外,TAK242還可有效地減弱肺中嗜中性粒細胞的激活和積聚,并抑制LPS攻擊誘導的NF-κB的DNA結合活性[16]。TAK242還可顯著抑制肺組織中TLR4、MyD88的表達和NF-κB的活化[17]。另外,TAK242作為治療膿毒癥的潛在藥物已被證明在人體內是安全的[13]。本實驗所用芪參合劑組成為生黃芪、炙黃芪、丹參和川芎,方中黃芪能增強和調節機體免疫力,對宿主固有免疫和特異性免疫均有調節作用,可提高機體的抗病能力,且有實驗證實黃芪注射液可通過改善膿毒癥患者的免疫失衡狀態改善膿毒癥患者的預后[18-19]。現代藥理學研究發現,丹參具有擴張血管、改善微循環、調節宿主免疫功能的作用[20-21]。另外研究證實川芎可通過增強巨噬細胞吞噬功能調節宿主固有免疫[22]。
由于TAK242是TLR4介導的信號轉導通路的特異性抑制劑,TAK242抑制LPS誘導的炎癥反應可通過TLR4介導的信號轉導途徑發揮作用,故以TAK242和芪參合劑對膿毒癥大鼠進行干預來進一步探索芪參合劑固有免疫調節作用的分子機制。本研究結果表明,模型組大鼠BALF中觀察到較高水平的炎癥細胞因子,主要臟器功能亦出現明顯損害,表現為血清ALT、AST、BUN、Cre水平明顯高于空白組,以上結果證實膿毒癥大鼠造模成功,為研究耐藥菌膿毒癥新的治療方案提供實驗基礎。本研究中qRT-PCR結果顯示,耐藥K.p膿毒癥模型組大鼠肺組織TLR4、MyD88、TRIF、NF-κB p65 mRNA水平明顯升高。Western blot結果顯示耐藥K.p膿毒癥模型組大鼠肺組織TLR4、MyD88、TRIF蛋白表達明顯增高;免疫組化結果顯示NF-κB p65蛋白水平明顯升高且核易位明顯,和基因水平變化一致。ELISA結果顯示,耐藥K.p膿毒癥模型組大鼠肺組織細胞因子TNF-α、IL-6、CXCL1、MIP-2水平明顯升高。在芪參合劑和TAK242干預后,代表TLR4通路活化相關的蛋白表達和基因轉錄水平均降低,肺組織中炎癥因子TNF-α、IL-6、CXCL1、MIP-2水平亦明顯降低,推測芪參合劑可能主要通過抑制TLR4/MyD88/NF-κB和TLR4/TRIF/NF-κB信號通路的活化發揮對K.p膿毒癥大鼠的固有免疫調節作用,并減少炎癥因子釋放,使耐藥K.p入侵機體后能發揮有效的固有免疫反應以應對耐藥K.p感染,減輕膿毒癥患者器官功能損傷,治療膿毒癥。

