辣木籽渣組分蛋白的理化與功能性質(zhì)研究
黃志連 付開舉 彭芍丹 黃曉兵 李如一 曹玉坡 周偉 李積華

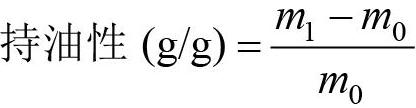

摘? 要:辣木籽渣是辣木籽提取油之后的副產(chǎn)物,為了提高其綜合利用價值,本文以辣木籽渣為原料,通過奧斯本(Osborne)四步法提取清蛋白、球蛋白、谷蛋白和醇溶蛋白,分析比較了4種組分蛋白的理化性質(zhì)及功能特性。結(jié)果表明:清蛋白、球蛋白、谷蛋白和醇溶蛋白的提取率分別為10.34%、0.69%、3.40%和3.65%,純度均在82%以上,清蛋白、球蛋白、谷蛋白的分子量均較低(5~25 kDa),且清蛋白的蛋白條帶濃度最高。此外,清蛋白的溶解性、乳化性、乳化穩(wěn)定性及起泡性均為最優(yōu),但泡沫穩(wěn)定性最差,在靜置120 min后消散。4種組分蛋白的持油性均受溫度的影響,球蛋白受溫度影響最小。本研究表明辣木籽渣是一種較優(yōu)質(zhì)的植物蛋白資源,可為其在食品工業(yè)的加工利用提供理論依據(jù)
關(guān)鍵詞:辣木籽渣;Osborne四步法;組分蛋白;理化性質(zhì);功能特性
中圖分類號:TS255? ? ? 文獻標(biāo)識碼:A
Abstract: Moringa (Moringa oleifera) seed residue is the byproduct after oil extraction from the seed. In this paper, four component proteins (albumin, globulin, glutelin and alcohal-soluble protein) were obtained from the seed residue by the Osborne four-step method in order to improve the comprehensive utilization value of the seed residue. The physicochemical and functional properties of the four proteins were systematically evaluated. The results showed that the extraction rate of albumin, globulin, glutelin and alcohal-soluble protein was respectively 10.34%, 0.69%, 3.40%, and 3.65%, and the purity was above 82%. The molecular weight of albumin, globulin and glutelin was between 5 kDa and 25 kDa, and the protein concentration of albumin band was the highest. The solubility, emulsifying activity index, emulsifying stability index and foamability of albumin were also thebest, whereas the foaming stability wasthe worst. The oil absorption capacity of the four proteins was affected by temperature, of which globulin was the least affected. This study indicated that the moringa seed residue was a high-quality plant protein resource, which could provide a theoretical basis for the processing and utilization in food industry.
Keywords: moringa seed residue; Osborne four-step method; component proteins; physicochemical properties; functional properties
DOI: 10.3969/j.issn.1000-2561.2021.01.033
辣木(Moringa oleifera Lam.)屬辣木科(Moringaceae)辣木屬(Moringa),是一種熱帶落葉樹,原產(chǎn)于印度北部和非洲地區(qū),現(xiàn)廣泛分布于熱帶和亞熱帶地區(qū),在中國廣東、廣西、云南、海南等省均有種植[1]。辣木喜光、耐干旱且耐貧瘠,對降雨量和土壤等自然條件具有很強的適應(yīng)性,易存活且生長迅速,具有相當(dāng)?shù)纳a(chǎn)規(guī)模[2]。辣木籽是辣木營養(yǎng)成分和經(jīng)濟價值較高的部位之一,具有高蛋白、高油脂的特點,含有豐富的維生素、甾醇、生育酚、氨基酸和微量元素[3-4],能起到抗衰老、美白、調(diào)節(jié)免疫功能、抗紫外線、抗腫瘤、降低血糖和降低心血管疾病風(fēng)險等作用,具有較大的食用和藥用的前景[5-6]。其中,辣木籽脂肪含量為35%~40%,高于常用的食用油加工原料大豆(約20%)[7]。有研究表明,辣木籽油含有豐富的油酸(約76%)和棕櫚酸(約12%),可作為橄欖油的替代品,或用于化妝品等領(lǐng)域[8]。此外,辣木籽中還含有約35%的蛋白質(zhì),遠高于花生(約23%)、葵花子(約20%)、腰果(約21%)等堅果種子蛋白,且辣木籽蛋白富含人體所需的必需氨基酸,是一種較為優(yōu)質(zhì)的蛋白質(zhì)[9]。目前,國內(nèi)外對于辣木籽的研究主要集中在辣木籽油的提取工藝優(yōu)化及組分分析[10]、辣木籽在凈化污水中的應(yīng)用[11]、辣木籽蛋白的提取工藝優(yōu)化[12]、辣木籽的抗氧化活性[13]等,而對于食品工業(yè)中榨油后的含有豐富蛋白質(zhì)的辣木籽渣研究甚少,導(dǎo)致辣木籽渣被廢棄或停留在作為動物飼料等初級利用階段。因此,為提高資源的綜合利用,增加辣木籽渣的附加值,提取辣木籽渣中蛋白并對其基本性質(zhì)進行表征具有重要的意義。
本研究主要采用Osborne四步法從辣木籽渣中提取清蛋白、球蛋白、谷蛋白和醇溶蛋白,并對各組分蛋白的理化性質(zhì)和功能特性進行研究,為提高辣木籽渣的綜合利用以及其組分蛋白的精深加工提供理論基礎(chǔ)。
1? 材料與方法
1.1? 材料
1.1.1? 材料與試劑? 辣木籽渣,由河南金辣木生物科技有限公司提供;純凈水,由德國達姆施塔特Millipore公司Milliq Integral 3系統(tǒng)生產(chǎn);大豆油,購自本地超市;氯化鈉、硫酸銨、無水乙醇、氫氧化鈉、鹽酸等化學(xué)試劑均為分析純。
1.1.2? 儀器與設(shè)備? UV1780紫外可見分光光度計,日本Shimadzu 公司;FJ200-SH高速分散機,上海滬析有限公司;LC-20A低溫高速離心機,德國Sigma公司;Christ Alpha 1-4/2-4 LD plus凍干機,德國Marin Christ公司;FE20–Five Easy Plus? pH計,瑞士Mettler Toledo 公司;KjeltecTM 8400自動凱氏定氮儀,福斯華(北京)科貿(mào)有限公司;HH.601恒溫水浴鍋,金壇市恒豐儀器制造有限公司;DF-101S集熱式恒溫磁力攪拌器,鞏義市予華儀器有限責(zé)任公司。
1.2? 方法
1.2.1? 辣木籽渣脫脂粉的制備? 將一定量色澤均勻的辣木籽渣在萬能粉碎機中粉碎15 s,重復(fù)3次后過60目篩,放置于干燥器中,備用。將粉碎后的辣木籽渣與沸程30~60 ℃石油醚按1∶8的料液比混合,在室溫下磁力攪拌8 h,過濾,重復(fù)脫脂3次,干燥,得到辣木籽渣脫脂粉。
1.2.2? 辣木籽渣組分蛋白的提取? 組分蛋白的提取參考Osborne四步法[14]。稱量一定質(zhì)量的辣木籽渣脫脂粉,與10倍體積0.15 mol/L NaCl溶液混合,在室溫下磁力攪拌2 h,4800 r/min離心后收集上清液,重復(fù)提取1次,合并上清液。上清液用硫酸銨調(diào)至25%的飽和度,靜置1 h后離心,去除沉淀,繼續(xù)加入硫酸銨使溶液硫酸銨飽和度達到80%,靜置1 h,離心,收集沉淀。沉淀在4 ℃下透析5 d,離心,上清液即為清蛋白,沉淀為球蛋白。氯化鈉溶液提取后的殘渣依次用70%乙醇溶液、0.1 mol/L NaOH溶液按照上述步驟提取,得到醇溶蛋白、谷蛋白。
1.2.3? 提取率及營養(yǎng)成分的測定? 蛋白質(zhì)含量(蛋白質(zhì)純度)測定采用GB/T 5009.5—2010的凱氏定氮法(蛋白質(zhì)換算系數(shù)F為6.25);粗脂肪含量測定采用GB/T 14772—2008的索氏提取法;水分含量測定采用GB 5009.3—2010的直接干燥法。
蛋白質(zhì)提取率按下式計算∶
式中:C0為辣木籽渣的蛋白質(zhì)含量,m0為提取辣木籽渣的質(zhì)量,C1為提取蛋白的純度,m1為提取得到的蛋白質(zhì)質(zhì)量。
1.2.4? SDS-PAGE? SDS-PAGE參照Ma等[15]的方法稍加修改。在SDS-Tris-甘氨酸間斷緩沖體系使用4%~20%梯度凝膠進行測定。蛋白樣品用磷酸緩沖液稀釋至1.5 mg/mL。用移液槍吸取30 μL蛋白質(zhì)樣品液與10 μL上樣緩沖液混合,沸水浴7 min,離心,得到蛋白樣品上清液。分別在凝膠道中加入10 μL蛋白樣品上清液和SDS-PAGE標(biāo)品,在恒壓120 V下進行電泳,直到溴酚藍染料的前沿遷移至距凝膠下端約1 cm時,結(jié)束電泳。用5 g/L考馬斯亮藍(R-250)染色2 h,在脫色液中脫色1 h。
1.2.5? 溶解性的測定? 溶解性的測定參考Adebiyi等[16]的方法稍加修改。分別稱取一定質(zhì)量的清蛋白、球蛋白、醇溶蛋白、谷蛋白,配置濃度為1%的蛋白質(zhì)溶液后,用1 mol/L HCl溶液和1 mol/L NaOH溶液調(diào)節(jié)pH為3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,離心,得到樣品溶液。以牛血清蛋白為標(biāo)品,用考馬斯亮藍G-250法測定上清液中蛋白質(zhì)的含量。
1.2.6? 持油性的測定? 持油性的測定參考李曉明等[17]的方法稍加修改。稱取0.50 g清蛋白、球蛋白、谷蛋白、醇溶蛋白于10 mL離心管中,用移液槍加入2 mL大豆油,振蕩1 min;分別置于5、25、45、65、85 ℃水浴鍋水浴30 min,4800 r/min離心10 min,棄去上層大豆油,稱重,根據(jù)以下公式計算蛋白質(zhì)持油性。
式中:m0為樣品干質(zhì)量,m1為離心后殘留物質(zhì)量。
1.2.7? 乳化性及乳化穩(wěn)定性? 乳化性及乳化穩(wěn)定性參考Zhang等[18]的方法稍加修改。分別制備2%的清蛋白、球蛋白、醇溶蛋白、谷蛋白,按20∶1的體積比加入大豆油,均質(zhì)。立即吸取底部的乳狀液50 μL,并用1% SDS溶液稀釋100倍;10 min后,再一次取樣。以0.1% SDS溶液為空白,在500 nm下測定吸光值。乳化性(emulsifying activity index,EAI)、乳化穩(wěn)定性(emulsifying stability index,ESI)計算公式如下∶
式中:D是稀釋倍數(shù)(100),C是初始蛋白濃度(g/mL),L是光程(1 cm),θ是形成乳液的油的體積分?jǐn)?shù)(0.048),A0和A10分別是在0 min和10 min時測的稀釋后的乳化液的吸光值。
1.2.8? 起泡性及泡沫穩(wěn)定性? 起泡性及泡沫穩(wěn)定性的測定參考Kaushik等[19]的方法并稍加修改。分別稱取0.1 g的清蛋白、球蛋白、醇溶蛋白、谷蛋白于100 mL量筒中,加入30 mL蒸餾水溶解,磁力攪拌30 min,高速勻漿機攪打1 min,靜置,分別讀取0、5、10、30、60、90、120、180 min的泡沫體積。起泡性和泡沫穩(wěn)定性的計算公式如下∶
式中:V0為攪拌均質(zhì)前溶液體積,V1為0 min時測得的體積,Vt為攪拌均質(zhì)后不同時間點測得的體積。
1.3? 數(shù)據(jù)處理
每組試驗均進行了3次重復(fù)。采用SSPS17.0軟件進行方差分析(P<0.05),數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示,采用Origin 8.5軟件作圖。
2? 結(jié)果與分析
2.1? 辣木籽渣組分蛋白的提取率及基本成分
辣木籽渣組分蛋白的提取率及基本成分分析結(jié)果見表1。清蛋白、球蛋白、谷蛋白和醇溶蛋白的提取率分別為10.34%、0.69%、3.40%、3.65%,清蛋白是辣木籽渣蛋白的主要成分。辣木籽渣中各組分蛋白的粗脂肪含量均低于1%,說明使用石油醚能較好地去除辣木籽渣的脂肪,且蛋白純度均高于82%,說明提取得到的辣木籽渣組分蛋白雜質(zhì)較少。
2.2? SDS-PAGE
辣木籽渣中各組分蛋白在非還原條件下測定的SDS-PAGE圖譜如圖1所示。結(jié)果表明辣木籽渣中各組分蛋白的組成差異較大;球蛋白的分子量范圍在15~20 kDa,谷蛋白的分子量集中在5~20 kDa,清蛋白的分子量范圍在5~25 kDa,且清蛋白的蛋白條帶的濃度最大,醇溶蛋白未檢測出。
2.3? 溶解性
辣木籽渣組分蛋白的溶解性如圖2所示。在不同的pH條件下,4種蛋白的溶解曲線有明顯的差異,且清蛋白均表現(xiàn)出了較好的溶解性(≥67.04%)。清蛋白在pH 4.0時溶解性最高,達到86.19%,隨著pH的升高,溶解性變小;而谷蛋白則相反,在pH 4.0時,谷蛋白的溶解性最低(43.64%)。醇溶蛋白的溶解性曲線呈小U型,在pH 5.0時溶解性最低(17.08%);球蛋白在pH 5.0時溶解性最高(28.17%),在pH 8.0時溶解性最低(13.62%)。
2.4? 持油性
辣木籽渣中各組分蛋白在不同溫度下的持油性結(jié)果如圖3所示,在常溫下(25 ℃)球蛋白的持油性最好,其次是谷蛋白和清蛋白,醇溶蛋白的持油性最差。在低溫(5 ℃)下,谷蛋白的持油性隨著溫度的升高稍微減少,在25 ℃達到最低點(8.15 g/g),之后隨著溫度的升高持油性升高。球蛋白恰好與谷蛋白相反,在25 ℃時達到最高點(9.32 g/g),且與其他組分蛋白相比,球蛋白受溫度的影響較小。清蛋白的持油性先隨著溫度的升高而減少,在45 ℃時持油性達到最低點(6.72 g/g);之后,隨著溫度的升高,清蛋白的持油性增加,在85 ℃時持油性達到10.69 g/g。醇溶蛋白在5 ℃的低溫下,持油性最小,為4.14 g/g。
2.5? 乳化性及乳化穩(wěn)定性
由表2可知,清蛋白的乳化性及乳化穩(wěn)定性最好,分別為10.12 m2/g、24.54 min,其次是谷蛋白,醇溶蛋白的乳化性及乳化穩(wěn)定性性最差。這與圖2中的蛋白質(zhì)在pH 7.0時的溶解性相對應(yīng),說明乳化性及乳化穩(wěn)定性與蛋白質(zhì)的溶解性有一定的正相關(guān)性。
2.6? 起泡及泡沫穩(wěn)定性
由圖4可知,辣木籽渣中清蛋白、球蛋白、谷蛋白和醇溶蛋白的起泡性分別為21.11%、10.00%、20.00%、8.89%;其中清蛋白的起泡性最好,其次是谷蛋白,醇溶蛋白最差,這與辣木籽渣組分蛋白在pH 7.0時溶解性相一致。由圖5辣木籽渣中各組分蛋白的泡沫穩(wěn)定性可知,谷蛋白的泡沫穩(wěn)定性最好,其次是球蛋白、醇溶蛋白,?而清蛋白的泡沫穩(wěn)定性較差。
3? 討論
植物蛋白因具有持油性、乳化性、起泡性等性能,已成為食品工業(yè)加工中必不可少的部分。尋找新型的植物蛋白資源代替動物蛋白是現(xiàn)今研究的熱點方向。辣木籽中含有較高的蛋白質(zhì)(達35%)[9],但現(xiàn)有的加工方式主要是提取其油脂,蛋白在榨油后的籽渣中并未得到很好的利用。采用Osborne四步法可解析植物蛋白中各組分蛋白的功能性質(zhì),為針對性提取組分蛋白并加工利用提供技術(shù)指導(dǎo)。
本研究以辣木籽渣為原料,通過Osborne四步法提取辣木籽渣中各組分蛋白(清蛋白、球蛋白、谷蛋白、醇溶蛋白),系統(tǒng)分析了4種組分蛋白的理化性質(zhì)及功能特性。研究發(fā)現(xiàn),辣木籽渣中清蛋白提取率較高(10.34%±0.090%)。SDS-PAGE測定結(jié)果與Chen等[20]研究發(fā)現(xiàn)辣木籽蛋白主要由5個蛋白帶組成,且蛋白質(zhì)分子量均較低(3.4~20 kDa)的結(jié)果相吻合。未檢測出醇溶蛋白,可能是因為“辣木籽醇溶蛋白中95.48%的分子量低于0.9 kDa”而沒有檢測出來[21]。
蛋白質(zhì)溶解性能反映蛋白溶解和聚集的情況,也是反映蛋白質(zhì)在水油界面吸附和遷移速度的基本指標(biāo),因此探究蛋白質(zhì)在不同pH下的溶解度對其在食品工業(yè)中的應(yīng)用有一定的指導(dǎo)意義[22]。本研究結(jié)果顯示,在不同的pH條件下,辣木籽渣中清蛋白表現(xiàn)出了良好的溶解性(≥67.04%),高于其他3種組分蛋白,這一結(jié)果與非洲山藥種子[23]相類似,也與澳洲堅果蛋白[14]在各pH下溶解度均大于60%相類似,但當(dāng)pH<7時辣木籽渣清蛋白的溶解度(74.62%~86.19%)較澳洲堅果蛋白(60%~70%)要高,較為耐酸。蛋白質(zhì)在等電點附近的相互作用會增強,靜電斥力下降,導(dǎo)致蛋白質(zhì)發(fā)生沉淀或聚集,出現(xiàn)較低的溶解性。4種辣木籽渣組分蛋白在不同的pH條件下出現(xiàn)最低溶解度,這可能是組分蛋白的等電點各不相同導(dǎo)致的。辣木籽谷蛋白的溶解性優(yōu)于澳洲堅果谷蛋白的溶解性,而清蛋白的溶解性則與之相當(dāng)[14]。球蛋白和醇溶蛋白的溶解性較差,可能是因為其疏水氨基酸的含量較高,限制了蛋白質(zhì)分子與水的相互作用。
持油性表示蛋白質(zhì)與油脂結(jié)合的能力,在食品加工中風(fēng)味保留和改善口感等方面起到較為重要的作用[24]。4種組分蛋白的持油性均受溫度的影響,其中球蛋白隨著溫度的改變持油性的波動較小,且在常溫下辣木籽渣清蛋白、球蛋白、谷蛋白、醇溶蛋白的持油性分別為8.09、9.32、8.15、4.94 g/g,均高于杏鮑菇清蛋白(5.59 mL/g)[25]、玉米醇溶蛋白(約4.80 g/g)[26]和花生蛋白(1.255 g/g)[27],這一結(jié)果表明辣木籽渣組分蛋白在控制脂肪吸收具有一定的應(yīng)用空間。辣木籽渣組分蛋白在不同溫度下持油性的差異表明了這4種蛋白的分子結(jié)構(gòu)及組成存在較大的差異性,這與蛋白質(zhì)的SDS-PAGE相對應(yīng)。在常溫下,辣木籽渣組分蛋白的持油性均優(yōu)于向日葵濃縮蛋白(3.00 g/g)[28]、椰子粕蛋白(2.60 g/g)[29]。這表明辣木籽渣組分蛋白能應(yīng)用于食品工業(yè)中油脂含量高的食品(如素肉、烘培食品)中,起到較好的穩(wěn)定作用。
乳化性及乳化穩(wěn)定性是蛋白質(zhì)可作為乳化劑的2個重要指標(biāo)。蛋白質(zhì)是兩性物質(zhì),通過劇烈的攪打可形成具有良好穩(wěn)定性的物理屏障油水界面,因而被作為乳化劑廣泛應(yīng)用于食品行業(yè)中[30]。本研究表明,清蛋白的乳化性及乳化穩(wěn)定性(10.12 m2/g、24.54 min)、起泡性(21.11%)均較優(yōu),且其乳化性與菠蘿蜜種子分離蛋白(乳化性9.72 m2/g)[31]相當(dāng),這表明清蛋白在冰淇淋、巧克力等食品加工方面具有較大的應(yīng)用潛能。起泡性是反映蛋白質(zhì)在溶液中被攪打產(chǎn)生泡沫能力的指標(biāo),泡沫穩(wěn)定性是表示蛋白質(zhì)維持泡沫以防止破裂和聚集的能力的指標(biāo)[32]。谷蛋白的泡沫穩(wěn)定性較優(yōu),在靜置180 min后,泡沫穩(wěn)定性為35.71%,優(yōu)于黑茶蛋白(靜置60 min后,泡沫穩(wěn)定性為24.07%)[33],這表明谷蛋白可以較好地在烘培食品中維持產(chǎn)品地疏松結(jié)構(gòu)或良好口感。泡沫穩(wěn)定性與分子間的粘度有關(guān),粘度越大,膜的強度越大,泡沫就越穩(wěn)定。清蛋白的泡沫穩(wěn)定性較差,表明清蛋白形成的泡沫強度不大,泡沫較易消散。
本研究通過對辣木籽渣各組分蛋白的理化和功能特性進行解析,結(jié)果表明辣木籽渣組分蛋白可在食品工業(yè)中作為乳化劑、持油劑、發(fā)泡劑等使用,可成為一種新的具有潛在應(yīng)用價值的植物蛋白資源。同時,辣木籽渣蛋白質(zhì)的解析研究也可為提高辣木籽的綜合利用率,增加其附加值提供新思路。下一步,將就辣木籽渣組分蛋白的具體性能在食品工業(yè)中的應(yīng)用開展深入研究,以期為辣木籽渣蛋白的應(yīng)用方向提供技術(shù)指導(dǎo)。
參考文獻
康丹丹, 李照瑩, 董浩瀾, 等. 辣木葉蛋白質(zhì)酶解產(chǎn)物的制備及其抗菌活性研究[J]. 食品工業(yè)科技, 2019, 40(8): 114-119.
韓學(xué)琴, 趙? 廣, 廖承飛, 等. 水分脅迫對辣木生物量分配和水分利用效率的影響[J]. 熱帶作物學(xué)報, 2018, 39(6): 1045-1049.
Alessandro L, Alberto S, Alberto B, et al. Moringa oleifera seeds and oil: characteristics and uses for human health[J]. International Journal of Molecular Sciences, 2016, 17(12): 2141.
郭夢橋, 徐海軍, 王曉飛, 等. 辣木種子結(jié)構(gòu)及營養(yǎng)器官發(fā)育過程解剖學(xué)研究[J]. 熱帶作物學(xué)報, 2017, 38(6): 1075-1080.
王麗虹, 許? 悅, 劉? 陽. 辣木籽中活性物質(zhì)及其生理功能研究進展[J]. 食品研究與開發(fā), 2019, 40(4): 190-195.
Rahman I M M, Barua S, Nazimuddin M, et al. Physicochemical properties of Moringa oleifera Lam. seed oil of the indigenous-cultivar of Bangladesh[J]. Journal of Food Lipids, 2009, 16(4): 540-553.
Nadeem M, Imran M. Promising features of Moringa oleifera oil: recent updates and perspectives[J]. Lipids in Health and Disease, 2016, 15(1): 212.
Oliveira J T A, Silveira S B, Vasconcelos I M, et al. Compositional and nutritional attributes of seeds from the multiple purpose tree Moringa oleifera Lamarck[J]. Journal of the Science of Food and Agriculture, 1999, 79(6): 815-820.
Falowo A B, Mukumbo F E, Idamokoro E M, et al. Multi-functional application of Moringa oleifera Lam. in nutrition and animal food products: A review[J]. Food Research International, 2018, 106: 317-334.
李美萍, 李彩林, 張生萬, 等. 響應(yīng)面法優(yōu)化辣木籽油超聲輔助提取工藝及其脂肪酸組成[J]. 中國油脂, 2019, 44(6): 14-18.
Kebede T G, Dube S, Nindi M M. Removal of non-steroidal anti-inflammatory drugs (NSAIDs) and carbamazepine from wastewater using water-soluble protein extracted from Moringa stenopetala seeds[J]. Journal of Environmental Chemical Engineering, 2018, 6(2): 3095-3103.
王標(biāo)詩, 李雪兒, 梁小慧, 等. 響應(yīng)面法優(yōu)化水酶法提取辣木籽蛋白質(zhì)的工藝及其功能性質(zhì)研究[J]. 天然產(chǎn)物研究與開發(fā), 2019, 31(4): 587-594, 674.
楊? 迎, 謝? 凡, 龔勝祥, 等. 響應(yīng)面法優(yōu)化辣木籽多酚提取工藝及其抗氧化活性[J]. 食品工業(yè)科技, 2018, 39(3): 172-178.
彭? 倩. 澳洲堅果蛋白組分及分離蛋白的理化與功能性質(zhì)研究[D]. 南昌: 南昌大學(xué), 2018.
Ma M, Ren Y, Xie W, et al. Physicochemical and functional properties of protein isolate obtained from cottonseed meal[J]. Food Chemistry, 2018, 240: 856-862.
Adebiyi A P, Aluko R E. Functional properties of protein fractions obtained from commercial yellow field pea (Pisum sativum L.) seed protein isolate[J]. Food Chemistry, 2011, 128(4): 902-908.
李曉明, 陳? 凱, 黃占旺, 等. 白玉菇蛋白提取工藝優(yōu)化及其功能特性研究[J]. 食品與發(fā)酵工業(yè), 2020, 46(4): 239-246.
Zhang Y J, Zhou X, Zhong J Z, et al. Effect of pH on emulsification performance of a new functional protein from jackfruit seeds[J]. Food Hydrocolloids, 2019, 93: 325-334.
Kaushik P, Dowling K, McKnight S, et al. Preparation, characterization and functional properties of flax seed protein isolate[J]. Food Chemistry, 2016, 197: 212-220.
Chen R, Wang X J, Zhang Y Y, et al. Simultaneous extraction and separation of oil, proteins, and glucosinolates from Moringa oleifera seeds[J]. Food Chemistry, 2019, 300: 125162.
Baptista A T A, Silva M O, Gomes R G, et al. Protein fractionation of seeds of Moringa oleifera Lam. and its application in superficial water treatment[J]. Separation and Purification Technology, 2017, 180: 114-124.
彭? 倩, 顏小燕, 李雨婷, 等. 鹽提和堿提酸沉兩種方法提取腰果蛋白的結(jié)構(gòu)及其功能性質(zhì)分析[J]. 食品科學(xué), 2017, 38(23): 75-81.
Ajibola C F, Malomo S A, Fagbemi T N, et al. Polypeptide composition and functional properties of African yam bean seed (Sphenostylis stenocarpa) albumin, globulin and protein concentrate[J]. Food Hydrocolloids, 2016, 56: 189-200.
Gao L L, Li Y Q, Wang Z S, et al. Physicochemical characteristics and functionality of tree peony (Paeonia suffruticosa Andr.) seed protein[J]. Food Chemistry, 2018, 240: 980-988.
魏君慧, 薛? 媛, 馮? 莉, 等. 杏鮑菇分離蛋白和清蛋白的理化性質(zhì)及功能分析[J]. 食品科學(xué), 2018, 39(18): 54-60.
王曉杰, 劉曉蘭, 叢萬鎖, 等. 殼寡糖酶法糖基化修飾對玉米醇溶蛋白功能性質(zhì)的影響[J]. 食品科學(xué), 2018, 39(8): 13-20.
彭? 輝, 寧程茜, 胡傳榮, 等. 兩種方法提取花生蛋白功能特性的對比研究[J]. 食品工業(yè), 2015, 36(11): 171-175.
Kabirullah M, Wills R B H. Functional properties of acetylated and succinylated sunflower protein isolate[J]. International Journal of Food Science & Technology, 1982, 17(2): 235-249.
Rodsamran P, Sothornvit R. Physicochemical and functional properties of protein concentrate from by-product of coconut processing[J]. Food Chemistry, 2018, 241: 364-371.
Xiao J, Wang X A, Gonzalez A J P. Kafirin nanoparticles- stabilized Pickering emulsions: microstructure and rheological behavior[J]. Food Hydrocolloids, 2016, 54: 30-39.
Zhang Y J, Zhou X, Zhong JZ, et al. Effect of pH on emulsification performance of a new functional protein from jackfruit seeds[J]. Food Hydrocolloids, 2019, 93: 325-334.
Hu H, Li-Chan E C Y, Wan L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids, 2013, 32(2): 303-311.
Ren Z Y, Chen Z Z, Zhang Y Y, et al. Functional properties and structural profiles of water-insoluble proteins from three types of tea residues[J]. LWT-Food Science and Technology, 2019, 110: 324-331.
責(zé)任編輯:崔麗虹

