Hsp60表達下調通過促進TGFBI分泌增強膀胱癌細胞侵襲轉移
陳彥斌 ,張 波,夏先鹍,袁建林,楊 帆
(1.勉縣縣醫院藥劑科,陜西漢中 724200;;2.勉縣紅十字會醫院,陜西漢中 724200;3.安康市中醫醫院,陜西安康 724299;4.空軍軍醫大學第一附屬醫院西京醫院泌尿外科,陜西西安 710032;5.空軍軍醫大學第二附屬醫院唐都醫院泌尿外科,陜西西安 710038)
膀胱癌是泌尿系最常見的惡性腫瘤之一,其可分為非肌層浸潤性膀胱癌和肌層浸潤性膀胱癌兩種類型。非肌層浸潤性膀胱癌惡性程度低,預后較好,然而當其進展為肌層浸潤型膀胱癌時,其惡性程度顯著升高且進展迅速預后極差,成為膀胱癌致死的主要原因[1]。因此探尋膀胱癌侵襲轉移的機制成為膀胱癌臨床監測及治療亟待解決的棘手問題。
熱休克蛋白60(heat shock protein 60,HsP60)是定位于線粒體內的蛋白伴侶分子,其能夠以腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)依賴的方式促進線粒體蛋白的折疊在維持線粒體功能方面發揮著重要的作用[2]。研究發現腫瘤組織中Hsp60的表達存在顯著異常且參與腫瘤的惡性進展[3-5]。膀胱癌組織中Hsp60表達下調能夠顯著影響膀胱癌的放化療及免疫治療效果[6-7],然而Hsp60否參與膀胱癌的轉移目前尚不清楚。
轉化生長因子β誘導蛋白(transforming growth factor beta induced,TGFBI)是一種轉化生長因子β誘導分泌的細胞外基質蛋白,又稱βig-H3,能夠與整合素α3β1、α5β3和α5β5等相互作用介導細胞的粘附和遷移[8-9]。研究發現膀胱癌細胞中TGFBI的表達及分泌顯著增高且能夠促進膀胱癌細胞發生上皮細胞-間充質轉化(epithelial to mesenchymal transition,EMT)及轉移[8,10],然而何種因素導致膀胱癌細胞中TGFBI表達上調目前尚不完全明確。
本研究我們系統分析了Hsp60在膀胱癌組織的表達與膀胱癌分期分級的相關性,在膀胱癌細胞中敲低Hsp60表達后觀察膀胱癌侵襲遷移能力的變化,以期發現膀胱癌轉移的新機制為臨床預防及治療轉移性膀胱癌提供新的靶分子。
1 材料與方法
1.1 材料與儀器膀胱癌組織來源于西京醫院泌尿外科2018年1月1日—2020年12月30日期間確診及收治的95例膀胱癌患者,所有膀胱癌組織均經過病理確診為膀胱癌,經石蠟包埋為組織石蠟塊,后送南京弗瑞思生物科技有限公司制備為膀胱癌組織芯片。膀胱癌患者血清為同期西京醫院泌尿外科收治的膀胱癌患者。所有參與實驗的患者均簽署了患者知情同意書并均經過西京醫院倫理委員會審核通過。
人膀胱癌細胞株UM-UC-3細胞購自賽百慷(上海)生物技術股份有限公司(iCell Bioscience Inc,Shanghai);MEM培養基購自Hyclone公司;胎牛血清購自生工生物工程股份有限公司;青鏈霉素混合液購自索萊寶公司;表達Hsp60shRNA的腺病毒載體構建及包裝、TGFBI siRNA,HIF1α siRNA 以及Hsp60引物購自上海吉瑪公司;實時定量PCR試劑盒購自TaKaRa公司;即用型免疫組化EliVisionTM plus試劑盒、加強型DAB Plus Kit購自福州邁新試劑公司;小鼠抗人Hsp60單克隆抗體、小鼠抗人β肌動蛋白(β-actin)單克隆抗體購自Abcam公司;兔抗人HIF1α單克隆抗體購自Cell Signaling Technology公司;兔抗人TGFBI多克隆抗體購自Novus生物技術公司;MitoSOXTMRed線粒體超氧化物指示劑購自賽默飛世爾科技有限公司;TGFBI ELISA檢測試劑盒購自Abcamb公司;FV1000共聚焦顯微鏡和YM310倒置顯微鏡購自Olympus公司;NovoCyte流式細胞儀購自艾森生物有限公司。
1.2 免疫組化檢測膀胱癌組織Hsp60的表達將石蠟組織芯片經二甲苯單脫蠟后在體積分數為100%、95%、80%、75%的乙醇中進行水化,然后在10 mmol/L檸檬酸鈉緩沖液(pH=6.0)中進行高壓抗原修復(90 s);待自然冷卻后用PBS沖洗3 min×3次,3% H2O2的溶液孵育20 min祛除內源性過氧化物酶;PBS沖洗3 min×3次;非免疫山羊血清室溫封閉20 min;4 ℃下加一抗體孵育過夜。用PBS洗滌5 min×3次;室溫下加辣根過氧化物酶結合的EnVision+System二抗孵育2 h;PBS洗滌5 min×3次;加DAB顯色3 min;自來水沖洗。蘇木精染色進行復染;鹽酸乙醇脫色1 s;自來水沖洗,淡氨水反藍;然后梯度乙醇由低至高及二甲苯洗滌脫水。免疫組化結果評分評分由2名病理學家根據每張玻片(200倍放大)5個鏡下視野內陽性細胞的比例和強度獨立評估。比例評分表示估計的陽性染色腫瘤細胞比例,分配如下:0(0~9%),1(10%~25%),2(26%~50%),3(51%~75%) or 4(76%~100%)。強度評分表示陽性腫瘤細胞的平均強度,分為0(未染色)、1(弱染色)、2(中等染色)或3(深染色)。然后將比例和強度分數相乘得到總分,總分范圍為0~12。
1.3 qPCR檢測Hsp60穩定干涉膀胱癌細胞Hsp60的干涉效果使用Trizol從膀胱癌細胞分離總RNA,DNAse處理后利用SuperScript Ⅱ逆轉錄酶進行反轉錄。將得到的cDNA用于qRT-PCR模板,利用Hsp60引物5’-AAGCTCTAAGTACACT-CGTCTTGAATAGG-3’和5’-GCACCACCAGTAGCAATAGCCATAT-3’和β-actin為5’-TGACCCAGATCATGTTTGAG-3’和5’-CGTAC-AGGGATAGCACAG-3’。使用SYBR Green PCR商品化試劑盒擴增cDNA。每25 μL反應體積包含上述反轉錄生成的cDNA 2 μL,SYBR Green mix 12.5 μL,每對寡核苷酸引物10 μmol/L。循環參數開始于95 ℃ 5 min的初始變性步驟;95 ℃15 s,60 ℃ 30 s,72 ℃15 s,共40個循環。β-actin作為內參基因,采用2-△△Ct法計算目的基因mRNA的含量,每個樣品做3個復孔,實驗重復3次。
1.4 Western-blot檢測Hsp60、TGFBI及HIF-1α等的表達將6孔板培養的細胞棄上清,PBS清洗3遍,用濾紙吸干殘余液體,加70 μL RIPA裂解液及蛋白酶抑制劑,冰上孵育30 min,細胞刮子將裂解的蛋白刮至ependof管,4 ℃,12 000 r/min離心30 min,收集上清液為細胞總蛋白;BCA蛋白定量試劑盒測定蛋白濃度;5×蛋白上樣緩沖液稀釋,100 ℃煮沸10 min;SDS電泳分離蛋白;轉膜至PVDC膜上;BSA封閉30 min;加抗Hsp60抗體(1∶1 000),抗TGFBI抗體(1∶1 000)或者抗HIF1α抗體(1∶1 000)4 ℃過夜;TBST洗膜 5 min×3次;加辣根過氧化物酶標記的山羊抗兔/鼠IgG(1∶10 000),室溫孵育1 h;TBST洗5 min×4次;化學發光顯影;每組實驗至少重復3次。
1.5 Hsp60穩定干涉細胞系的建立膀胱癌細胞以6×105的密度接種至6孔板過夜,將包裝好的攜帶Hsp60shRNA基因的腺病毒以感染復數(multi-plicity of infection,MOI)=5的密度加入膀胱癌細胞培養上清中,37 ℃孵育6 h后換液,用不含嘌呤霉素的培養基培養72 h后,加入含有嘌呤霉素的培養基加壓培養1周后,qPCR及Western-blot檢測干涉效果(shRNA-Hsp60:5’-TGCAGGCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGG-AGAATTTTTTC-3’)。
1.6 siRNA干涉膀胱癌細胞TGFBI或者HIF1α的表達膀胱癌細胞以5×105的密度接種至6孔板過夜,按照lipo3000說明書用無血清培養基配置lipo3000包裹siRNA的脂質體微球,棄去細胞上清加500 μL的無血清培養基,將配置好的包裹siRNA的脂質體微球點狀均勻加至細胞培養上清中,米字搖晃,37 ℃培養6 h后,換含血清的正常培養基,72 h后,Western-blot檢測干涉效果(TGFBI siRNA:CGGGAAGGCGATCATCTCCAA;HIF1α siRNA:GCAAGGCCTTACATGTTAA;siRNA Ctrl:5’-UUCUCCGAACGUGUCACGUTT-3’)。
1.7 ELISA檢測細胞培養上清TGFBI的濃度Hsp60穩定干涉的膀胱癌細胞及對照組細胞培養48 h后收集上清。按照TGFBI ELISA檢測試劑盒中說明書的操作方法進行檢測;膀胱癌患者外周血需取3 mL于無抗凝管中,2 h之內分離血清,-80 ℃ 保存,然后使用ELISA檢測試劑盒。
1.8 Transwell實驗檢測干涉Hsp60表達后膀胱癌細胞侵襲轉移能力的改變將Hsp60穩定干涉的膀胱癌細胞及對照組細胞以3×104的密度接種至鋪有Matrige膠或者沒有鋪Matrige膠的Transwell小室的上室中,下腔室含有0.6 mL含100 g/L胎牛血清的培養基。細胞孵育12 h(轉移)或24 h(侵襲)后,取上室用棉簽擦去小室內部未穿出的細胞,用40 g/L多聚甲醛固定上室穿出的細胞,用40 g/L結晶紫溶液染色。顯微鏡下以20倍放大率捕捉5個隨機視場進行分析。每個樣品設3個復孔。
1.9 劃痕實驗檢測干涉Hsp60表達后膀胱癌細胞遷移能力的改變在24孔板上接種膀胱癌細胞,待細胞密度長至80%時,用200 μL移液槍的槍頭在24孔培養板劃一條等寬的直線,用無血清培養基將劃落的細胞清洗干凈后再加無血清培養基繼續培養,12 h在20倍物鏡下捕捉圖像。采用Image J軟件(NIH,MD,USA)計算創面愈合面積。遷移率(%)=(0 h創面面積12 h或者24 h創面面積)/0 h創面面積×100%。
1.10 MitoSOX檢測線粒體活性氧的變化將膀胱癌細胞接種至6孔板,待細胞密度長至70%左右時棄去細胞培養上清。用PBS洗3次,用無血清培養基按比例1∶1 000稀釋加DCFH-DA熒光探針,在細胞培養箱中孵育25 min,棄去上清,PBS洗滌3次,再加入無血清培養基。共聚焦顯微鏡下攝取熒光圖片,并計算熒光強度。每個樣品3個復孔。

2 結 果
2.1 膀胱癌組織Hsp60表達降低與膀胱癌的分化及臨床密切相關免疫組化檢測膀胱癌組織Hsp60蛋白的表達,結果顯示:Hsp60蛋白局限性表達在膀胱癌細胞的胞質中,且在浸潤性膀胱癌組織中的表達水平顯著低于非浸潤性膀胱癌組織(圖1A),免疫組化評分進一步確認:與非浸潤性膀胱癌組織相比,Hsp60在浸潤性膀胱癌組織中的表達顯著降低(圖1B)。根據免疫組化評分中位數(5.468±1.846)將膀胱癌患者分為Hsp60高表達組及Hsp60低表達組。統計學分析結果進一步證實:膀胱癌組織Hsp60的表達與膀胱癌的臨床分期,分級以及復發等顯著相關,而與膀胱癌患者的年齡、性別、飲酒史、抽煙史等沒有顯著的相關性(表1)。

A:免疫組化檢測Hsp60蛋白的表達差異;B:Hsp60的免疫組化評分值。圖1 免疫組化檢測膀胱癌組織Hsp60蛋白的表達

表1 Hsp60表達與膀胱癌患者臨床參數的相關性 [例(%)]
2.2 干涉Hsp60表達膀胱癌細胞的侵襲遷移能力顯著增強利用表達Hsp60shRNA的重組腺病毒載體感染膀胱癌細胞UM-UC-3,構建Hsp60穩定干涉的膀胱癌細胞株。qPCR及Western-blot檢測Hsp60的干涉效果,結果顯示:穩轉細胞中Hsp60的mRNA及蛋白表達均被顯著抑制(圖2A、B)。進一步檢測Hsp60表達變化對膀胱癌細胞侵襲轉移的影響。Transwell實驗結果顯示:干涉膀胱癌細胞Hsp60表達后,膀胱癌細胞的侵襲遷移能力均顯著增強(圖2C)。劃痕實驗進一步證實:Hsp60干涉后膀胱癌細胞的遷移能力顯著增強(圖2D)。這些結果均提示:Hsp60表達降低能夠增強促進膀胱癌細胞的侵襲轉移。
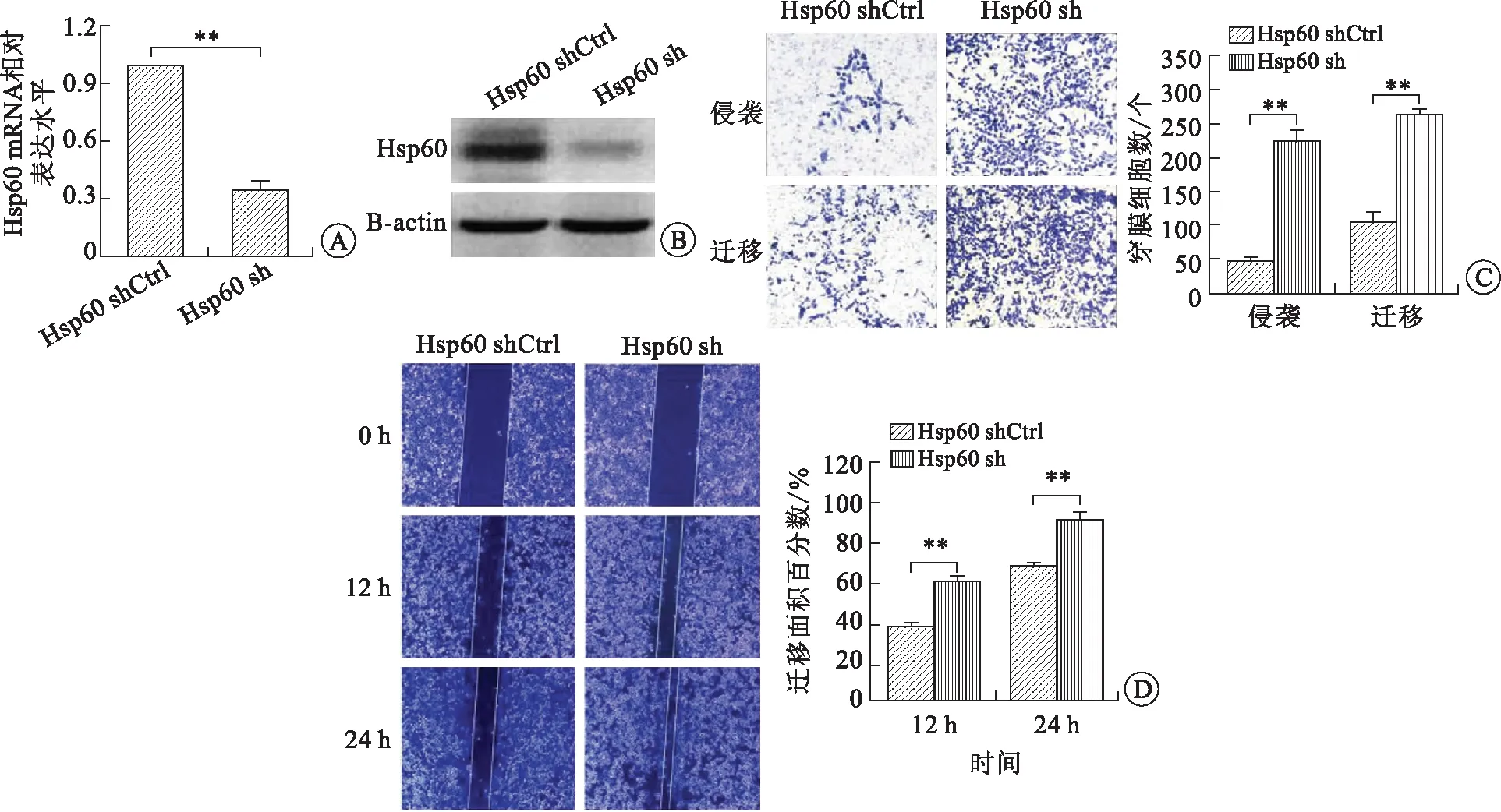
A:qPCR檢測Hsp60 mRNA的表達;B:Western-blot檢測蛋白的表達;C:Transwell實驗檢測膀胱癌細胞的侵襲遷移;D:劃痕實驗檢測膀胱癌細胞遷移。圖2 干涉Hsp60表達后,檢測膀胱癌細胞侵襲轉移能力的改變
2.3 干涉膀胱癌細胞Hsp60表達促進TGFBI的表達RNA-Seq分析結果顯示:與對照組相比,Hsp60穩定干涉膀胱癌細胞中TGFBI基因的表達顯著升高(圖3A)。Western-blot檢測Hsp60表達對TGFBI蛋白的影響,結果顯示:干涉Hsp60表達后,膀胱癌細胞中TGFBI蛋白表達較對照組顯著升高(圖3B)。ELISA檢測結果顯示:與對照組相比,Hsp60干涉的膀胱癌細胞培養上清中TGFBI的分泌也顯著增加(圖3C)。進一步檢測18例Hsp60高表達膀胱癌患者及20例Hsp60低表達膀胱患者血清中TGFBI水平,結果顯示:Hsp60低表達膀胱癌患者血清中TGFBI的表達水平顯著高于Hsp60高表達膀胱癌患者血清中的TGFBI(圖3D)。這些結果均提示:Hsp60表達降低促進了TGFBI的表達。
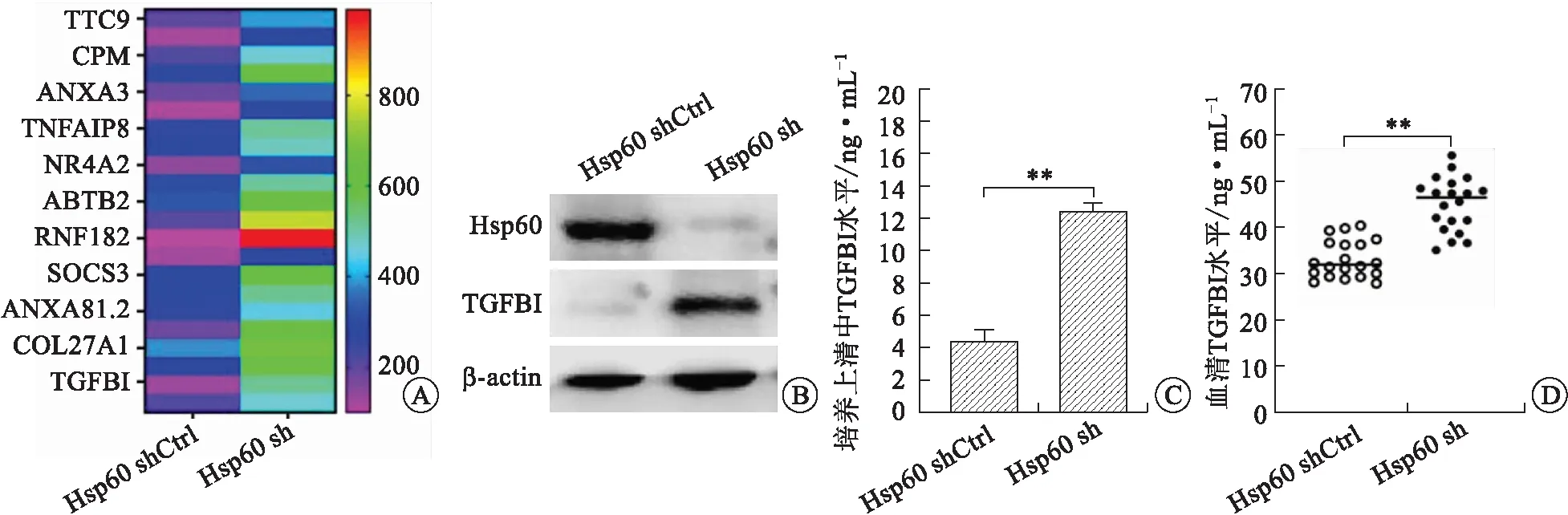
A:RNA-seq分析基因的差異表達;B:Western-blot檢測Hsp60及TGFBI蛋白;C:ELISA檢測培養上清中的TGFBI蛋白;D:ELISA檢測血清TGFBI蛋白。圖3 Hsp60對TGFBI表達的影響
2.4 膀胱癌細胞中Hsp60表達降低通過促進TGFBI促進膀胱癌細胞轉移文獻報道TGFBI是促進腫瘤侵襲轉移重要因素,因此我們進一步探索干涉Hsp60表達能否通過TGFBI促進膀胱癌細胞的侵襲遷移。利用TGFBI siRNA特異性阻斷Hsp60穩定干涉膀胱癌細胞中TGFBI的表達,Transwell結果顯示:干涉TGFBI表達后,Hsp60表達降低導致的膀胱癌細胞侵襲遷移能力增強被顯著抑制;同時劃痕實驗也證實:干涉TGFBI后,Hsp60表達降低所導致膀胱癌細胞遷移能力增強也被顯著抑制。這些結果均提示:干涉Hsp60表達所導致的膀胱癌細胞的侵襲遷移是通過TGFBI介導的。
2.5 干涉Hsp60表達降低通過ROS/HIF1a通路促進TGFBI的表達我們首先檢測膀胱癌細胞Hsp60表達降低能否影響ROS/HIF1α信號通路。MitoSOX染色結果顯示:干涉Hsp60表達后,膀胱癌細胞內線粒體ROS的水平顯著升高(圖5A、B);同時Western-blot結果顯示:干涉Hsp60表達后,膀胱癌細胞內HIF1α的表達顯著升高(圖5B)。利用MitoTEMP祛除Hsp60穩定干涉膀胱癌細胞內的線粒體ROS后,Western-blot結果顯示:Hsp60干涉導致的HIF1α及TGFBI表達升高均被顯著抑制(圖5C);同時利用siRNA干涉Hsp60穩定干涉膀胱癌細胞內的HIF1α表達后,發現Hsp60敲低導致TGFBI表達升高也被顯著抑制(圖5D)。這些結果提示:干涉Hsp60表達誘導的TGFBI表達是通過ROS/HIF1α通路調控的。

A、B:Transwell實驗檢測膀胱癌細胞的侵襲遷移;C、D:劃痕實驗檢測膀胱癌細胞的遷移。圖4 干涉TGFBI顯著抑制Hsp60干涉導致的膀胱癌細胞侵襲遷移增強

A:MitoSOX檢測膀胱癌細胞ROS水平;B:統計學分析膀胱癌細胞ROS水平;C~E:Western-blot;C:干涉Hsp60表達顯著增加膀胱癌細胞HIF1α的表達;D:MitoTEMP去除線粒體ROS,可顯著降低Hsp60穩定干涉膀胱癌細胞內TGFBI的表達;E:HIF1α siRNA膀胱癌可顯著降低Hsp60穩定干涉膀胱癌細胞內TGFBI的表達。圖5 干涉Hsp60表達可通過ROS/HIF1α信號通路促進膀胱癌細胞TGFBI的表達
3 討 論
本研究揭示了Hsp60在浸潤性膀胱癌組織中的表達較非浸潤性膀胱癌組織顯著降低,統計學分析結果顯示:Hsp60表達與膀胱癌患者的臨床分期、分級及復發顯著相關。細胞學實驗證實:干涉Hsp60表達可通過ROS/HIF1α信號通路上調TGFBI表達促進膀胱癌細胞的侵襲轉移。
以往的研究發現Hsp60與腫瘤的侵襲轉移密切相關[3]。PISELLI等[11]發現Hsp60與CD44v5/v6,ICAM-1等協同表達能夠促進胰腺癌的轉移。另有研究發現Hsp60在結直腸癌組織中異常表達與結直腸癌的淋巴結轉移密切相關[5]。ZHANG等[12]研究發現肝癌組織Hsp60表達顯著下調且能夠促進肝癌細胞的去分化及侵襲轉移。膀胱癌組織Hsp60表達下調與膀胱癌患者預后不良有關[13]。在侵襲性或高危淺表性膀胱癌中,Hsp60表達低的膀胱癌患者其對新輔助化療的反應性越差[7]。我們的研究發現:與非浸潤性膀胱癌相比,Hsp60在浸潤性膀胱癌組織中的表達顯著降低。干涉Hsp60表達后,膀胱癌細胞的侵襲遷移能力顯著增強,我們的研究揭示了Hsp60表達降低促進膀胱癌惡性進展具體機制,為預測膀胱癌的轉移提供了新的標記分子同時為轉移性膀胱癌的治療提供了新的潛在靶點。
TGFBI作為一種細胞外基質蛋白其能夠通過與黏附素結合,激活金屬蛋白酶或者促進新生血管生成等方式促進腫瘤細胞的侵襲轉移[14]。在轉移性結直腸癌中TGFBI的表達顯著上調且與腫瘤分級和轉移潛能的增加相關[15]。在骨肉瘤、前列腺癌細胞中抑制TGFBI表達可顯著降低腫瘤的轉移[16-17]。在胰腺癌癥轉移模型中,分離出血液循環癌細胞,這些細胞在體內和體外都有高的轉移潛能,通過對這些高惡性細胞的mRNA分析發現,TGFBI是原發和惡性胰腺癌細胞株中變化幅度最大的基因[18]。乳腺癌細胞中TGFBI的表達升高能夠促進乳腺癌細胞發生EMT及轉移[9]。膀胱癌細胞TGFBI表達顯著上調且能夠增強膀胱癌細胞的侵襲轉移[10]。我們的研究發現干涉膀胱癌細胞Hsp60表達能夠顯著促進TGFBI的表達,利用siRNA阻斷膀胱癌細胞Hsp60干涉膀胱癌細胞內TGFBI的表達可顯著抑制Hsp60表達下調導致的膀胱癌細胞侵襲轉移潛能增加。我們的研究揭示了Hsp60表達下調促進膀胱癌轉移的新機制。
TGFBI的表達受缺氧誘導因子HIF-1的調控[18]。活性氧不僅在缺氧條件下上調HIF-1的表達,還可以在多種應激狀態下上調HIF1的表達。Hsp60是維持線粒體活氧化呼吸鏈ROS生成的重要因素[19]。在膠質母細胞瘤細胞中干涉Hsp60表達能夠顯著上調細胞內ROS水平。蛋白組學分析揭示:Hsp60沉默增能夠導致線粒體氧化呼吸鏈復合物I亞基的下調,導致呼吸鏈功能紊亂,產生過量的ROS[20]。我們的研究發現干涉Hsp60表達后,膀胱癌細胞ROS水平及HIF1a的表達均顯著升高。清除ROS或者抑制HIF1a表達均可抑制Hsp60干涉導致TGFBI表達上調,提示膀胱癌細胞Hsp60下調通過ROS/HIF1a信號通路促進膀TGFBI表達。
我們的研究揭示了Hsp60在膀胱癌組織表達下調促進膀胱侵襲轉移的作用及機制,為臨床膀胱癌侵襲轉移的監測及治療提供新的潛在靶點。

