實驗動物病理組織切片質量評價體系與回顧性分析
喬 欣 李 夢 焦 昆 李勝利
(首都醫科大學實驗動物部,北京 100069)
病理診斷技術在實驗動物相關科學研究中發揮著重要作用,是人類疾病動物模型檢驗、藥理毒理學分析及實驗動物疾病診斷中最為基本的一種形態學檢驗技術。病理組織切片制作則是病理診斷的基礎和必要條件。病理診斷的準確性,取決于病理組織切片制作質量的高低。制片過程中,操作方法和技巧是制作出優質病理切片的前提保證。為提高病理組織切片制作效果,保證病理診斷的準確性和嚴謹性,對本實驗動物病理室前期制作的1 800件切片質量予以分析,以期進一步改進實驗動物常規切片的制作,提高病理切片制作質量。
1 材料和方法
1.1 切片選取
從本實驗室兩年內制作完成的病理石蠟切片中隨機選取1 800件作為研究對象,根據組織切片制備質量控制評價標準對選取的病理切片進行質量評估,觀察樣本切片存在的質量缺陷、統計壞片率及分析導致切片出現質量缺陷的原因。
1.2 評價標準
評價標準共包括切片完整等10個方面,每個小項標準滿分均為10分,滿分100分。根據質量缺陷適當減分,具體見表1。評價分≥ 90 分為甲級片(優),75~89 分為乙級片(良),60~74 分為丙級片(基本合格),0~59 分為丁級片(不合格)。優片率=[(甲級片+乙級片)/病理切片總件數]×100.0%,壞片率=[(基本合格+不合格)/ 病理切片總件數]×100.0%。

表1 蘇木素-伊紅(HE)染色切片質量的基本評價標準
2 結果
2.1 病理切片質量統計結果
在抽取研究的1 800 件病理切片中,甲級片有567 件(31.50%),乙 級 片 有1 056件(58.67%), 切 片 優 片 率 為 90.17%(1 623/1 800),其余177件均存在不同程度的質量缺陷,壞片率為9.83%(177/1 800)。具體切片質量情況見表2。
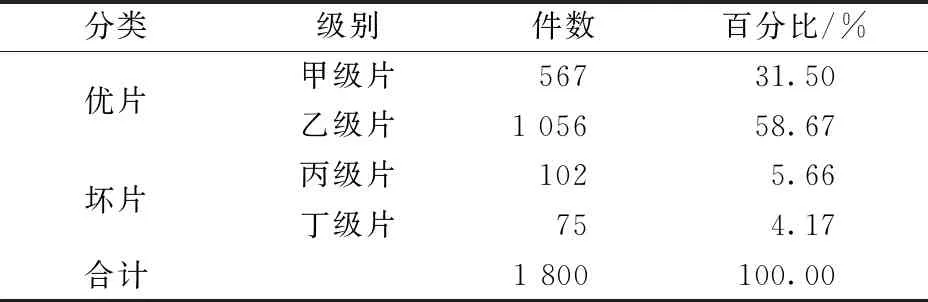
表2 各級別病理切片統計結果
2.2 壞片分類及原因分析
對評估出現的177件壞片予以分析,發現導致壞片的原因多系操作不當,其中尤以取材和標本固定不當為主,試劑試藥原因占比較低。出現壞片具體原因見表3。
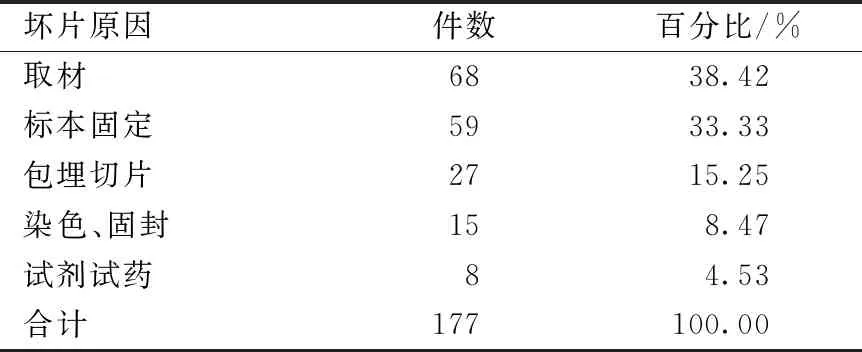
表3 導致壞片原因
3 討論
實驗動物病理切片是獸醫病理學家做出病理診斷的重要依據。切片質量優劣取決于病理切片制作過程的規范性及病理技術人員工作的嚴謹性,極大程度上影響病理診斷的準確性。病理切片制作過程的復雜性和繁瑣環節,無論是取材、固定、脫水透明,還是浸蠟包埋、貼片、染色封片等,上述諸多環節中,任何一個節點出現問題都將對切片質量造成一定的影響。當然,病理切片出現質量錯誤原因既可能系操作不當,也可能是器械、試劑試藥等外因所致。結合實驗動物病理工作實踐,對實驗動物病理切片制作過程中存在的問題進行歸納、分析及總結,并提出有效的解決方法,對推進實驗動物科學相關研究工作意義重大。
本研究共選取 1 800 件制作完成的病理切片,其中1 623 件符合甲、乙級切片標準,優良率為 90.17%,剩余177件均存在不同程度的質量缺陷,壞片率為9.83%。結果證明,實驗室病理切片制作質量控制嚴格,優良率在90%以上,壞片率控制在10%以下,基本上達到了病理室技術工作要求[1],能夠滿足科研需要,但切片優級率為31.5%,低于業界指標,說明制片技術仍有待于進一步提高。從統計結果看出,導致出現壞片的原因主要在于取材、標本固定、包埋切片、染色固封等環節,上述節點所致壞片比例分別為 38.42%、33.33%、15.25%和8.47%,而試劑試藥原因占比較小。壞片可以發生在切片制作的任何環節。根據上述壞片原因現將處理方法總結如下:(1)規范取材。取材要盡量做到保持組織自然形態、完整性、代表性、時效性、順序性和全面性,避免人為改變組織形態。為便于病理讀片時辨認組織和識別病變,取材時應選取病變顯著區與較健康區交界處和可疑病灶,組織塊大小以1.5 cm × 1.0 cm × 0.5 cm為宜(不含穿刺取材),而較大的病灶可以反映病變各階段及病灶各層形態,故此類病灶取材時宜從中心到外周多部位順序取材,而特殊形狀器官可特殊處理。本研究涉及的因取材所致壞片中有部分系因取材不及時,組織出現了自溶,繼而影響到切片質量,也有部分壞片系因所取組織塊偏大,組織固定不充分而受到影響;(2)選擇適合的固定液及保證充足的固定時間。固定時,固定液應新鮮,新配制的固定液最佳,避免因久放儲存而影響固定效果。另外,固定液量應充足,至少為固定組織體積的5倍以上,且液面能夠沒過組織表面。容器大小同樣非常重要,要避免強行把組織塊塞入小口容器,以免損傷病理組織及固定完成后不易取出組織塊。固定期間使用搖床攪動組織或晃動容器有利于固定液的滲入。鑒于實驗動物病理工作涉及到的組織標本來自多種動物,且標本來源及動物年齡參差不齊,故固定要盡可能依據組織種類、性質及大小、固定液的種類、性質及滲透力、搖床轉速、環境溫度、實驗目的等掌握最佳固定時間。如使用同種固定液,老年動物病理標本較幼齡動物標本固定時間應適當延長,小型豬或非人靈長類實驗動物病理標本固定時間也要延長、小鼠標本固定時間略長。固定時間過短會導致組織結構不清晰且染色效果不佳,而固定時間過長則會導致組織過硬難以制片。目前,新型混合固定液的使用范圍增大,其可以達到縮短固定時間、固定液對制片者毒性降低等效果[2]。另外,固定方式的改良,如肺臟負壓固定、氣管灌注固定[3]以及神經系統組織取材前,進行循環系統灌注,均可取得良好效果;(3)提升包埋與切片技巧。包埋工作對切片質量具有一定影響,需引起重視。王鳳龍[4]指出,可依據環境溫度選擇包埋用石蠟熔點,即:熔點較高的硬蠟應在環境溫度高時使用,而熔點較低的軟蠟則適用于室溫偏低時。組織包埋時,應考慮石蠟種類、浸蠟溫度、組織塊大小、石蠟硬度等因素,合理包埋。切片是制片的關鍵步驟。切片時,用力均勻穩定,切速緩和均一,厚度一致。切片可以是單張,也可以是連續切片形成蠟帶。切片可根據室溫摸索適合蠟塊的處理方法(4 ℃預冷),避免出現刀痕,以保持組織的完整性、切片的厚度均一等。另外,及時變更刀片切點既有利于保證切片質量也利于節約,提高刀片使用時間;(4)試劑試藥及時更換。存放時間過長,或其它不確定因素,均可導致試劑試藥變質,繼而將直接影響到切片制作中的組織脫水、透明、浸蠟等過程。嚴重時,還會導致污染標本,最終影響診斷。本研究出現的部分壞片,因未能及時更換變質的試劑試藥所致。
總之,高質量實驗動物病理切片的制備,涉及到制作過程的各個步驟,需要認真、細致及嚴謹。快速制作高水平切片需要長期摸索條件和改進方法,如超聲波的應用極大縮短制片時間[5]。改進、提升和發展病理切片制作技術,對推進實驗動物科研工作具有重要意義。

