射干種子萌發(fā)抑制物特性研究
杜逍,陳昊天,梁偉玲,趙敏,劉艷芬,武玉翠
(河北工程大學園林與生態(tài)工程學院,河北 邯鄲 056038)
射干(Belamcanda chinensis L.)為鳶尾科射干屬多年生直立草本藥用植物,以黃褐色塊狀根莖入藥,味苦、性寒,有清熱解毒、消痰、利咽的功效,可用于熱毒痰火郁結、咽喉腫痛、痰涎壅盛、咳嗽氣喘的治療[1]。成熟種莢分3 室,每室有3~11 粒種子,種子近球形,質(zhì)地堅硬,外被黑色有光澤的假種皮,內(nèi)部有細網(wǎng)紋[2]。目前,射干主要靠種子和根莖繁殖。由于根莖繁殖效率較低,且容易導致藥材品質(zhì)退化,因此應盡量尋求種子繁殖。但是,在自然狀態(tài)下,射干種子發(fā)芽率較低、發(fā)芽不整齊,且萌發(fā)時間較長,需要20~30 d。因此,提高種子發(fā)芽率,縮短萌發(fā)時間,是提高射干繁殖效率的關鍵所在[2,3]。
利用射干種子吸水試驗,通過觀察去皮和帶皮射干種子的萌發(fā)情況,研究種皮對射干種子萌發(fā)的影響;并進一步利用射干種皮和胚乳浸提液對小麥種子萌發(fā)及幼苗生長的影響試驗,探究影響射干種子萌發(fā)的內(nèi)源抑制物質(zhì)及其存在部位,旨為提高射干繁殖的生產(chǎn)效率提供參考。
1 材料與方法
1.1 試驗材料
射干種子采自河北工程大學校園內(nèi),曬干后備用。小麥品種為金麥54 號,由河北金穗種業(yè)開發(fā)有限公司生產(chǎn)。射干種苗栽培基質(zhì)購自河北奧龍園藝有限公司。
1.2 試驗方法
1.2.1 射干種子形態(tài)觀察 選取飽滿的射干種子,肉眼觀察其結構特征;然后放到蒸餾水中浸泡24 h[4],用解剖針剝開種皮,置于放大鏡下觀察種皮和胚乳的形態(tài)。
1.2.2 射干種子吸水性測定 取帶皮射干種子2 g,置于裝有50 mL 蒸餾水的100 mL 燒杯中浸泡,每隔一定時間取出稱重1 次。先用濾紙吸干種子表面浮水,稱重后再次吸水,反復數(shù)次至種子質(zhì)量不再變化[5]。繪制射干種子的吸水曲線[6]。
1.2.3 射干種皮對種子萌發(fā)的影響 取射干種子若干粒,用機械手段去除其黑色種皮。將去皮和帶皮的種子分別播種于裝有栽培基質(zhì)的花盆(直徑135 mm、高19 mm)中,播種深度2 cm,播種量50 粒/盆,3次重復,在自然條件下進行培養(yǎng)[6]。播種15 d 后,每天上午觀察并記錄1 次種子的發(fā)芽數(shù)量,觀察期為1 個月。計算射干種子的發(fā)芽率和發(fā)芽勢:
發(fā)芽率=種子萌發(fā)數(shù)量/50×100%
發(fā)芽勢=培養(yǎng)22 d 種子的萌發(fā)數(shù)量/50×100%
1.2.4 射干種子不同部位浸提液對小麥種子萌發(fā)和幼苗生長的影響 將射干種皮放入粉碎機內(nèi)充分打碎,稱取0.6 g,用蒸餾水分別定容至10、15 和20 mL,在室溫下浸泡36 h 后用定量濾紙過濾,得到濃度分別為0.06、0.04 和0.03 g/mL 的種皮浸提液;取射干胚乳碾碎,稱取0.6 g,用蒸餾水定容至10 mL,在室溫下浸泡36 h 后用定量濾紙過濾,得到濃度為0.06 g/mL的胚乳浸提液。在直徑100 mm 的培養(yǎng)皿中鋪4 層濾紙,放置小麥種子100 粒,加入5 mL 射干種子浸提物溶液進行處理,試驗設0.06、0.04 和0.03 g/mL 種皮浸提液以及0.06 g/mL 胚乳浸提液4 個處理,以加入5 mL 蒸餾水為對照(CK),每處理均3 次重復。在溫度23 ℃、1 200 lx 光照6 h/黑暗6 h 環(huán)境下培養(yǎng),期間每隔2 h 統(tǒng)計1 次小麥種子的萌發(fā)數(shù)量,計算種子發(fā)芽勢;培養(yǎng)28 h 后,以小麥種子露白為標準,每隔10 h 統(tǒng)計1 次小麥種子的萌發(fā)數(shù)量,培養(yǎng)至72 h 結束,計算小麥種子發(fā)芽率和萌發(fā)抑制率。培養(yǎng)5 d 后,測量小麥根長和苗高,計算根長和苗高抑制率。培養(yǎng)期間,噴灑蒸餾水保持濾紙濕潤。
發(fā)芽勢=培養(yǎng)0~24 h 種子的萌發(fā)數(shù)量/100×100%
萌發(fā)抑制率=(1-處理組種子萌發(fā)數(shù)量/對照組種子萌發(fā)數(shù)量)×100%
根長抑制率=(處理組根長-對照組根長)/對照組根長×100%
苗高抑制率=(處理組苗高-對照組苗高)/對照組根長苗高×100%
1.3 數(shù)據(jù)處理與分析
采用Excel 軟件對試驗數(shù)據(jù)進行統(tǒng)計分析和方差分析等。
2 結果與分析
2.1 射干種子的形態(tài)特征
觀察發(fā)現(xiàn),射干種子呈卵圓形,直徑0.35~0.60 cm,表面黑色、有光澤;種皮墨綠色或黑色,質(zhì)地較柔軟,放大鏡下觀察有細網(wǎng)紋;胚乳白色,質(zhì)地堅硬,均勻分布于胚外側(cè),占據(jù)種子大部分空間。
2.2 射干種子的吸水性特征
隨著浸泡時間的延長,射干種子的凈吸水量增加呈先快后慢的趨勢變化(圖1)。其中,浸泡6 h 內(nèi)指標值呈直線上升趨勢,凈吸水量約占種子總吸水量的36.59%;浸泡6~36 h,種子仍保持較快的吸水速率;浸泡36~60 h,種子凈吸水量增加緩慢;浸泡60 h 后,種子凈吸水量幾乎不再增加,種子吸水基本達到飽和。射干種子吸水過程所表現(xiàn)的3 個階段符合其他種子的吸水規(guī)律,說明射干種皮具備通暢吸水透水的能力,并不存在嚴重的透水障礙。因此推測,種皮的透水性不是導致射干種子休眠的主要原因。
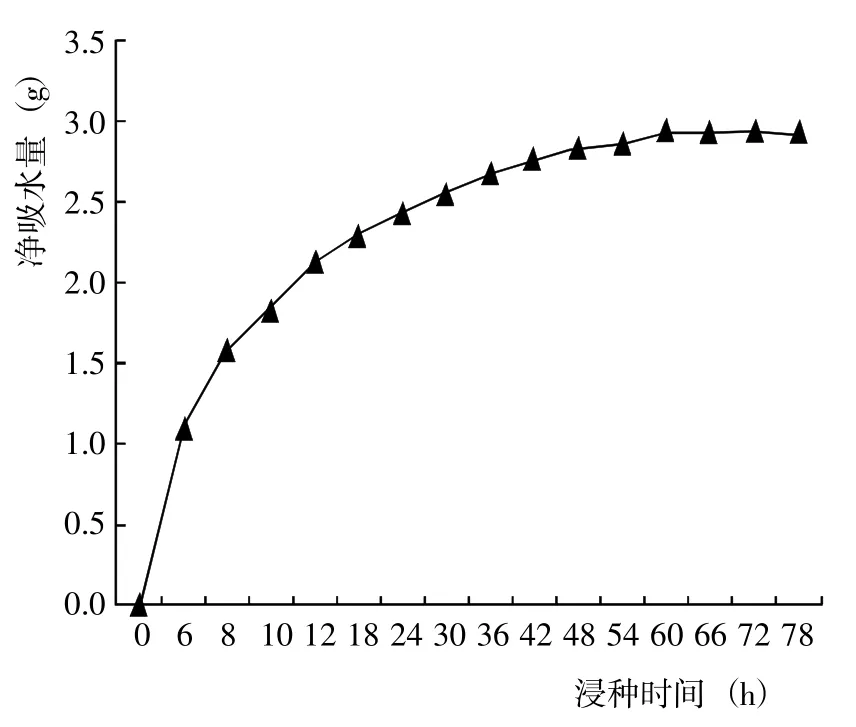
圖1 射干種子的吸水曲線Fig.1 Water sorption curve of B. chinensis
2.3 射干種皮對種子萌發(fā)的影響
射干去皮種子的發(fā)芽數(shù)量(圖2)、發(fā)芽率和發(fā)芽勢(表1)均顯著>帶皮種子,其中發(fā)芽率為帶皮種子的1.71 倍,且萌發(fā)的幼苗比較強壯。表明射干種皮對種子萌發(fā)具有明顯的抑制作用,去皮可以明顯促進射干種子萌發(fā)。
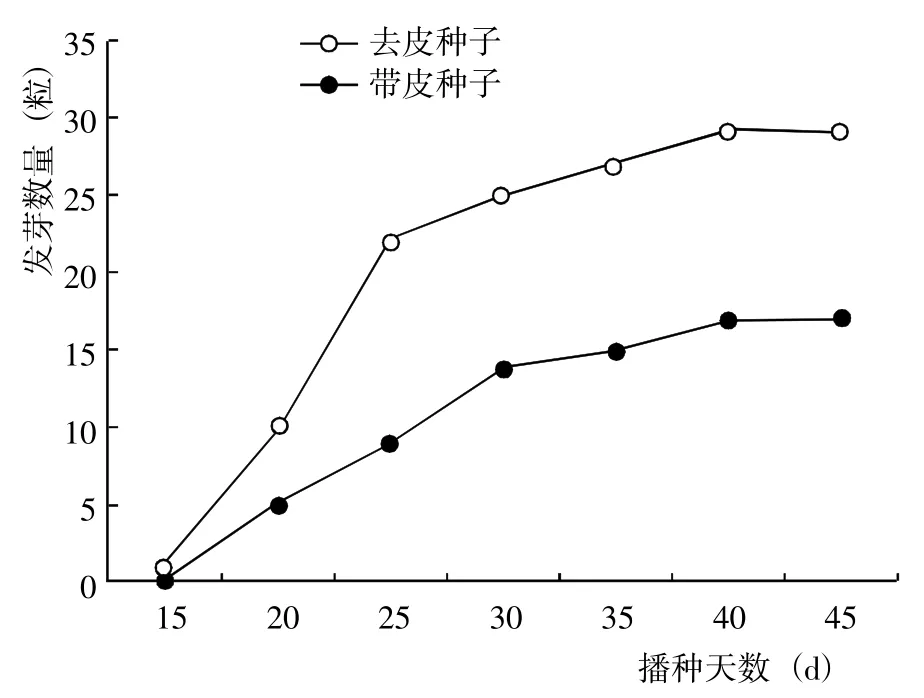
圖2 射干去皮和帶皮種子的發(fā)芽數(shù)量Fig.2 Germination quantity of B. chinensis seeds without and with seed coats

表1 射干種子的發(fā)芽率和發(fā)芽勢Table 1 Germination rate and germination potential of B. chinensis seeds (%)
2.4 射干種子不同部位浸提液對小麥種子萌發(fā)和幼苗生長的影響
2.4.1 對小麥種子萌發(fā)的影響 射干種子不同部位浸提液處理的小麥種子萌發(fā)率均<CK,其中種皮浸提液處理影響較大,而胚乳浸提液處理的指標值與CK 差異始終不顯著(圖3)。表明射干種子不同部位浸提液均對小麥種子萌發(fā)具有一定的抑制作用,其中射干種皮浸提液的抑制作用明顯,且抑制效果也明顯高于胚乳浸提液。
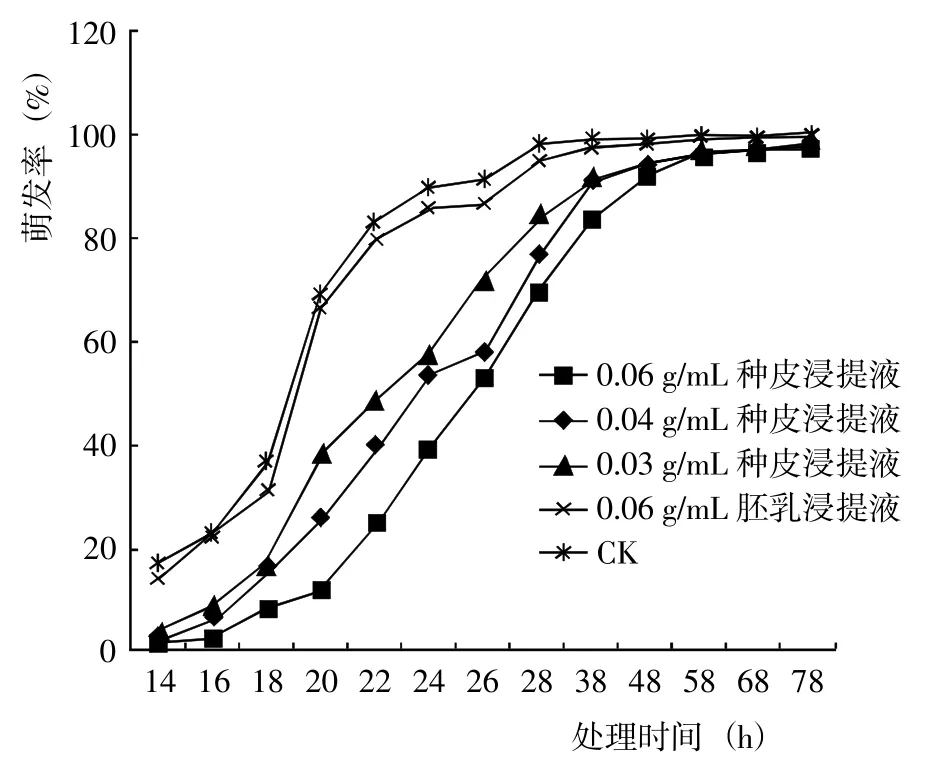
圖3 射干種子不同部位浸提液對小麥種子萌發(fā)的影響Fig.3 Effects of difference extract from B. chinensis on the germination of wheat seeds
射干種皮浸提液處理的小麥種子培養(yǎng)14~38 h,萌發(fā)數(shù)明顯較少,發(fā)芽率顯著<CK;培養(yǎng)38~56 h,種子陸續(xù)萌發(fā),發(fā)芽率與CK 差異逐漸減小;培養(yǎng)72 h后,種子發(fā)芽率均≥97.67%,不同濃度處理之間及其與CK 之間差異均不顯著。射干種皮浸提液處理會明顯推遲小麥種子萌發(fā),且推遲作用隨著種皮浸提液濃度的增大而增強,0.03、0.04、0.06 g/mL 種皮浸提液處理的小麥種子發(fā)芽勢分別為57.33%、53.33%和39.00%,指標值與0.06 g/mL 胚乳浸提液處理(86.00%)和CK(90.00%)相比明顯降低。表明射干種皮浸取液可顯著抑制和延緩小麥種子萌發(fā),且這種抑制作用隨著浸提液濃度的增大而增強。
2.4.2 對小麥種子幼苗生長的影響 射干種子不同部位浸提液處理的小麥根長和苗高均<CK,其中種皮浸提液處理的指標值與CK 差異均達到了顯著水平,而胚乳浸提液處理與CK 差異均不顯著;不同部位浸提液處理的小麥根長和苗高均差異較大,其中種皮浸提液對幼苗根長和苗高的抑制作用明顯高于胚乳浸提液(表2)。種皮浸提液處理下,其抑制作用隨著浸提液濃度的降低而降低,其中0.06 與0.04 g/mL 濃度處理的小麥根長和苗高無顯著差異,但二者均顯著<0.03 g/mL 濃度處理。表明射干種子不同部位浸提液均對小麥種子幼苗生長具有一定的抑制作用,其中射干種皮浸提液抑制作用明顯,且抑制效果也明顯高于胚乳浸提液。由此推斷,射干種子的內(nèi)源抑制物主要存在于種皮。

表2 射干種子不同部位浸提液對小麥幼苗生長的抑制效果Table 2 Inhibition effects of different extracts from B. chinensis on the growth of wheat seedlings
射干種子不同部位浸提液處理對小麥根長與苗高的影響效果不同,其中種皮浸提液對小麥株高生長的抑制作用更強。
3 結論與討論
自然界中多數(shù)植物存在種子休眠現(xiàn)象,即具有生活力的種子即使在適宜的環(huán)境條件下仍不能萌發(fā)的現(xiàn)象[7~10]。研究表明,部分植物種子的休眠主要受種皮透氣性、透水性等結構因素的影響,種皮致密使胚與外界水、氣交換受到嚴重影響,從而導致種子萌發(fā)受到抑制[11];還有部分種子的休眠現(xiàn)象是由于種子內(nèi)部存在內(nèi)源抑制物質(zhì)而影響儲存有機物質(zhì)的生理代謝活動,導致種子無法正常萌發(fā)[12]。賈和田[13]研究發(fā)現(xiàn),用機械手段去掉射干種子的種皮后可以提高種子萌發(fā)率,說明種皮對射干種子萌發(fā)具有一定的抑制作用。本研究觀察發(fā)現(xiàn),射干種子浸泡36 h 內(nèi)吸水較快;浸泡36~72 h,種子吸水量明顯減少;浸泡72 h 后,吸水量幾乎不再增加,種子吸水基本達到飽和。射干種子的吸水過程基本符合一般種子的吸水規(guī)律,種皮產(chǎn)生的機械阻礙對水分流通影響不大,由此推測,射干種子的休眠現(xiàn)象不是由于種皮機械阻礙造成的。
前人研究證明,植物種子中存在內(nèi)源抑制物質(zhì)是導致種子休眠的主要原因之一[14],且自然界大多數(shù)植物種子中含有萌發(fā)抑制物[15]。趙燕[5]研究發(fā)現(xiàn),滇重樓種子的胚乳內(nèi)存在大量易溶于甲醇的萌發(fā)抑制物;陸秀君等[16]研究發(fā)現(xiàn),天女木蘭種子的抑制物質(zhì)主要存在于假種皮和胚乳中;賈彩霞[17]研究發(fā)現(xiàn),核桃種子各部分均存在內(nèi)源萌發(fā)抑制物。可見,種子萌發(fā)抑制物質(zhì)分布較為廣泛,存在于種子的各個部位,但不同部位中的抑制物含量與種類也有所差別。本研究中,在花盆中播種去皮和帶皮的射干種子,觀察其萌發(fā)情況,發(fā)現(xiàn)射干去皮種子的發(fā)芽率和發(fā)芽勢均顯著好于帶皮種子,且較帶皮種子萌發(fā)的幼苗更加健壯、長勢更好,由此可基本斷定射干種皮內(nèi)存在內(nèi)源萌發(fā)抑制物。以蒸餾水處理為CK 進一步比較了射干種皮浸提液與胚乳浸提液對小麥種子萌發(fā)和幼苗生長的抑制效果,發(fā)現(xiàn)射干胚乳浸提液對小麥種子萌發(fā)和幼苗生長影響不大;射干種皮浸提液對小麥種子萌發(fā)和幼苗生長均具有顯著的抑制作用,且這種抑制作用也明顯高于胚乳浸提液。射干種子休眠主要與其內(nèi)源種子萌發(fā)抑制物有關,且該抑制物質(zhì)集中存在于種皮。
自然界中,種子萌發(fā)抑制物的種類有很多[18],其種類不同,作用機理和對幼苗的影響方式也有所差別[19]。如,多花黃精種子內(nèi)的萌發(fā)抑制物主要影響幼苗根部生長和葉綠素合成[4];黃連種子內(nèi)存在脫落酸、香豆素等物質(zhì),主要影響幼苗伸長[20]。本研究結果表明,射干種皮浸提液對小麥生長具有顯著的抑制作用,其中對苗高的抑制作用強于對根長的抑制作用。
綜上所述,射干種子休眠現(xiàn)象是由種皮中的內(nèi)源萌發(fā)抑制物所致,而非致密種皮不透水導致的機械阻礙,種子萌發(fā)抑制物對小麥幼苗的影響主要體現(xiàn)在抑制苗高和根長2 個方面。射干種皮內(nèi)源抑制物的成分及其抑制機理有待進一步研究。

