SO2、NO2 與針鐵礦、赤鐵礦、磁鐵礦的非均相反應
賈小紅, 王 甫, 任 燕, 李 銳, 顧文君, 張歡歡, 唐鈺婧, 彭 超*, 唐明金
(1. 中國科學院 廣州地球化學研究所 有機地球化學國家重點實驗室/廣東省環境資源利用與保護重點實驗室/粵港澳環境污染過程與控制聯合實驗室, 廣東 廣州 510640; 2. 深圳市龍華疾病預防控制中心, 廣東 深圳 518109; 3. 中國科學院大學, 北京 100049)
0 引 言
礦質顆粒物主要來源于干旱和半干旱地區, 據估計全球每年約有1000~3000 Tg 礦質顆粒物排放至大氣中[1-2], 對對流層化學過程[3-4]、氣候變化[5-8]和人類健康[9-10]等產生非常重要的影響。礦質顆粒物的沉降是開放海域地區關鍵微量營養元素(如Fe 和P 等)的主要來源[11-13], 在很大程度上決定了海洋的初級生產力[14], 最終影響生物地球化學循環。Fe 是礦質顆粒物的重要組分, 絕大多數以難溶態鐵的形式存在[15-16]。研究表明, 遠海洋上空氣溶膠中的水溶性鐵含量遠遠高于近沙塵源區[17-18], 而大氣化學過程(如成云過程)能夠顯著提高礦質顆粒物中的水溶性鐵含量[14,19,20]。但目前關于非均相反應對礦質顆粒物中Fe 元素水溶性影響的研究十分有限[17,21]。
硫酸鹽是我國大氣顆粒物的重要組分[22-24], 可吸收和散射太陽輻射直接影響全球氣候變化[25-26], 也可作為云凝結核間接改變大氣輻射平衡[25,27,28]。SO2的氧化是對流層中硫酸鹽的主要來源, 有3個主要途徑, 即SO2與OH 自由基的氣相氧化[27]; O3、H2O2、OH 自由基氧化和過渡金屬(Fe 和Mn 等)催化作用下的O2氧化等液相氧化[27]; 非均相反應氧化[29-32]。與外場觀測比, 數值模擬一般高估SO2濃度而低估硫酸鹽濃度[30,33,34], 僅用氣相反應和液相反應已不足以解釋這一現象。外場觀測表明, 礦質顆粒物表面常常覆蓋有硫酸鹽[35-36], 而模式研究中[37]加入礦質顆粒物的非均相反應, 可以更好地模擬硫酸鹽濃度。因此SO2與礦質顆粒物非均相反應可能是硫酸鹽形成的重要途徑[37-38]。
近年來, 許多學者相繼開展了SO2與Fe2O3、FeOOH、MgO、Al2O3、撒哈拉沙塵和中國黃土等非均相反應研究[32,39-45]。例如, Adamset al.[39]和Usheret al.[44]使用內壁涂層流動管和努森池等研究了SO2與撒哈拉沙塵、中國黃土的非均相反應, 測得初始反應攝取系數為(6.6±0.8)×10?5和(4±2)×10?5; 使用漫反射傅里葉變換紅外光譜儀研究得到SO2與撒哈拉沙塵、CaCO3非均相反應的初始攝取系數低兩個數量級[31,43]。此外, 低相對濕度條件下, SO2與Fe2O3、FeOOH 非均相反應極其微弱[46-47]; 當相對濕度由0%增加至82%, SO2與Fe2O3非均相反應的攝取系數先增大后減小[46]。相對濕度的增加顯著提高了SO2與CaSO4、CaCO3和美國亞利桑那沙塵等反應攝取系數[48-50]。共存氣體可能會促進SO2與礦質顆粒物非均相反應硫酸鹽的形成。目前, 許多學者已開展了SO2、NO2與撒哈拉沙塵、Fe2O3、MgO、CaO 和Al2O3等礦質顆粒物非均相反應的復合效應研究[30,32,42], 與SO2的非均相反應相比, NO2的共存顯著促進了硫酸鹽的形成。此外, O3、H2O2和HCOOH等共存也能顯著影響SO2在礦質顆粒物表面硫酸鹽的生成[31,44,51-53]。
本研究擬開展SO2、NO2與針鐵礦、磁鐵礦、赤鐵礦在不同相對濕度(0%、30%、60%和90%)條件下的非均相反應, 定量分析反應后顆粒物表面生成的硫酸鹽、硝酸鹽以及水溶性鐵的含量隨反應時間的變化。進一步闡明SO2和礦質顆粒物的非均相反應對硫酸鹽和水溶性鐵的貢獻, 有助于更好地評估礦質顆粒物的非均相反應對硫酸鹽和Fe 元素水溶性的影響。
1 實驗方法
1.1 樣品制備
本研究選取了3 種含鐵礦物, 即針鐵礦(>98%, santa cruz)、磁鐵礦(>95%, strem chemicals)和赤鐵礦(>99.8%, strem chemicals) 。 采 用 比 表 面 積(Brunauer-Emmett-Teller, BET)和孔徑分布測定儀(ASAP 2640, micromeritics)測定了3 種樣品的比表面積, 分別為(11.30±0.08) m2/g、(6.34±0.04) m2/g 和(9.23±0.17) m2/g[21]。
為了使反應氣體與顆粒物充分接觸, 將顆粒物均勻附著在聚四氟乙烯(PTFE, 47 mm, Whatman)濾膜上。制備方法如下: 稱取0.25 g 顆粒物于500 mL塑料廣口瓶中, 加入500 mL 乙醇溶液(高效液相色譜純, 天津市科密歐化學試劑有限公司)。使用磁力攪拌器不斷攪拌使顆粒物在酒精中均勻分散, 得到0.5 g/L 顆粒物和乙醇混合物。吸取10 mL 混合物滴于空白PTFE 濾膜上, 待酒精完全揮發后, 取出制備好的樣品膜并置于干凈的膜盒中, 將膜盒置于托盤中。在托盤上方鋪放干凈的保鮮膜, 使用該方法能夠避免樣品膜與實驗室空氣的接觸。反復稱重, 最終顆粒物的質量為(5±1) mg。
1.2 非均相反應
圖1 為SO2和NO2與礦質顆粒物非均相反應的裝置示意圖, 左上部分為氣路系統, 右上部分為反應系統。氣路系統由4 路氣體組成, 即(1) NO2標準氣體; (2) SO2標準氣體; (3) 干合成空氣; (4) 濕合成空氣。MFC1、MFC2、MFC3 和MFC4 均為質量流量控制器(D07-7K, 北京七星華創電子股份有限公司), 分別控制上述4 路氣體的流速。NO2標準氣體(2.05×103μg/L, 中國計量科學研究院國家標準物質研究中心)和SO2標準氣體(2.86×103μg/L, 佛山得力梅塞爾氣體有限公司)的流速均為 0~10 mL/min, 干、濕合成空氣(>99.999%, 佛山華特氣體有限公司)的總流速為350 mL/min。濕合成空氣通過兩個串聯的鼓泡裝置(125 mL, 品牌SYNTHWARE)產生, 通過調節干濕兩路合成空氣的流速比以控制混合氣的相對濕度, 相對濕度范圍為0%~90%, 精度為1%。4路氣體在通入反應器之前相互混合, 最終得到總流速約為350 mL/min 的模擬空氣, 混合氣中SO2和NO2的濃度分別為(7.14±0.29) μg/L 和(5.13±0.21) μg/L。
反應系統主要由空白反應器(blank)和樣品反應器(sample)組成, 空白反應器放置一張空白PTFE 濾膜, 在反應開始之前, 混合氣通入空白反應器中平衡。待SO2和NO2氣體濃度穩定后, 將混合氣切換至樣品反應器中, 開始反應。反應過程中, 混合氣自上而下穿過樣品膜。反應結束后, 將混合氣切換至空白反應器, 取出反應后的樣品膜并存放于塑料膜盒中, 密封保存, 在30 min 內盡快分析。為了減小混合氣在反應器中的壁損失, 選取兩個完全相同且為特氟龍(PFA)材質的膜托(47 mm, Savillex)作為空白反應器和樣品反應器, 內徑為42 mm, 內壁長度為48 mm, 反應器內部體積為66 mL, 流速為350 mL/min, 混合氣在反應器中的停留時間大約為11 s。
如圖1 右下部分所示, 反應后的混合氣經實驗室空氣混合稀釋, 最終進入SO2分析儀(T100, API)和氮氧化物分析儀(T200, Teledyne API)進行在線檢測。混合氣被實驗室空氣(經濾膜過濾)稀釋后總流速約為1100 mL/min, 參與反應的混合氣(350 mL/min)最終被稀釋了3.14 倍。整個實驗過程中, 過濾后實驗室空氣中SO2濃度小于0.06 μg/L, NO2濃度小于0.10 μg/L, 對混合氣中SO2和NO2濃度的檢測影響可忽略不計(<1%)。
1.3 樣品分析
反應結束后, 使用陶瓷剪刀將樣品膜一分為二, 取半張膜剪碎并用10 mL 去離子水浸沒, 軌道搖床震蕩提取2 h (轉速300 r/min)。提取后, 使用0.22 μm過濾頭(聚醚砜, 上海安譜實驗科技有限公司)過濾。使用Metrohm公司ECO 型離子色譜儀分析反應前后硫酸鹽和硝酸鹽等, 該儀器配備有萬通品牌且型號為Metrohm suppressor Module 抑制器, 采用型號為Metrohm Metrosep A Supp 4-250/4.0 型分離柱實現不同離子的分離。淋洗液為 1.8 mmol/L Na2CO3和1.7 mmol/L NaHCO3混合緩沖溶液, 流速為1.0 mL/min, 抑制液為92 mmol/L的H2SO4溶液, 單次進樣量為10 μL。
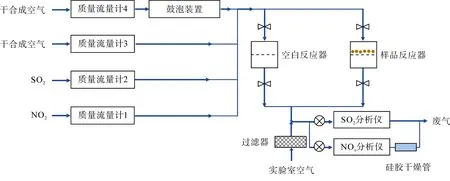
圖1 SO2 和NO2 與礦質顆粒物非均相反應裝置示意圖 Fig.1 Schematic of the apparatus used to investigate heterogeneous reaction of SO2 and NO2 with mineral dust particles
為了更好地模擬大氣顆粒物在海洋中的沉降, 許多研究學者使用低pH 緩沖溶液提取實際大氣樣品中水溶性鐵含量[17,54-57]。本研究也使用類似方法提取和分析樣品中水溶性鐵, 即將另一半樣品膜剪碎并用10 mL 5 mmol/L pH=4.18 的醋酸和醋酸鈉緩沖溶液浸沒, 軌道搖床震蕩提取2 h。使用0.22 μm過濾頭過濾, 加入59 μL 69% HNO3溶液(OPTIMA, fisher)酸化至提取液中HNO3體積分數為0.4%。使用電感耦合等離子體質譜(iCAP-Q, Thermo Fisher Scientific)分析總水溶性鐵含量[21]。
2 結果與討論
2.1 針鐵礦的非均相反應
2.1.1 SO2與針鐵礦的非均相反應
4 個不同相對濕度條件下, SO2與針鐵礦反應24 h硫酸鹽的生成量(硫酸鹽質量與針鐵礦質量比即(m(SO42?)/m(針鐵礦))隨相對濕度變化如圖2 所示。隨著相對濕度的增加, 硫酸鹽生成量呈顯著遞增趨勢。在干態下(相對濕度為0%), SO2與針鐵礦反應幾乎無硫酸鹽生成; 當相對濕度為30%和60%時, 硫酸鹽生成量分別約為(0.45±0.17)%和(0.62±0.04)%; 在相對濕度為90%的高濕度條件下, 硫酸鹽生成量最大可達(0.79±0.04)%。已有研究表明[41,46,47,58], 干態下SO2與大多數礦質顆粒物非均相反應幾乎無硫酸鹽生成, 而高相對濕度更有助于非均相反應的發生, 進而促進更多的硫酸鹽生成, 與本研究的結果較為吻合。
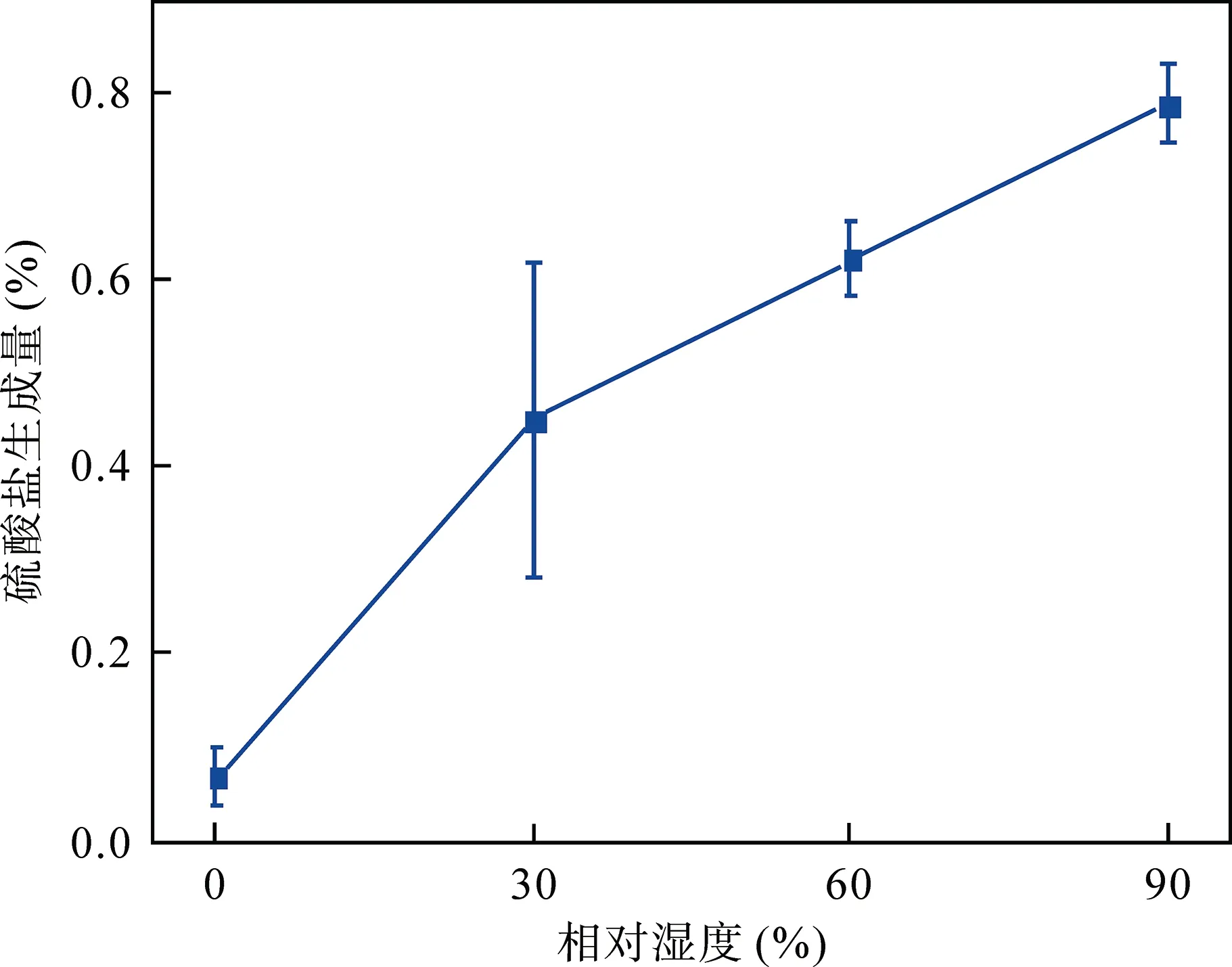
圖2 不同相對濕度(0%、30%、60%和90%)條件下, SO2與針鐵礦非均相反應24 h 硫酸鹽的生成量 Fig.2 Sulfate formation in heterogeneous reaction of goethite with SO2 at 0%, 30%, 60% and 90% relative humidity for 24 h
2.1.2 SO2和NO2與針鐵礦的非均相反應
不同反應時長和不同相對濕度條件下, SO2和NO2共存時與針鐵礦反應硫酸鹽的生成量如圖3a 所示。在干態下(相對濕度為0%), SO2、NO2共存時與針鐵礦反應24 h 后幾乎無硫酸鹽生成; 相對濕度為30%、60%、90%時, 反應24 h 仍未達到飽和; 相對濕度為30%和60%時, 反應有明顯的硫酸鹽生成, 硫酸鹽的生成量最大為(0.55±0.16)%; 相對濕度增加至90%時, 硫酸鹽生成量最高達(0.66±0.17)%。這表明相對濕度的增加有助于非均相反應的發生, 進而促進硫酸鹽的生成。從整體來看, SO2和NO2共存時與針鐵礦反應生成硫酸鹽的量不足1%, 該反應對硫酸鹽貢獻有限。此外, 從SO2單獨與針鐵礦的反應結果相比, SO2、NO2共存時與針鐵礦反應對硫酸鹽的生成幾乎無影響, 而已有研究表明, NO2和O3等氣體的共存能夠促進SO2和礦質顆粒物非均相氧化硫酸鹽的形成[30-32]。例如, Liuet al.[32]使用漫反射傅里葉變換紅外光譜技術(DRIFTS)開展了SO2、NO2分別與α-Fe2O3、CaO 和α-Al2O3等顆粒物的非均相反應研究, 發現NO2共存時能夠顯著促進SO2非均相反應硫酸鹽的生成, 可能的原因是NO2共存時能夠將顆粒物表面的亞硫酸鹽氧化為硫酸鹽, 最終生成更多的硫酸鹽。在本研究中, NO2共存時對SO2非均相反應硫酸鹽的生成幾乎無影響, 推測是已有文獻中使用的氣體濃度(SO2濃度為5.71×102μg/L, NO2濃度為4.11×102μg/L)遠遠高于本研究, 低濃度NO2可能不足以將亞硫酸鹽氧化成硫酸鹽, 最終未能生成更多的硫酸鹽。
圖3b 為SO2和NO2共存時與針鐵礦非均相反應的硝酸鹽生成量。4 個不同相對濕度下, SO2、NO2共存時與針鐵礦反應24 h 后仍未達到飽和。干態下(相對濕度為0%), SO2、NO2共存時與針鐵礦反應24 h 后硝酸鹽的生成量為(0.27±0.01)%; 相對濕度為30%和60%時, 有明顯硝酸鹽生成且最大生成量為(0.65±0.04)%; 當相對濕度增加至90%時, 硝酸鹽生成量最高達(1.18±0.16)%。該結果表明, 隨著相對濕度的增加, 硝酸鹽的生成量呈顯著增加趨勢。這表明相對濕度的增加有助于NO2的非均相氧化過程, 進而促進硝酸鹽的生成。此外, 同NO2與針鐵礦的非均相反應相比[21], SO2和NO2共存時硝酸鹽的生成量明顯減少, 這表明SO2的共存抑制了硝酸鹽的生成。這一研究結果與文獻報道中的結果一致[32,42]。Liuet al.[32]研究表明, SO2的共存均能夠抑制NO2與 α-Fe2O3非均相反應硝酸鹽的生成。已有研究表明, 硫酸鹽的吸濕性弱于硝酸鹽[59]。當NO2與顆粒物發生非均相反應, 生成了硝酸鹽; 而SO2和NO2共存時反應生成了硫酸鹽和硝酸鹽, 二者產物的存在使得顆粒物的吸濕性相對于NO2反應時減弱, 最終使顆粒物表面的吸附水減少, 進而抑制了硝酸鹽的生成。在本研究中, 也可能是上述原因導致SO2和NO2共存時硝酸鹽生成被抑制。
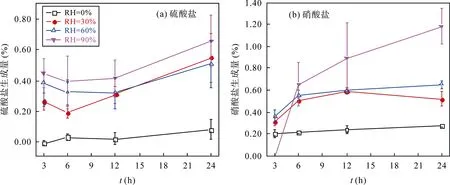
圖3 不同相對濕度條件下, SO2、NO2 與針鐵礦非均相反應硫酸鹽和硝酸鹽的生成量(RH 為相對濕度) Fig.3 Sulfate and nitrate formation in heterogeneous reaction of goethite with SO2 and NO2 at different relative humidity levels
2.1.3 反應攝取系數
攝取系數是定量大氣非均相反應的重要參數, 是大氣顆粒物攝取或反應能力的量化指標[60]。本研究計算了SO2非均相氧化反應的攝取系數γ(SO2), 其定義為礦質顆粒物表面硫酸鹽的生成速率(r=d[SO42?]/dt)與SO2在顆粒物表面碰撞總頻率(f)之比[31,46], 即:

對于SO2與針鐵礦, SO2和NO2共存時與針鐵礦反應24 h, SO2的平均反應攝取系數如表1 所示。SO2與針鐵礦非均相反應24 h, SO2的平均反應攝取系數小于1×10?8, 且SO2反應攝取系數隨相對濕度增加而增大。這可能由于一方面隨著相對濕度的增加, 礦質顆粒物表面形成了水膜, 有助于SO2的吸收進而促進非均相反應進行[43]; 另一方面生成的硫酸鹽具有一定吸濕性, 吸收更多水分子進而促進硫酸鹽的形成[61]。SO2和NO2共存時與針鐵礦反應前24 h, SO2平均反應攝取系數小于1×10?8, 相對濕度的變化對SO2反應攝取系數無顯著影響。此外, NO2的存在對SO2反應攝取系數幾乎無影響。

表1 SO2 與針鐵礦非均相反應平均反應攝取系數 Table 1 Average reactive uptake coefficients of SO2 for goethite
本研究將反應生成的硫酸鹽歸一化為生成的硫酸鹽在礦質顆粒物表面的覆蓋層數, 計算公式[2]如下。
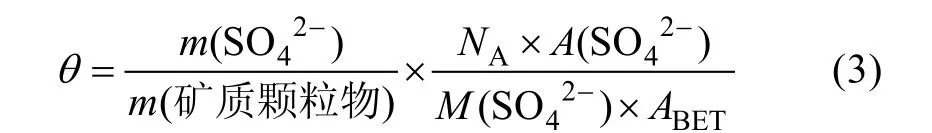
式中,θ表示硫酸鹽在礦質顆粒物表面的覆蓋層數,m(SO42?)和m(礦質顆粒物)分別為硫酸鹽和礦質顆粒物的質量(單位, g),NA為阿伏伽德羅常數(6.02×1023mol?1),M(SO42?)為硫酸根離子的摩爾質量(96 g/mol),ABET為礦質顆粒物的BET 比表面積,A(SO42?)表示1 個硫酸根離子的截面積(假設其近似等同于1 個吸附水的截面積1×10?15cm2)[2]。SO2或SO2和NO2共存時與針鐵礦非均相反應m(SO42?)/m(針鐵礦)最大值分別為(7.88±0.41)×10?3和(6.59±1.71)×10?3, 由計算可知, 反應生成的硫酸鹽在針鐵礦表面的最大覆蓋密度分別為(4.42±0.23)×1014cm?2和(4.81±1.90)× 1014cm?2, 覆蓋層數分別為(0.44±0.02)和(0.48±0.09), 均不足1 個分子單層, 這表明SO2以及SO2和NO2共存時與針鐵礦非均相反應對硫酸鹽的貢獻比較有限。
2.2 磁鐵礦和赤鐵礦的非均相反應
不同濕度條件下, SO2與磁鐵礦或赤鐵礦非均相反應24 h 后均無硫酸鹽生成; SO2和NO2共存時反應24 h 也幾乎無硫酸鹽生成, 只有少量硝酸鹽生成。圖4a 為SO2、NO2共存時與磁鐵礦反應后硝酸鹽生成量, 隨著相對濕度的增加, 硝酸鹽生成量呈顯著增加趨勢; 當相對濕度增加至90%時, 硝酸鹽生成量達到最大(0.16±0.01)%, 這表明高相對濕度更有助于NO2的非均相氧化過程。與NO2和磁鐵礦反應相比[21], SO2和NO2共存時硝酸鹽的生成量明顯減少, 這表明SO2的共存抑制了硝酸鹽的生成, 這一結果與文獻報道中的結果具有良好的一致性[32,42]。SO2和NO2共存時與赤鐵礦非均相反應后硝酸鹽的生成量如圖4b 所示, 相對濕度的變化對硝酸鹽生成量幾乎無影響, 反應24 h 后硝酸鹽生成量平均為(0.12±0.03)%。與NO2和赤鐵礦反應結果相比, SO2共存對硝酸鹽生成無顯著影響。
2.3 非均相反應對水溶性鐵的影響
本研究中, Fe 元素的水溶性(iron solubility)定義為水溶性鐵的質量在總鐵質量中的占比。在定量反應所生成的水溶性鐵之前, 首先定量了未反應3 種樣品膜中水溶性鐵含量。分析結果表明, 未反應針鐵礦、磁鐵礦和赤鐵礦中水溶性鐵的濃度依次為(17.18±1.55) μg/L、(3.05±1.61) μg/L 和(0.02±0.41) μg/L, 其中未反應赤鐵礦中的水溶性鐵濃度遠遠低于檢測限1 μg/L。計算得到未反應針鐵礦、磁鐵礦和赤鐵礦樣品中Fe 元素水溶性分別為(9.16±0.47)×10?5、(1.80±1.06)×10?5和(0.01±0.23)×10?5。
圖5a 為SO2與針鐵礦非均相反應24 h 對Fe 元素水溶性的影響, 反應只有少量水溶性鐵生成, Fe元素水溶性的增加值小于1×10?4; 相對濕度的變化對水溶性鐵生成幾乎無影響。Cartledgeet al.[17]開展了14.29 μg/L SO2與針鐵礦在相對濕度為23%和98%下的非均相反應研究, 結果表明, SO2與針鐵礦非均相反應24 h 對水溶性鐵生成非常有限, 相對濕度的變化對Fe 元素水溶性幾乎無影響, 相關結果與本研究較為吻合。本工作進一步探究了不同相對濕度以及不同反應時間條件下SO2、NO2共存與針鐵礦非均相反應對Fe 元素水溶性的影響, 結果如圖5b所示。SO2、NO2與針鐵礦非均相反應只有少量水溶性鐵生成, 但Fe 元素水溶性的增加值小于5×10?4; 相對濕度和反應時間的變化對水溶性鐵的含量幾乎無影響。
SO2和磁鐵礦非均相反應24 h 無水溶性鐵生成, 而SO2、NO2共存時與磁鐵礦反應24 h, 僅在相對濕度為90%條件下生成了少量水溶性鐵, 且Fe 元素水溶性增加值僅為(9.16±0.47)×10?5。赤鐵礦非均相反應對Fe 元素水溶性的影響如圖5c 和圖5d。Fe 元素水溶性的增加值均小于1×10?5, 比針鐵礦反應低1個數量級; 此外, 相對濕度的變化對Fe 元素水溶性無影響。這表明SO2或SO2、NO2共存時與赤鐵礦的非均相反應對Fe 元素水溶性的影響極其微弱。該研究結果與Cartledgeet al.[17]結果具有良好的一致性。發生非均相反應后樣品中Fe 元素的水溶性均較低, 與未反應樣品中相比, 二者相差較小甚至在某些條件下接近, 故圖5 中的不確定度較大。
3 結 論
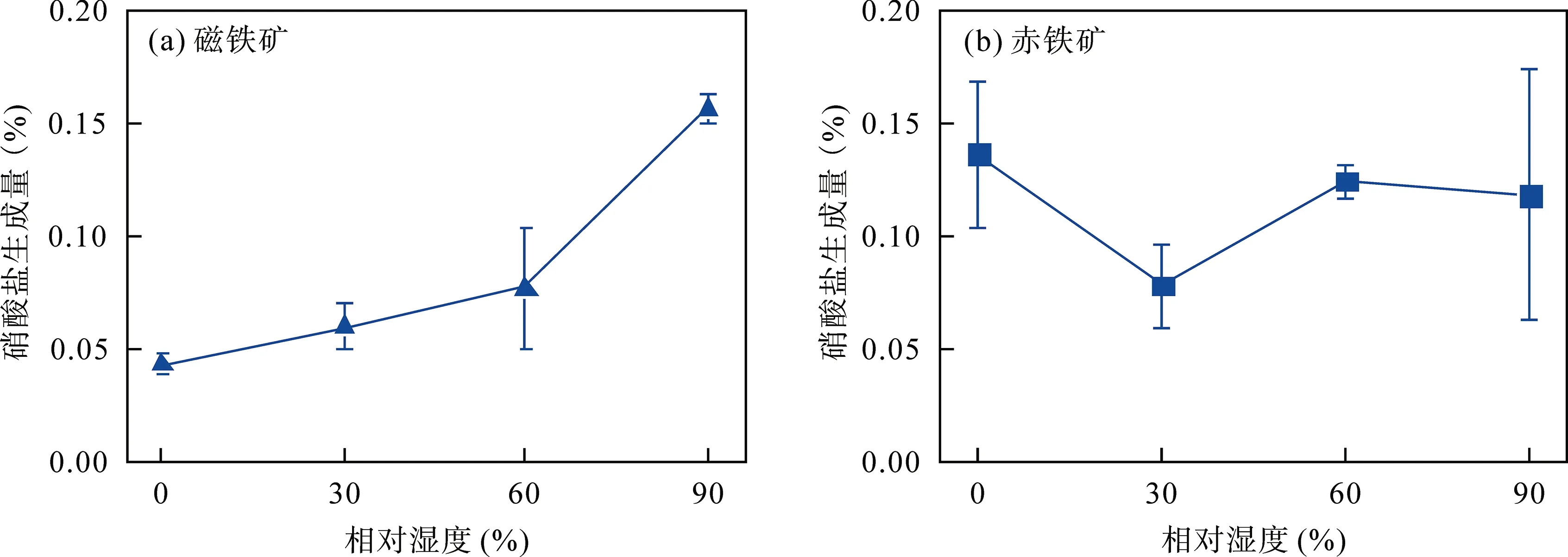
圖4 不同相對濕度(0%、30%、60%和90%)條件下, SO2、NO2 與磁鐵礦、赤鐵礦非均相反應24 h 硝酸鹽的生成量 Fig.4 Nitrate formation in heterogeneous reaction of magnetite and hematite with SO2 and NO2 at 0%, 30%, 60%, and 90% relative humidity for 24 h
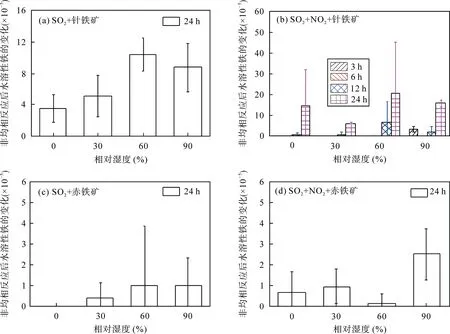
圖5 非均相反應后水溶性鐵的變化 Fig.5 Changes in iron fractional solubility due to heterogeneous reaction
(1) 對針鐵礦而言, SO2或SO2、NO2共存時與針 鐵礦反應24 h 均未達到飽和, 相對濕度的增加明顯促進硫酸鹽和硝酸鹽的生成。NO2的存在對SO2和針鐵礦非均相反應硫酸鹽生成無影響, 而SO2存在條件下對硝酸鹽的生成有明顯抑制作用。SO2或SO2和NO2共存時針鐵礦非均相反應SO2的平均反應攝取系數均小于1×10?8。
(2) 對于磁鐵礦和赤鐵礦而言, SO2或SO2和NO2共存時非均相反應幾乎無硫酸鹽生成, 僅在SO2和NO2共存時有極少量硝酸鹽生成。對于3 種含鐵礦物, 針鐵礦反應性最強, 但硫酸鹽的最大生成量不足0.80%。因此, SO2與含鐵礦物非均相反應對硫酸鹽貢獻比較有限。
(3) SO2與3 種含鐵礦物的非均相反應對Fe 元素水溶性的貢獻均小于1×10?4, 幾乎可忽略不計。目前關于非均相反應對Fe 元素水溶性影響的研究集中于簡單的含鐵礦物, 對于成分更為復雜的黏土礦物和實際沙塵的研究還處于空白階段。此外, 大氣中不同氧化劑(如O3、H2O2和HONO 等)、共存組分(如硝酸鹽)、光照以及溫度等可能會影響SO2的非均相反應氧化程度, 因此不同反應條件對非均相反應以及Fe 元素水溶性的貢獻還有待進一步詳細探究。
特別感謝兩位審稿專家對本文提出的建設性的修改意見及建議。

