乙酸異丁酯-異丁醇-1-己基-3-甲基咪唑醋酸鹽物系等壓氣液相平衡數據的測定及關聯
張親親,董冰冰,辛 華,張哲宇,陳 俊,張志剛
(沈陽化工大學 化學工程學院 遼寧省化工分離技術重點實驗室,遼寧 沈陽 110142)
乙酸異丁酯(IBAc)作為溶劑可單獨使用或與其他溶劑混合使用,目前廣泛應用于涂料、油墨、黏合劑、工業清潔劑和脫脂劑中。乙酸和異丁醇酯化是合成IBAc最常用的方法,在這一過程中會形成異丁醇和IBAc的混合物[1-3]。由于二者在101.3 kPa下會形成異丁醇摩爾分數為0.875的二元共沸物,常規的精餾方法無法實現二者的分離。萃取精餾兼具溶劑萃取和蒸餾的雙重優點[4-6],并且在經濟效益、操作和安全等方面都優于其他方法,因而成為目前分離共沸物最常用的方法。選擇適宜的萃取劑對于保證萃取精餾的高效和經濟運行是至關重要的。Liu等[7]利用Aspen Plus軟件,模擬了變壓精餾分離IBAc-異丁醇的效果。Bai等[8]以N,N-二甲基乙酰胺(DMAC)為萃取劑萃取精餾分離了IBAc-異丁醇。Liu等[9]以二甲基亞砜(DMSO)為萃取劑,利用萃取精餾的方法分離了IBAc和異丁醇。以上分離IBAc-異丁醇共沸物系所用的萃取劑均為有機溶劑,存在溶劑用量大、環境污染、回收困難等問題。因此,萃取精餾分離IBAc-異丁醇二元共沸物需要新型高效綠色萃取劑[10-11]。離子液體是由陽離子(有機或無機)和陰離子組成、熔點低于373 K的室溫熔鹽,具有蒸氣壓極低、溶解性良好、可設計性強、化學和熱穩定性良好等優異特性,因而在萃取精餾領域得到了廣泛應用,如腈-水體系(如乙腈-水)[12]、腈-醇體系(如乙腈-甲醇)[13]、酯-醇體系(如乙酸乙酯-乙醇)[14]等。
本工作選用1-己基-3-甲基咪唑醋酸鹽([HMIM][Ac])作為萃取劑分離IBAc-異丁醇二元體系。在101.3 kPa下,測定了IBAc-異丁醇二元體系以及[HMIM][Ac]-IBAc-異丁醇三元體系的等壓氣液相平衡數據,分析了[HMIM][Ac]對IBAc-異丁醇物系氣液相平衡行為的影響,利用Aspen Plus軟件NRTL模型對二元和三元氣液相平衡數據進行了關聯,最后對[HMIM][Ac]和文獻報道的有機溶劑萃取劑進行了性能對比。
1 實驗部分
1.1 試劑及儀器
IBAc、異丁醇:分析純,中國國藥集團有限公司;離子液體[HMIM][Ac]:純度大于98%(w),蘭州雨陸離子液體有限公司。IBAc與異丁醇用氣相色譜法進行檢測,未檢出雜質。[HMIM][Ac]使用之前先用真空干燥箱在353 K下干燥24 h,采用Karl Fischer滴定法測定離子液體的含水量小于500×10-6。
采用Agilent公司GC7890A型氣相色譜儀分析試樣組成,TCD檢測,溫度為473 K,載氣為氫氣,流量為45 mL/min,DB-WAXETR型毛細管柱(30 m×0.32 mm×1 μm)。柱溫、進樣口和檢測器的溫度分別為343,473,473 K。
1.2 測定方法
在101.3 kPa條件下應用改進的北洋化工實驗設備公司CE-2型氣液平衡釜測定等壓氣液相平衡數據[15-16]。試樣配制采用稱重法,天平精度0.0001 g。首先將配制好的異丁醇與離子液體的混合試樣約50 mL加入到平衡釜中加熱至沸騰。每一次沸騰后,體系溫度穩定不變且保持約30 min時,則可視為已達到氣液相平衡狀態,記錄平衡溫度,用微量進樣器分別從氣相和液相采樣口進行取樣分析,然后分次加入IBAc與等量離子液體的混合溶液。實驗中對氣液相平衡溫度的測量選用精確校準過的水銀溫度計,標準不確定度為0.006 K。
2 結果與討論
2.1 實驗裝置的檢驗
為了驗證實驗所用儀器的可靠性,測定了101.3 kPa下的IBAc-異丁醇二元體系的等壓氣液相平衡數據,結果如表1所示。
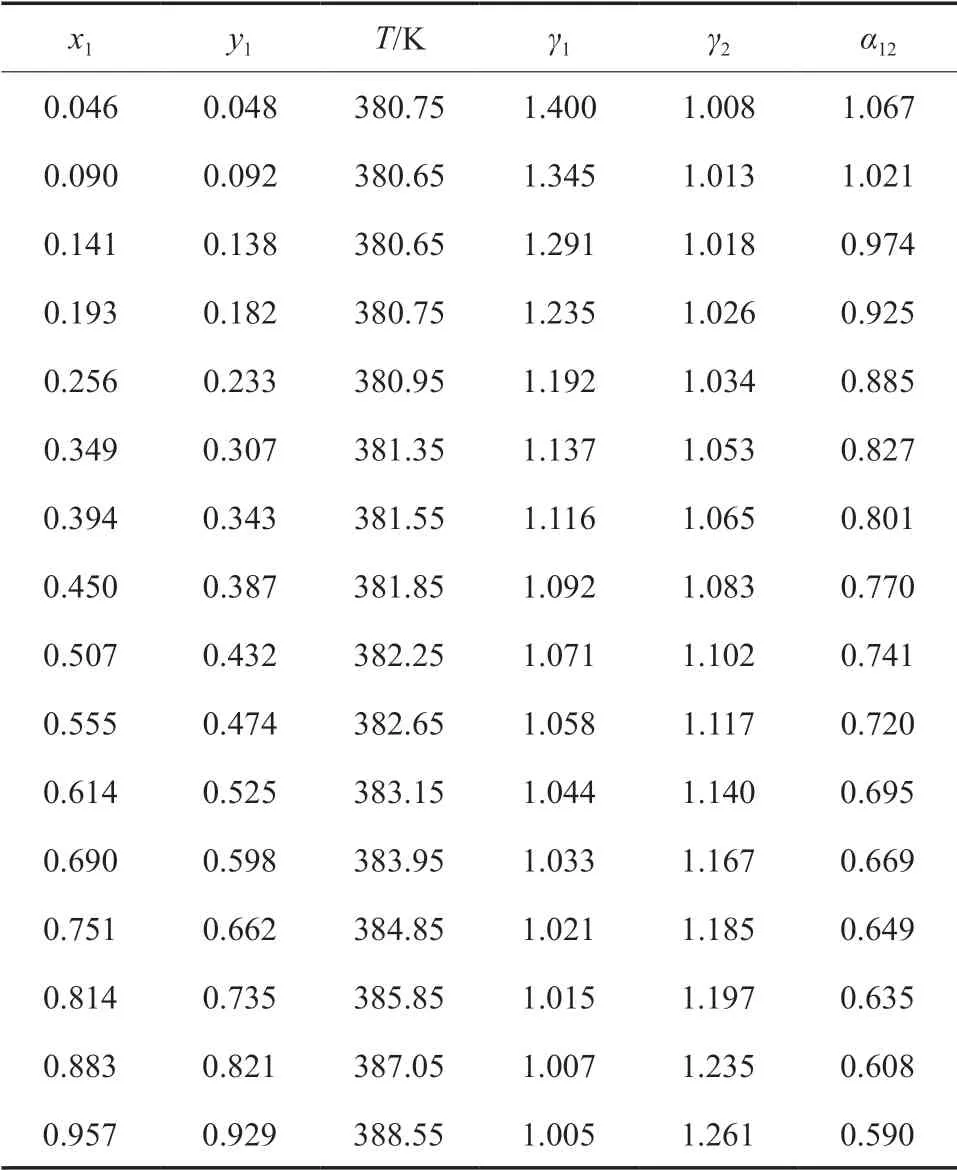
表1 在101.3 kPa下IBAc(1)-異丁醇(2)二元等壓氣液相平衡數據Table 1 Isobaric vapor-liquid equilibrium(VLE) data for the binary system of IBAc(1)-isobutanol(2) at 101.3 kPa
將測得的二元體系的實驗數據與文獻報道的數據[17]進行對比,結果如圖1所示。由圖1可知,實驗數據與文獻值基本一致,表明實驗所用儀器可靠。
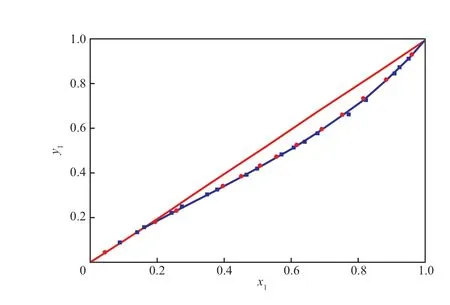
圖1 在101.3 kPa下IBAc(1)-異丁醇(2)二元物系的氣液平衡曲線Fig.1 The VLE curve for the binary system of IBAc(1)-isobutanol(2) at 101.3 kPa.
同時,采用Herington積分法[18]驗證所測二元實驗數據的熱力學一致性,結果如圖2所示。由圖2可知,│D-J│的計算值為1.475,說明等壓氣液相平衡數據滿足熱力學一致性的檢驗(標準│D-J│<10)。
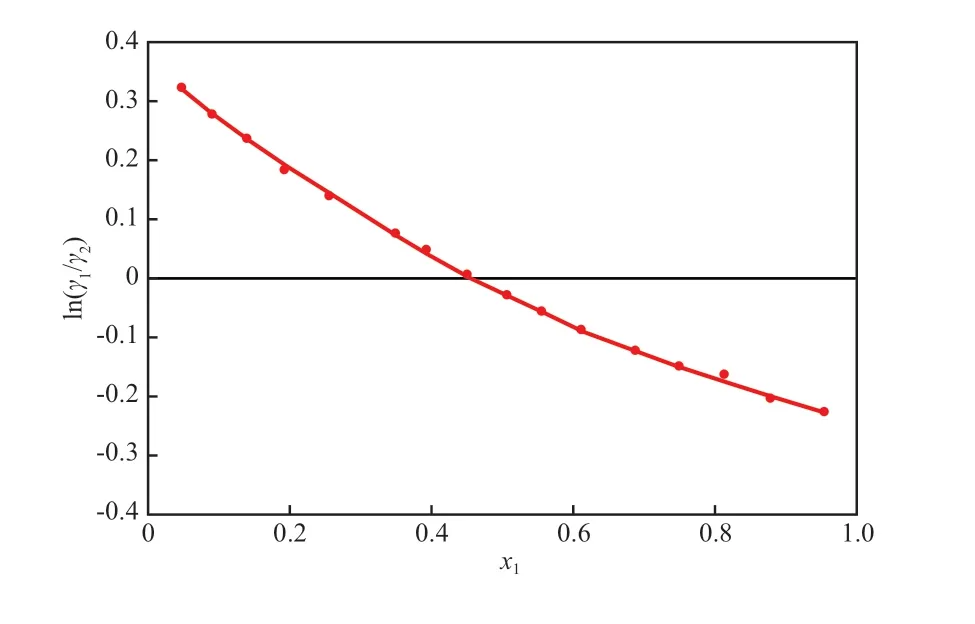
圖2 熱力學一致性檢驗Fig.2 Thermodynamic consistency test.
2.2 三元氣液相平衡數據
在101.3 kPa下,測定了IBAc(1)-異丁醇(2)-[HMIM][Ac](3)三元物系的等壓氣液相平衡數據,所用的離子液體摩爾分數分別為0.02,0.05,0.10,實驗測定數據見表2。
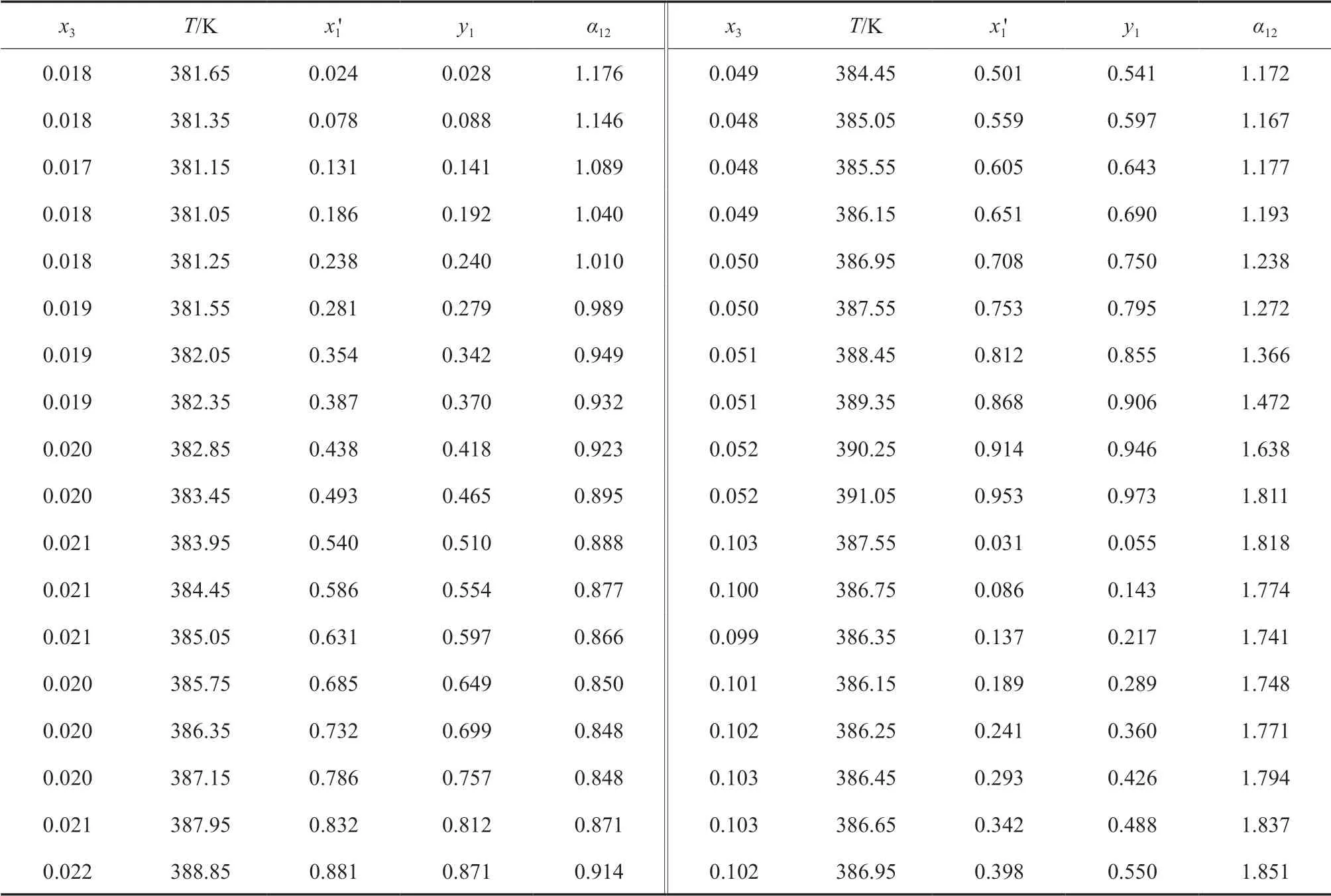
表2 101.3 kPa下IBAc(1)-異丁醇(2)-[HMIM][Ac](3)三元等壓氣液相平衡數據Table 2 Isobric VLE data for the ternary system of IBAc(1)-isobutanol(2)-[HMIM][Ac](3) at 101.3 kPa
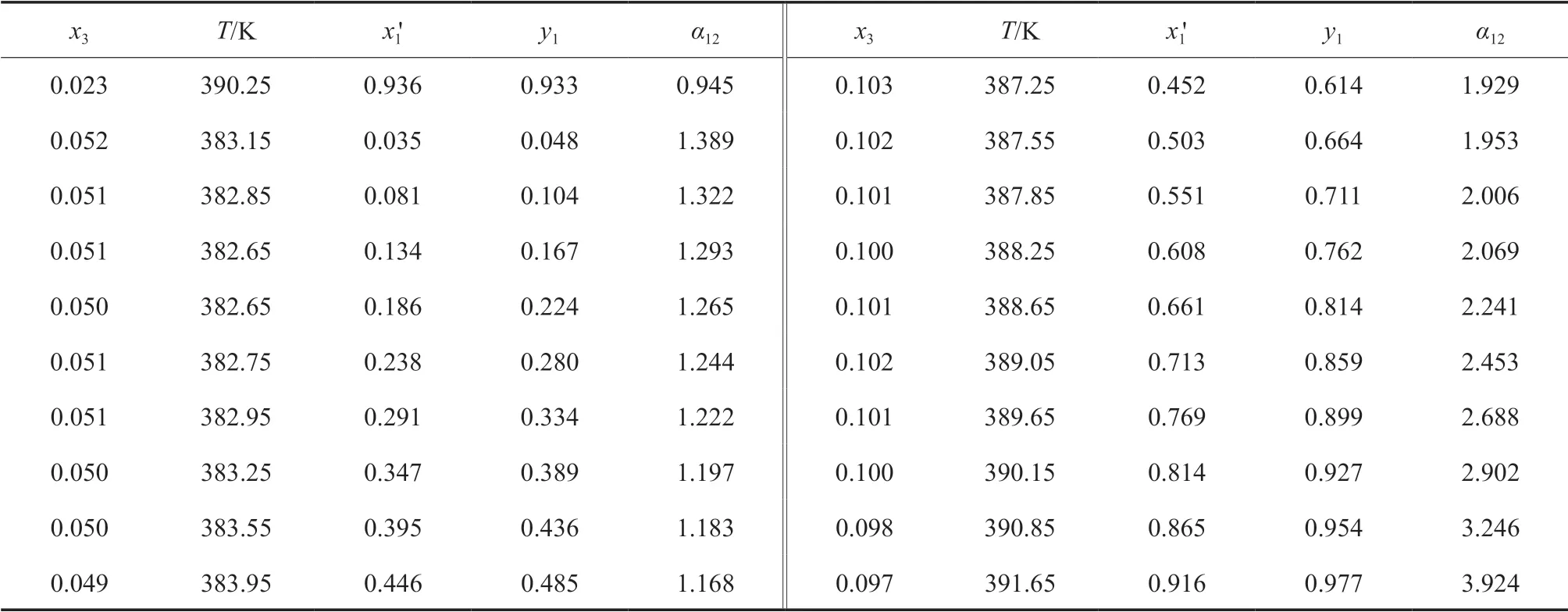
續表2
2.3 模型關聯
對氣液相平衡數據進行關聯擬合,能夠極大減少實驗研究的工作量,合理預測體系相平衡行為。目前,NRTL模型[19-20]對含離子液體系統的數據關聯有良好的適用性,且較為常用。因此,本工作選用NRTL模型對實驗數據進行關聯。在三元體系中,活度系數和相對揮發度用于描述不同離子液體對IBAc-異丁醇共沸體系的影響。由于實驗是在常壓下進行的,因此氣相可作為理想氣體來處理,且離子液體的蒸氣壓可忽略不計。由實驗數據回歸模型參數,采用Levenberg-Marquardt方法最小化目標函數,所得參數見表3。
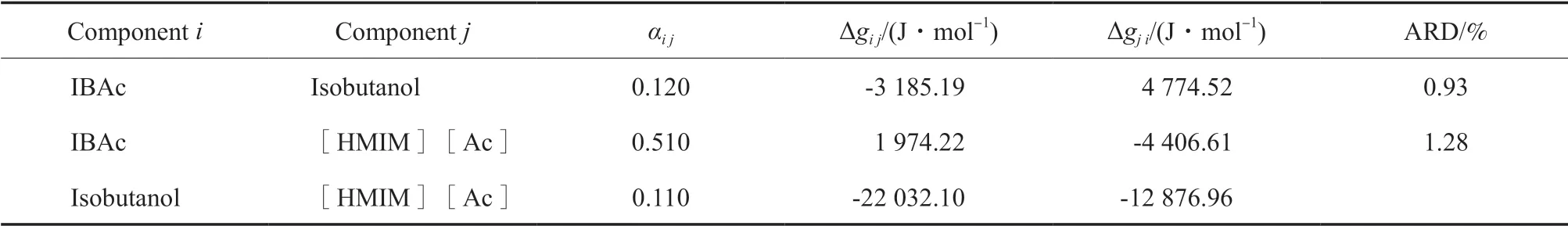
表3 NRTL模型的二組分相互作用參數Table 3 Estimated values of binary parameters in the NRTL model
2.4 討論
圖3為IBAc-異丁醇-[HMIM][Ac]三元物系的等壓氣液平衡曲線。由圖3可知,與未加[HMIM][Ac]相比,加入[HMIM][Ac]后IBAc-異丁醇二元物系的氣液平衡曲線發生偏離,且隨著[HMIM][Ac]含量的增加,氣液平衡曲線的偏離程度越來越大,這說明[HMIM][Ac]對IBAc具有明顯的鹽析作用,使IBAc在氣相中的含量增加。且當[HMIM][Ac]的摩爾分數為0.05時,即可完全消除IBAc-異丁醇物系的共沸點。
圖4為[HMIM][Ac]對IBAc-異丁醇相對揮發度的影響。由圖4可知,[HMIM][Ac]的加入可明顯提高IBAc對異丁醇的相對揮發度,且離子液體的含量越高效果越明顯。
2.5 不同萃取劑性能對比
將常用來分離IBAc-異丁醇共沸體系的萃取劑DMSO和DMAC與本工作所采用的離子液體[HMIM][Ac]的性能進行對比。以上3種萃取劑均能改變IBAc-異丁醇共沸物的相對揮發度,且都能完全打破共沸現象。但根據NRTL模型計算結果可知,[HMIM][Ac]的摩爾含量為0.023時即可使IBAc-異丁醇二元物系的共沸點完全消除,然而DMSO和DMAC兩種萃取劑,打破共沸所需的最小摩爾分數分別為0.360和0.361。可見,3種萃取劑分離效果由強到弱的順序為[HMIM][Ac]>DMSO>DMAC。另外從經濟和環保角度考慮,DMSO和DMAC是有機溶劑,存在用量大、能耗高及污染環境等問題。而離子液體與它們相比,因有蒸氣壓極低、溶解能力強等特性,具有顯著的優勢。綜上所述,離子液體[HMIM][Ac]更適合作為分離IBAc-異丁醇共沸體系的萃取劑。
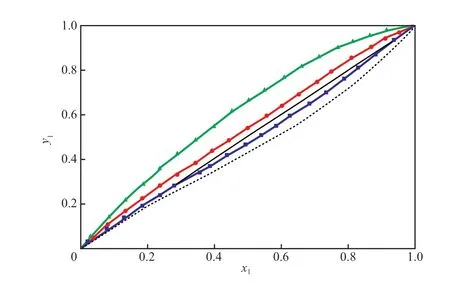
圖3 101.3 kPa下IBAc(1)-異丁醇(2)-[HMIM][Ac](3)三元等壓氣液平衡曲線Fig.3 Isobaric VLE curve for the ternary system of IBAc(1)-isobutanol(2)-[HMIM][Ac](3) at 101.3 kPa.
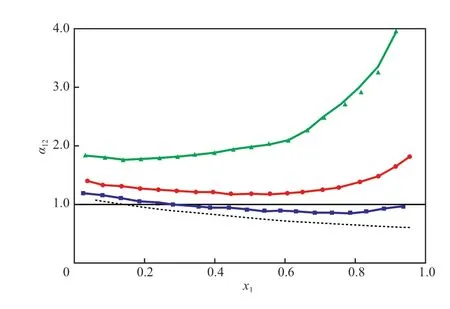
圖4 101.3 kPa下離子液體[HMIM][Ac]對IBAc(1)-異丁醇(2)相對揮發度的影響Fig.4 Effect of[HMIM][Ac]on the relative volatility of IBAc(1)to isobutanol(2) at 101.3 kPa.
3 結論
1)在101.3 kPa下,測定了IBAc-異丁醇二元氣液相平衡數據,以及[HMIM][Ac]摩爾分數分別為0.02,0.05,0.10時的IBAc-異丁醇-[HMIM][Ac]三元氣液相平衡數據。
2)在IBAc-異丁醇物系中加入[HMIM][Ac],可提高IBAc對異丁醇的相對揮發度,且隨著[HMIM][Ac]加入量的增加,對IBAc的鹽析效應越顯著。
3)利用NRTL模型關聯實驗數據,關聯結果與實驗結果達到了良好的一致性,NRTL模型適用于IBAc-異丁醇-[HMIM][Ac]三元氣液相平衡數據的關聯。
4)根據NRTL模型計算可知,離子液體[HMIM][Ac]的摩爾分數為0.023時,即可打破IBAc-異丁醇二元物系的共沸點,優于DMSO和DMAC的分離效果。

