2007—2019年國內中藥新藥注冊的審批情況分析
瞿禮萍,陳 楊,王筱竺,鄒文俊,劉 毅
成都中醫藥大學藥學院,四川 成都 610041
中藥產業是我國的特色和優勢領域,中藥的監管問題也一直備受關注。自1985年原衛生部頒布《新藥審批辦法》首次將中藥與化學藥和生物制品同列為3 大類新藥管理,歷經1999年《新藥審批辦法》和2002、2005、2007年3 版《藥品注冊管理辦法》(《辦法》),尤其《辦法》2007年版在規范中藥注冊行為,引導新藥研發和行業發展發揮了重要作用。但也因監管政策的頻繁變更,讓藥品注冊管理政策的合理性、連續性和可預見性屢受詬病[1-2]。2015年《國務院關于改革藥品醫療器械審評審批制度的意見》開啟新一輪藥品監管改革后,新版《辦法》于2020年7月1日正式施行,其突出框架性原則,不再具體規定新藥研發中涉及的技術要求,而是以便于適時調整的技術指導原則等配套文件的形式另行發布,如新的化學藥品和中藥注冊分類及申報資料要求,均以“通告”的形式予以發布[3-4];“中藥注冊管理專門規定”“已上市中藥變更事項及申報資料要求”等有關中藥注冊的更多配套文件亦正在制定當中[5]。這種方式既能兼顧法規制度的穩定性和技術體系的靈活性,又能更好地適應目前我國制藥工業和科學技術的發展水平。
目前《辦法》2007年版盡管已被廢止,但其實施了13年時間,相關配套文件“中藥注冊管理補充規定”[6]首次提出了中藥注冊應體現中醫藥特色,也是目前新版《辦法》第19 條提出“建立和完善符合中藥特點的注冊管理制度和技術評價體系”的最早雛形。因而,《辦法》2007年版不僅是我國藥品注冊管理發展完善的階段性標志[1],而且反映了我國中藥新藥研制技術領域發展的重要時期。本文旨在系統回顧其實施期間,我國中藥新藥的注冊審批情況,實證分析我國中藥新藥研發和注冊現狀以及可能存在的問題,以期為當前新版《辦法》后續有關中藥的配套文件制定提供一定參考。
1 數據來源與方法
本文的研究對象為《辦法》2007年版中規定的中藥新藥注冊申請。其中,中藥新藥包括第1~6 類中藥,第1 類中藥是指未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成份及其制劑;第2 類中藥是指新發現的藥材及其制劑;第3 類中藥是指新的中藥材代用品;第4 類中藥是指藥材新的藥用部位及其制劑;第5 類中藥是指未在國內上市銷售的從植物、動物、礦物等物質中提取的有效部位及其制劑;第6 類中藥是指未在國內上市銷售的中藥、天然藥物復方制劑。新藥注冊申請包括臨床試驗申請(investigational new drug application,IND)和生產申請(新藥上市申請,new drug application,NDA)這2 個階段,分別為完成藥物臨床前研究和完成臨床研究后報送的申請。
通過檢索國家藥品監督管理局(National Medical Products Administration,NMPA)藥品數據庫、NMPA 藥品審評中心(Center for Drug Evaluation,CDE)網站、藥智網和米內網等商業數據庫,結合中國知網、谷歌、百度等搜索引擎,以受理號計,系統收集2007年10月1日—2019年12月31日CDE 受理的中藥新藥注冊申請數據,對各申請審評結論的統計時間為2020年6月30日。將審評結論分為批準、不批準和結論待定3 類。其中,參考張曉東等[7]報道的標準,退審、企業撤回、由于各類原因終止審評程序等情況,均視為不批準;結論待定,包括審評意見為資料發補或書面發補、需進一步咨詢、生產現場核查及缺失技術審評結論的情況。以總批準件數在總受理件數中的占比計算總體批準率,以截至本文統計時間獲批的中藥新藥申請件數在其受理年度總申請總件數中的占比,計算年度批準率。采用Excel 2016 統計處理數據。
2 《辦法》2007年版實施期間中藥新藥注冊審批情況分析
2.1 受理及審評概況
2007—2019年CDE 共受理980 件中藥新藥申請,含IND 686 件和NDA 294 件,見表1。從受理總量的逐年變化趨勢而言,2008—2014年均維持在約100 件/年,此后出現回落,2015年約68 件,2016年降為31 件,至2019年減至18 件;細分為IND和NDA 后,其變化趨勢與總受理量類似。在批準情況方面,截至本文統計時間,有955 件中藥新藥申請完成審評,其中388 件獲得批準,包括IND 343件和NDA 45 件,總體批準率分別約為50%、15%。從總體批準情況的逐年變化趨勢看,與受理總量的變化相似,但細分為IND 和NDA 發現,NDA 獲批申請的受理時間分布更加集中,絕大部分于2007—2011年受理,約占總批準件數的81%,2014年后受理的NDA 申請降至0 批準,且持續至2017年,2018 和2019年小幅回升;而IND 雖然自2014年后,其年批準件數亦逐年下滑,但仍維持在15~25件/年。因而,盡管2015年后IND 受理量急劇下降,其年度批準率卻出現提升,2016年受理IND 的批準率提高至71.0%,2019年甚至達100%。
此外,在已完成審評的申請中,還有346 件為不批準,這當中除了審評結論明確為“不批準”的申請264 件,其余大部分為企業主動撤回(69 件),均為2015—2016年撤回的NDA。另有221 件結論不詳,主要為要求企業補充技術或其他資料,或審評結論缺失的情況。
2.2 中藥新藥的注冊類別
2007—2019年CDE 受理的中藥新藥申請以第6 類中藥最多,共計789 件,占總受理數的80.5%;其次是第5、1 類中藥,分別有135、41 件,占比約13.8%、4.2%。第2、3、4 類申請極少,分別僅受理7、5、3 件。核實品種信息后發現,在第2 類中藥申請中,僅有莽吉柿及其膠囊制劑的IND 于2009年獲批,且CDE“藥物臨床試驗登記與信息公示平臺”信息顯示至今仍處于II 期試驗招募中;在5 件第3 類中藥申請當中,有4 件為《辦法》2007年版前提交的NDA,并非其規定的“新的中藥材代用品”,因而實際僅有1 件IND(人工熊膽粉)為第3類中藥;第4 類中藥均為IND。可見,截至本文統計時間,2007—2019年未有第2、3、4 類中藥新藥獲得NDA 批準。
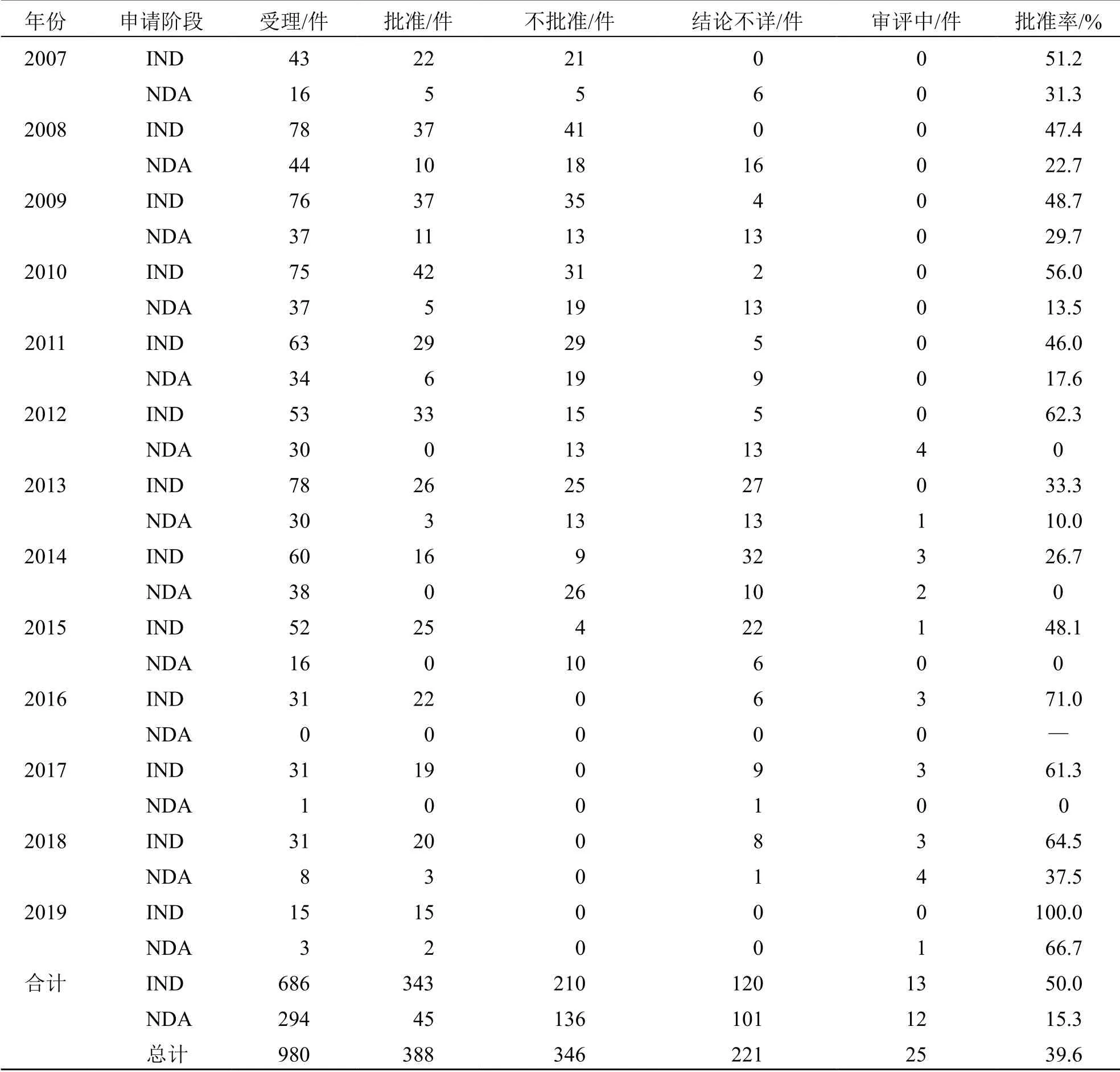
表1 2007—2019年CDE 受理中藥新藥申請的審評情況Table 1 Review of applications for new Chinese medicine registration in China from 2007 to 2019
進一步分析CDE 受理的主要注冊類別(第1、5、6 類中藥),同前述總體批準情況一致,2007—2019年這3 類中藥總體的IND 批準件數和批準率均明顯高于NDA。但從獲批申請的受理年度分布看(表2),這3 類中藥IND 和NDA 的差別則較大。在批準的IND 中,第6 類中藥的年度分布相對均勻;第5 類中藥以2010—2011年受理者居多,在2014年后出現了批準為0 的現象;第1 類中藥主要分布在《辦法》2007年版實施前期和近3年。在批準的NDA 當中,第6 類中藥主要在2007—2011年間受理的申請,占批準總數的84%,而在2014—2017年連續批準數為0;第5 類中藥僅分布在2008、2009 和2018年,分別占43%、38%、29%;第1 類中藥為0。
2.3 中藥新藥申請涉及的治療領域
在980 件CDE 受理的申請中,有2 件申請未能獲取治療領域有關信息,故本部分共納入978 件申請進行分析,結果顯示,2007—2019年我國中藥新藥注冊申請所涉及的治療領域有13 大類。無論總體申請,還是細分為IND、NDA 后,心腦血管疾病、消化系統疾病、呼吸系統疾病、婦科用藥和骨骼肌肉系統疾病均是申請最多的前5 類,合計約占70%,其余還依次涉及神經系統疾病、泌尿系統疾病、五官科、皮膚科、兒科、腫瘤疾病、補氣補血類和其他。以受理數與批準數的比值(批準比值)反映各治療領域申請獲批的難易程度(表3)可以發現,各領域的批準比值約為2∶1~3∶1,總體上的獲批難易程度相似。進一步細分為IND 和NDA后,IND 階段各領域的批準比值較接近,約2∶1,而在NDA 階段則相差甚遠,泌尿系統疾病和補氣補血類用藥尚無NDA 批準,在有NDA 批準的其余治療領域中,以神經系統疾病用藥最難,批準比值約26∶1,其次為心腦血管疾病用藥,約11∶1,之后是五官科和婦科用藥,分別約為10∶1、7∶1,皮膚科用藥最易獲批,比值約為2∶1。
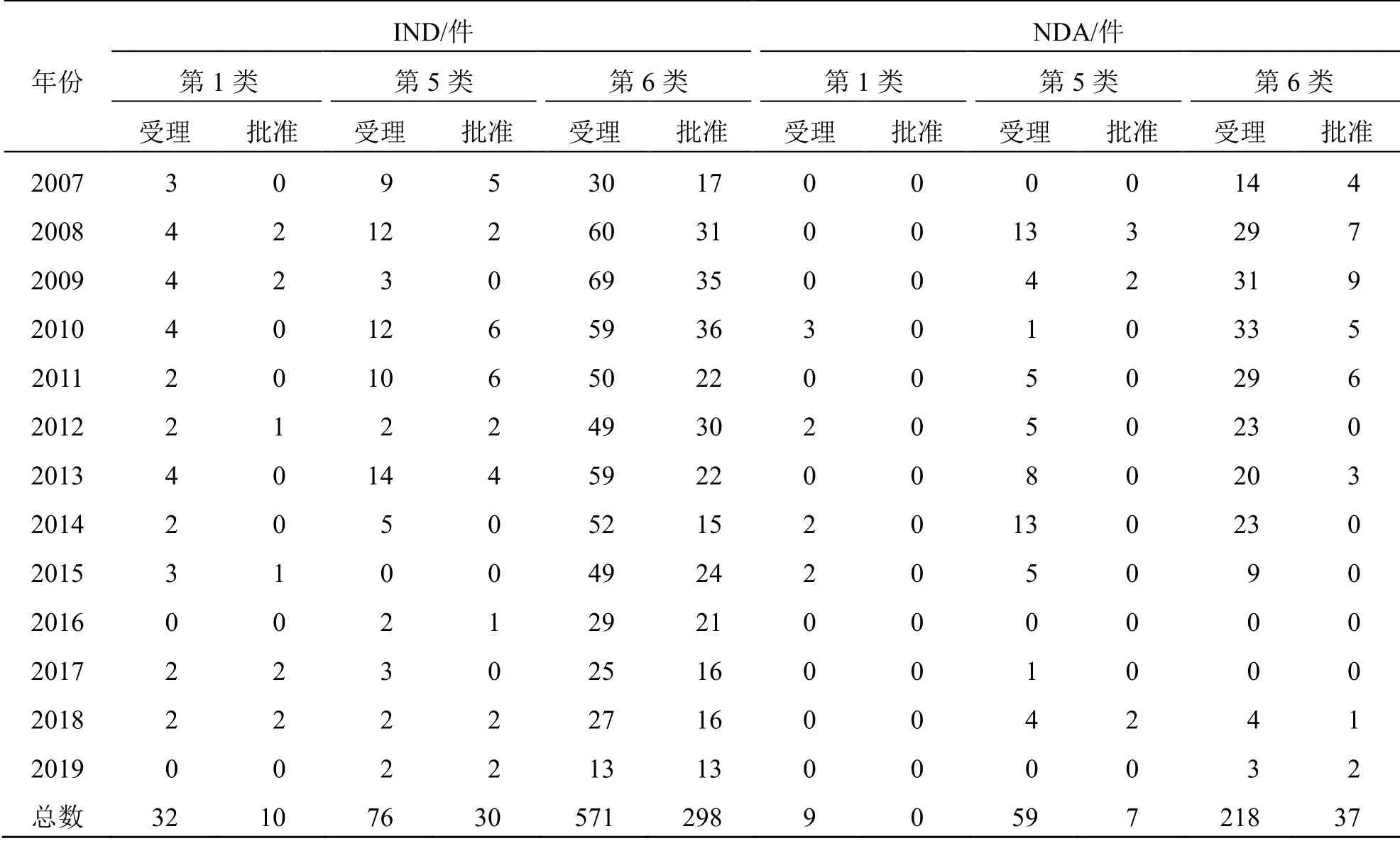
表2 2007—2019年CDE 受理的第1、5、6 類中藥新藥申請的受理與批準情況Table 2 Acceptance and approval for 1st,5th,and 6th new Chinese medicine registration applications in China from 2007 to 2019
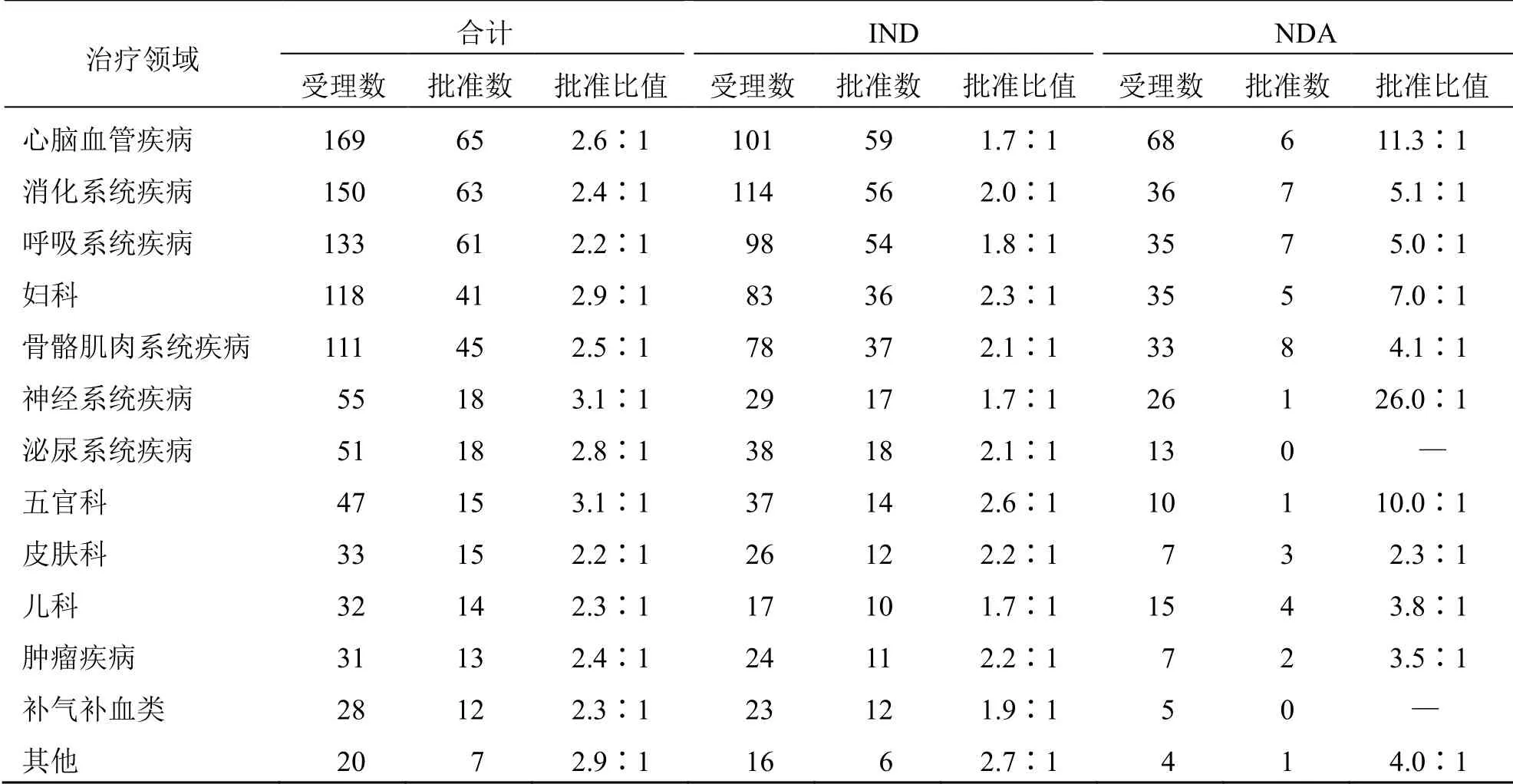
表3 2007—2019年CDE 受理中藥新藥申請的治療領域情況Table 3 Therapeutic area of new Chinese medicine registration applications in China from 2007 to 2019
2.4 中藥新藥申請涉及的劑型
2007—2019年CDE 受理的中藥新藥申請中,涉及制劑的申請共有897 件,主要為普通口服制劑(87%)、黏膜給藥和外用制劑(11%)、注射劑(2%)這3 大類,且細分為IND 和NDA 后仍呈類似分布。就具體劑型的構成而言(表4),在普通口服制劑申請中,總體申請及細分為IND 和NDA 后,均以膠囊劑、顆粒劑和片劑占據絕大部分比例,合計約88%,另有約10%為口服液和丸劑,約2%為糖漿劑、散劑等。在黏膜給藥和外用制劑申請中,IND 和NDA 則表現出了不同的構成特點;IND 涉及最多的為外用膏劑(33%),其余依次是噴霧劑(14%)、凝膠劑(11%)、栓劑(11%)、貼劑(10%)、滴眼液(7%)、擦劑(6%)等;而NDA 制劑申請以貼劑(46%)最為多見,其余主要還涉及外用膏劑(17%)、凝膠劑(13%)、噴霧劑(8%)和栓劑(8%)等。注射劑共涉及22 件,這類劑型自2011年起少有涉及,近3年未見申請。
同樣以批準比值反映各劑型獲批的難易程度,見表4,在批準的普通口服制劑中,IND 階段(286件)各劑型的獲批難易程度相差不大,但在NDA 階段(37 件)以丸劑更易獲批,批準比值為2.4∶1,其余劑型達6.4∶1~8.0∶1,尚無口服膏劑、口服散劑、糖漿劑和酒劑獲批。在批準的黏膜給藥和外用制劑中,IND 階段(37 件)以滴眼液(5.0∶1)最難,其余劑型約在1∶1~2∶1;NDA 階段(6 件)獲批的劑型僅有貼劑、凝膠劑和外用膏劑,以貼劑難度最大(5.5∶1),其余申請的劑型尚無批準。
3 討論
3.1 中藥新藥注冊申請和審評審批的歷年變化趨勢
由于《辦法》2005年版審批標準偏低,尤其是規定改劑型中藥如無質的改變,可減免臨床研究,中藥仿制藥只要符合國家標準即可減免相關研究[8],造成企業研制新藥的積極性不強,申報簡單改劑型和仿制中藥的數量急劇增多。針對該問題,《辦法》2007年版通過提高新藥的要求,如規定已上市藥品改變劑型、給藥途徑或增加新適應癥的,不再按照新藥管理[9],鼓勵創新藥物研發。從表1 可以看出,中藥新藥申請在《辦法》2007年版實施后迅速回歸理性,從2006年的數千件降至約100 件,提示當時對《辦法》2005年版的改革取得了良好成效。從《辦法》2007年版實施期間中藥新藥申請受理的歷年變化趨勢看,IND 和NDA 受理的件數在2015年以前均保持相對較高水平,分別52~78、34~44 件/年,之后急劇下降,尤其是NDA,降至個位數的年受理量,在2016年甚至出現0 受理。本文分析這可能與2015年《國務院關于改革藥品醫療器械審評審批制度的意見》和緊隨其后的系列改革政策文件的發布有關,尤其“關于開展藥物臨床試驗數據自查核查工作的公告”[10],不僅與NDA 受理量大幅下降直接相關,而且可能也是引發企業主動撤回大量新藥注冊申請的主要原因。本文統計在2015—2016年企業撤回的69 件中藥新藥NDA,可能均屬此類情況。在批準情況的歷年變化趨勢中,相較NDA,IND并未出現后期的大幅降低,仍保持在15~25 件/年。因而,盡管IND 的受理件數同NDA 一樣,在2015年后仍急劇下降,但其年度批準率反而出現較大提升,2019年度受理的15 件申請甚至全部獲批。筆者認為這可能與2018年7月NMPA 發布“關于調整藥物臨床試驗審評審批程序的公告”[11]提出默示許可制度有關。2019年12月的2 件IND(第6 類中藥“參芪麝蓉丸”和“硝石甘膽顆粒”)均為默示許可。
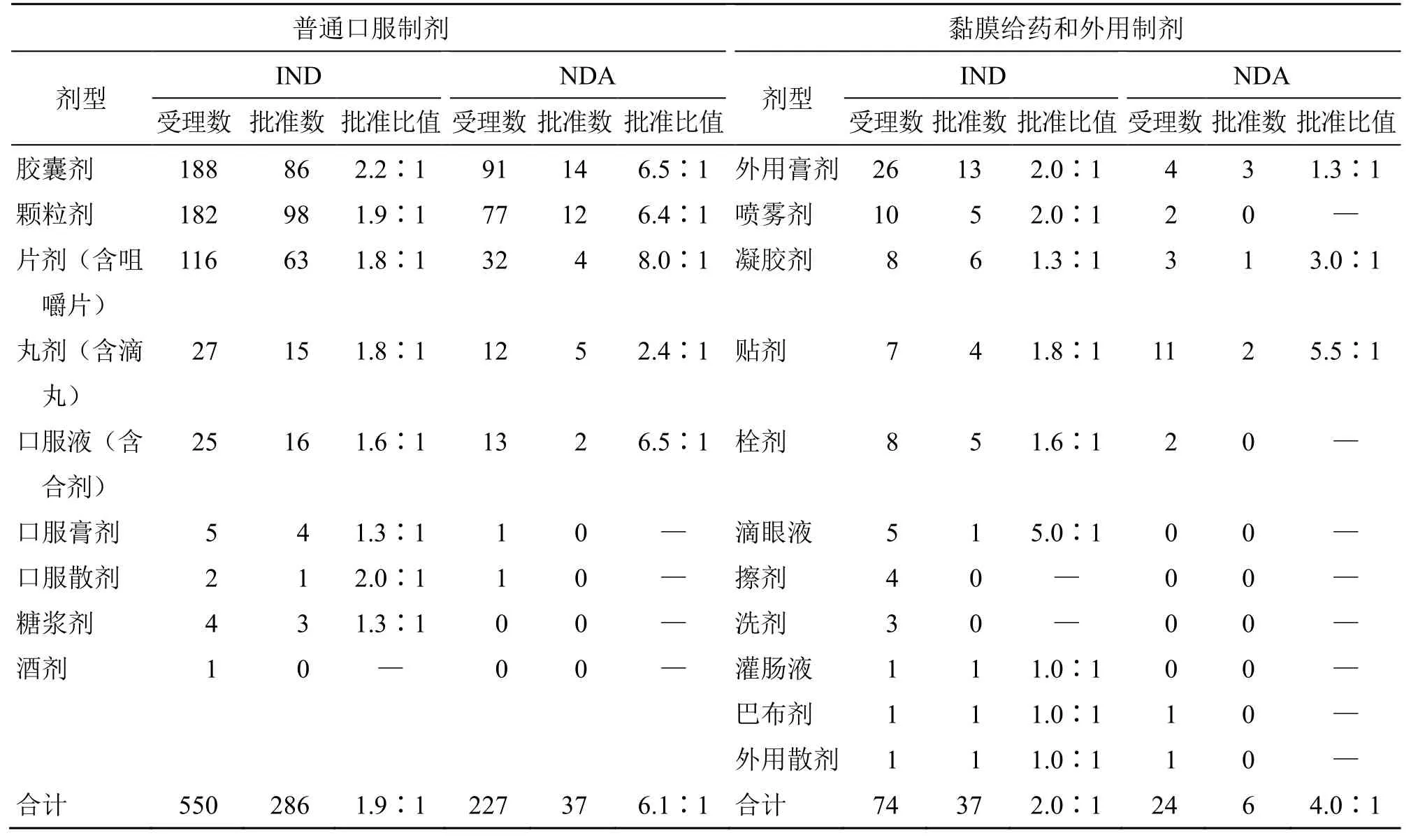
表4 2017—2019年CDE 批準的中藥新藥申請相關劑型情況Table 4 Approved pharmaceutical dosage forms of new Chinese medicine registration applications in China from 2007 to 2019
總體而言,在《辦法》2007年版實施后期,尤其近5年來,我國中藥新藥注冊的申請和審批現狀不甚理想。其中,IND 作為連接新藥研發與上市注冊的中間關鍵環節,其受理量反映了新藥研發的活躍程度。而目前我國中藥新藥IND 低受理量的現狀,間接反映了當前符合中藥特點的研發與技術評價體系以及監管政策等,均存在潛在的問題或缺陷,也直接引發對中藥產業未來創新發展的擔憂,中藥產業界、學術界及主管部門應當對該問題引起充分重視。雖然默示許可制度已寫入2020年新版《辦法》[12],對鼓勵創新藥的研制有直接地推動作用,但對于中藥而言,政策的落地還應多管齊下,結合不同注冊類別的實際情況(如非臨床安全性研究的要求、已有人用證據在產品注冊中如何應用),完善后續的相關配套文件。
3.2 各類中藥新藥申請的情況
《辦法》2007年版實施期間,中藥新藥申請的注冊類別分布極不均衡,主要涉及第1、5、6 類,以第6 類占據絕大部分比例(80.5%),無第2、3、4 類中藥批準上市。這與我國中藥新藥研發實際有關,一方面,第2、3、4 類中藥,即新發現的藥材及其制劑、新的中藥材代用品、藥材新的藥用部位及其制劑,缺乏人用歷史,開發難度和風險更大,企業積極性不高;另一方面,第1、5、6 類中藥的研制均不同程度受中醫臨床的啟發,申請和批準最多的第6 類中藥主要源自臨床實踐,有豐富的人用基礎,在新藥申報過程中可獲得非臨床藥效學研究、甚至臨床試驗的減免,企業積極性更強。但藥用資源直接關系到中藥產業的健康發展和環境可持續保護,其重要性不言而喻。我國早在1999年《新藥審批辦法》已經開始重視中藥資源問題[13],到《辦法》2007年版在中藥新藥注冊類別中明確了第2、3、4 類。盡管此前有諸如人工麝香(2004年批準)等少數中藥材代用品獲批上市,但《辦法》2007年版實施13年間,無1 件上述3 類中藥的NDA 獲批,提示了我國中藥資源可持續發展面臨的潛在難題。
2016年《中醫藥發展戰略規劃綱要(2016—2030年)》[14]明確指出了我國中醫藥可持續發展面臨資源總量不足,野生中藥材資源破壞嚴重,部分中藥材品質下降等問題。2017年《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》第13 條和2020年新版《辦法》亦從國家和法規層面提出應當促進資源可持續利用。可見,當前加強第2、3、4 類中藥的開發和注冊的重要性。從2020年新版《辦法》中藥有關的配套文件“中藥注冊分類及申報資料要求”[4]對“中藥創新藥”(1.1、1.2 和1.3 類)規定的具體內容看,實際與《辦法》2007年版中藥新藥規定的范圍類似,1.1 類的內容基本囊括在原第6 類中藥新藥當中,1.2 類和1.3 類則分別包括了《辦法》2007年版的第1、5 類和第2、3、4 類中藥。為避免出現《辦法》2007年版實施期間,新的藥材、新的中藥材代用品等注冊類別NDA 0 批準的局面,藥監部門在后續制定相應指導文件時,應吸取歷史經驗教訓,加強對這類中藥新藥的政策激勵,才能從源頭保障中藥產業健康可持續發展。
3.3 中藥新藥申請涉及的治療領域
《辦法》2007年版實施期間,國內中藥新藥申請的治療領域主要集中在心腦血管疾病、消化系統疾病、呼吸系統疾病、婦科用藥和骨骼肌肉系統疾病這5 類,這可能與上述領域的患病人群和市場潛力大、中醫藥具有防治優勢等有關。從獲批難易程度看,在IND 階段,各治療領域類似;但在NDA階段,泌尿系統和補氣補血類用藥未有批準,神經系統疾病、心腦血管疾病、五官科等領域均較難獲批,受理/批準比值超過了10∶1,這可能與上述領域臨床試驗研究難度大有關。同時,由于在版《辦法》2007年以前,新藥審批標準較低,相當部分的申辦者對臨床試驗研究的重視程度不夠,加之臨床試驗設計能力有限,未能深入認識產品的臨床定位,不僅導致我國早期批準上市的諸多中成藥存在定位寬泛、臨床價值不清晰的問題[15],而且一定程度致使一些臨床定位不清晰、功能主治范圍過大的NDA 申請的產生,在《辦法》2007年版提高審批標準后,也就成為導致上述領域獲批難度增大的可能原因。
自2015年我國啟動藥品審評審批改革以來,CDE 已就中藥新藥臨床研究的一般原則,中藥新藥治療原發性骨質疏松癥、中風、惡性腫瘤、流行性感冒、腸易激綜合征、功能性消化不良、咳嗽變異性哮喘、類風濕關節炎、慢性心力衰竭、癡呆10 個適應癥制定了指導原則,用以指導企業和臨床研究者開展相應研究。建議CDE 在制定其余更多相關指導原則的過程中,還可進一步重點結合前述《辦法》2007年版實施期間無NDA 批準,以及批準難度較大的治療領域,從中選擇具有代表性的中醫優勢領域病種,發揮更好的政策導向和技術指導作用,滿足業界和臨床需求。
3.4 中藥新藥申請涉及的劑型
《辦法》2007年版實施期間,膠囊劑、顆粒劑和片劑等普通口服制劑,是各年度CDE 受理中藥新藥申請的主要劑型,這與治療領域用藥特點、研發難易程度有關,也與中藥新藥注冊類別的分布特點密切相關。目前申報和批準的中藥新藥多為第6 類中藥復方制劑,日服劑量相對較大,需選擇載藥量大的劑型。此外,中藥注射劑自2006年魚腥草注射液事件發生后,國內對中藥注射劑安全性尤其關注,藥監部門于2007年頒布《中藥、天然藥物注射劑的基本技術要求》和《中藥注射劑安全性再評價工作方案》,2009年發布“關于開展中藥注射劑安全性再評價工作的通知”,2011年發布“中藥注射劑安全性再評價基本技術要求”,對藥學和安全性研究提出更高的要求。因而,中藥注射劑近幾年幾乎無企業申報,整個《辦法》2007年版實施期間,亦無IND 和NDA 獲批。
2017年中共中央辦公廳、國務院辦公廳印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》第13 條提出支持中藥傳承和創新,中藥研究應“處理好保持中藥傳統優勢與現代藥品研發要求的關系”的原則,并“鼓勵運用現代科學技術研究開發傳統中成藥,鼓勵發揮中藥傳統劑型優勢研制中藥新藥”。從前述《辦法》2007年版實施期間CDE 受理和批準申請的有關劑型分布情況看,目前中藥新藥劑型的研制在傳承與創新方面尚顯不夠。申報單位關注的劑型集中度較高,丸、散、膏、丹等傳統劑型缺乏,現代制劑技術結合中醫藥特點研制的新劑型匱乏,僅有少數中藥新藥申請涉及噴霧劑、巴布劑、滴眼液等,且尚無產品的NDA獲批。如何在中藥新藥的劑型研制領域做好傳承與創新,值得中藥產業界、學術界和藥監部門深思,2020年新版《辦法》相關配套文件也應做相應考慮。
利益沖突所有作者均聲明不存在利益沖突

