長方案全胚胎冷凍保存后首次凍融胚胎移植時機研究
王莉云 馬榮花 白雪
自1978年Edward等報告世界首例試管嬰兒誕生以來,人類體外受精與胚胎移植在世界各地已被廣泛應用。隨著人類輔助生殖技術(ART)的不斷發展及應用范圍的不斷拓展,人們的需求也隨之增多,醫源性相關疾病也在增加。在ART中控制性超促排卵是常規技術,可在一個助孕周期獲得多個卵子,體外受精后可有多個胚胎,從而增加妊娠幾率,但同時使得卵巢過度刺激征(OHSS)、多胎妊娠等并發癥增加,因此通常每次移植胚胎數在3個以內,剩余的胚胎進行冷凍保存備用。世界首例玻璃化凍融人胚胎于1990年移植獲得妊娠,該技術具有不需額外購買儀器、用時短、操作簡單、最大限度地降低冷凍技術對于胚胎的影響、胚胎復蘇率高等優點,隨著胚胎玻璃化冷凍技術的成熟和進步,使凍融胚胎移植(FET)臨床應用逐漸擴展。FET周期數和比例逐年增加。繼之全胚胎冷凍策略成為一種發展趨勢,更多的中心將其作為一種首選的治療方案。等待凍融胚胎移植患者也越來越多,研究者也更關注技術本身的安全性以及患者的獲益,如何選擇最佳凍融胚胎移植時機盡量減少進行輔助生殖技術的達活產時間顯得尤為重要,但相關研究報道尚不多見。目前未見研究證實經過超促排卵取卵后母體子宮內膜環境多久才能恢復的報道。既往經驗為避免超排卵的不良影響,常選擇患者自然恢復排卵大約2個月后進行FET,有些患者甚至時間更久,但過長時間的延遲移植使患者處于長時間的渴望期待中,甚至會產生焦慮緊張情緒,從而對未來FET可能造成不良影響。本中心利用部分體外受精-胚胎移植(IVF-ET)患者資料進行分析,旨在探討首次凍融胚胎移植的時機。
材料與方法
一、研究對象
選擇2017年1月至 2018年12月在青海省人民醫院生殖中心行體外受精-胚胎移植術(IVF-ET)后行全胚冷凍患者共171例。經患者知情同意并獲本院倫理委員會批準實施本研究。
1.納入標準:(1)常規IVF或單精子卵母細胞漿內注射(intracytoplasmic sperm injection,ICSI)后因取卵前高孕酮、取卵后發熱、卵巢過度刺激綜合征高風險或者發生其他不可預料的意外等取消新鮮移植(embryo transfer,ET);(2)促性腺激素釋放激素激動劑長方案;(3)患者年齡介于20~40歲之間;(4)胚胎凍存均采用玻璃化冷凍方法。
2.排除標準:(1)合并多發子宮內膜息肉、重度不典型增生、多發子宮肌瘤、重度宮腔粘連;(2)反復種植失敗(repeated IVF-ET failure,RIF);(3)合并卵巢或其他系統腫瘤;(4)合并病情未控制的甲狀腺亢進或減退;(5)除染色體多態性以外的染色體異常。
3.分組:根據患者是否首次行經來診準備FET,連續序貫治療不間斷,移植間隔最長時間約69 d確定為分組時間點,分為兩組,連續序貫治療間隔時間≤69 d的為間隔短(≤69 d)組共80例,等待時間治療且間隔時間>69 d為間隔長(>69 d)組共91例。
二、研究方法
1. 基礎資料:患者的年齡、BMI、不孕類型、不孕原因、基礎內分泌均來自本中心建檔記錄。BMI=體重[kg]/身高2[m2],患者在試管周期前在本中心測量身高、體重,計算獲得BMI;不孕類型分為原發不孕和繼發不孕;不孕原因分為子宮輸卵管因素、子宮內膜異位癥、男方因素及其他;基礎內分泌指標為患者在本中心建檔后測量的性激素5項(FSH、LH、E2、PRL、T)。
2.控制性超排卵(COH)方案:長方案超排卵,于治療前月經周期的黃體中期(周期第21天或排卵后7天)應用GnRH-a 1.25 mg,在月經的第3~5天(約降調節14 d)開始促排卵;當主導卵泡的直徑≥18 mm,當晚8時注射HCG 5 000~10 000 IU,以誘導卵泡最后成熟,并在注射HCG后36~37 h行取卵術,取卵術后常規IVF或ICSI受精,受精后形成的全部可利用D3胚胎及囊胚均玻璃化冷凍保存。
3.內膜準備方案:(1)自然周期方法:在月經第8~10天B超監測卵泡,當優勢卵泡直徑達15 mm時,每天測尿LH峰,卵泡直經大于18 mm或出現尿LH峰,當日肌注HCG 5 000 IU,B超監測排卵后第3天移植卵裂期胚胎或第5天移植囊胚。(2)降調節人工周期,用于自然周期無排卵、自然周期內膜不佳,黃體期給予達菲林1.25 mg,降調節14 d后開始雌孕激素準備內膜給予β17雌二醇(芬嗎通)2 mg。每日根據內膜生長情況逐漸增加劑量至6 mg/日,通常當雌激素應用大于10 d,內膜厚度超過8 mm時進行內膜轉化給予安琪坦膠丸0.4~0.6 g/d陰道塞入,內膜轉化3 d后移植卵裂期胚胎或者轉化5 d后移植囊胚。
4.指標定義:卵裂率=(授精卵裂胚胎數/受精卵數)×100%,優胚率=(優質胚胎數/正常受精卵裂胚胎數)×100%,ET優胚率=(移植的優質胚胎數/移植的胚胎數)×100%,獲胚數指獲得的可利用的胚胎數,ET胚胎數指移植的胚胎數量。
結 果
一、兩組患者一般情況比較
兩組患者年齡、BMI、不孕類型、不孕原因、基礎內分泌差異無統計學意義(P>0.05),見表1。
二、兩組患者不同內膜準備方案比較
兩組患者采用降調節人工周期及自然周期行內膜準備,其差異無統計學意義(P>0.05),見表2。

表1 兩組一般情況分析(均數±標準差)Table 1 Basic characteristics between the two groups

表2 兩組不同內膜準備方案的比較[例(%)]Table 2 Comparison of different endometrial preparation schemes between the two groups [n(%)]
三、兩組患者移植囊胚和卵裂期胚胎情況比較
兩組患者移植囊胚和卵裂期胚胎所占比例相比較,差異無統計學意義(P>0.05),見表3。
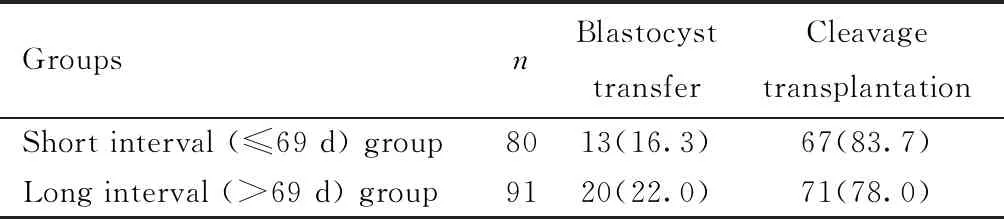
表3 兩組囊胚和卵裂期移植情況比較[例(%)]Table 3 Comparison of blastocyst and cleavage transplantation between the two groups [n(%)]
依據獲卵數多少再進行分組,獲卵數>15個組有90例,獲卵數≤15個組有81例,兩組妊娠率無統計學差異,但獲卵數>15個組的妊娠率有增高趨勢,見表4。
四、兩組患者妊娠結局的比較
間隔短(≤69 d)組患者在HCG日E2值低于間隔長(>69 d)組,差異有統計學意義(P<0.05)。間隔短(≤69 d)組患者卵裂率、優胚率、ET優胚率及臨床妊娠率均高于間隔長(>69 d)組,差異有統計學意義(P>0.05)。兩組患者在HCG日的LH值、P值、獲卵數、受精率、獲胚數比較,差異無統計學意義(P>0.05),見表5。

表4 根據獲卵數分組[例(%)]Table 4 Pregnancy rate according to the number of ovums [n(%)]
表5 兩組妊娠結局比較(均數±標準差)Table 5 Comparison of pregnancy outcomes
討 論
本研究結果顯示間隔短(≤69 d)組妊娠率略高于間隔長(>69 d)組,差異有統計學意義,考慮與間隔短(≤69 d)組患者移植優質胚胎比例和數量相對高有關,使其臨床妊娠率有增高趨勢,但是否與間隔短(≤69 d)組患者移植時間間隔較短,患者心理狀態及依從性好有關系,還需大樣本的研究進一步證實。2018年Ozgur[1]等對1 121例全胚凍存后行FET患者進行不同移植時間間隔研究報道,756例32~46 d 行FET,226例47~61 d行FET,139例大于62 d行FET,結果顯示1次月經后FET的活產率為57.8%與4次月經后FET的活產率(54.9%)相似。2018年梁利東[2]等研究報道全胚凍存后79例≤45 d為鄰近組,276例>45 d為非臨近組,兩組臨床妊娠率分別為51.9%和48.2%,活產率分別為43%和38.4%,差異無統計學意義,認為取消IVF新鮮周期移植后的第一個周期中立即行FET的臨床妊娠率和活產率與至少經歷一次月經周期后的FET無明顯差異。通過本研究及以上相關報道,可以認為全胚胎凍存后,首次行經即可開始行凍融胚胎移植準備,不影響成功率且這種連續序貫治療,可使患者心理適應性好從而可以減少焦慮緊張情緒相關。
本研究納入的患者均采用促性腺激素釋放激素激動劑長方案進行控制性超促排卵,因此方案可抑制內源性峰提早出現,從而改善卵子質量,提高排卵率和優質胚胎率,開啟了IVF-ET 的里程碑,但即使如此優化的方案仍擺脫不了妊娠率低的難題,其中子宮內膜容受性及胚胎-子宮對話異常被認為是引發胚胎著床失敗、導致妊娠率低的關鍵因素[3]。吳瓊等研究發現,GnRHa 超排卵后,多個卵泡同時發育成熟排出,引起小鼠著床期雌、孕激素失衡,子宮內膜形態結構發生改變,不能為胚胎著床提供良好的微環境,并可能通過下調 LIF、p-STAT3、HBEGF 和 glycodelin A 蛋白的表達影響子宮內膜容受性的建立和胚胎-子宮對話,進而對胚胎著床產生一定的不利影響,導致胚泡發育緩慢,著床數量減少[4]。本結果顯示兩組患者獲卵數均較多,間隔短(≤69 d)組獲卵數約17枚,間隔長(>69 d)組約15枚,HCG日E2值顯著增高,超排卵期間及取卵術后除外易導致OHSS發生,雌孕激素失衡明顯,不利于胚胎著床,因此選擇全胚冷凍后擇期FET移植在一定程度上是合理的。另外,研究證明,超排卵可導致卵母細胞發育或者隨后的胚胎植入過程中患者血中雌二醇、孕酮、血管內皮生長因子等在內的多種激素水平明顯增加[5],超過正常的生理水平。因此,異常的激素環境對卵母細胞的發育潛能、子宮內膜容受性、胚胎的植入等產生了什么樣的負面影響?超排卵后激素水平及子宮內膜多久才可以恢復到正常生理狀態呢?研究表明,超排卵期間卵巢中存在多個卵泡,每個卵泡均分泌雌二醇(E2)進入循環,使循環中E2水平顯著升高,可高達1 500~5 000 pg/mL,卵巢高反應的患者E2水平甚至更高,而高劑量的E2會影響子宮內膜。在一項體外研究中發現,將小鼠胚胎與從人類可生育的婦女獲得的子宮內膜組織一起培養,將胚胎暴露在高濃度E2環境下,其胚胎發育異常,粘附力下降[6]。其次,超排卵導致孕激素的提前升高使子宮內膜接受窗發生改變,而這一環境的改變可引起胚胎的表觀遺傳學改變,其效應可能影響子代生長受限,且這種變化會貫穿于后代整個生命周期[7]。然而子宮內膜容受性是影響胚胎著床率的重要影響因素,研究表明超排卵可使子宮內膜從組織學上發生變化,主要表現為子宮內膜腺體的上皮細胞管腔表面出現胞飲小泡[8],超排卵期間這種改變會出現的比自然狀態下更早。IVF周期取卵當天的子宮內膜活檢發現,獲卵數更多、更年輕的患者子宮內膜的組織學改變會更早發生[9],這一系列的改變可降低子宮內膜與“種植窗期”有關的特殊整合素的表達,影響其接受胚胎的最佳時機[10],從而降低胚胚胎著床率及妊娠率。本研究中所納入的均為年輕患者,獲卵數多,間隔短(≤69 d)組患者E2值為(5 660.7±2 650.4),間隔長(>69 d)組E2值為(5 958.9±3 944.1),E2值間隔短(≤69 d)組明顯高于間隔長(>69 d)組,差異有統計學意義;間隔短(≤69 d)組臨床妊娠率為68.7%(55/80),間隔長(>69 d)組臨床妊娠率為52.7%(48/91),間隔短(≤69 d)組臨床妊娠率明顯高于間隔長(>69 d)組,表明全胚凍存后首次來月經后子宮內膜容受性基本恢復。2017年Lattes[11]等對512周期凍胚移植周期的妊娠結局做了對比,其中263例取卵后歷經一個月經周期后行移植術,249例取卵后歷經2個月經周期后移植,兩組相比,1個月經周期后活產率(37.6%)高于2個月經周期后的活產率(27.3%),差異有統計學意義,且多因素回歸分析表明對活產率有顯著影響的變量是母親的年齡、移植胚胎的數量、移植時胚胎發育的天數和內膜準備類型,而與移植的時間間隔沒有關系。
是否全胚胎凍存時代已經到來?當今國內外眾多研究充分證明FET各種優勢所在,似乎胚胎“凍一凍”會更好。甚至有科學家提出了“非選擇性全胚胎冷凍移植(freeze-all ET)”的概念。從2013年到2015年美國輔助生殖技術年報顯示新鮮周期移植率從86.7%到73.6%下降[12],同期,中國中華醫學會生殖醫學分會(CSRM)輔助生殖技術數據上報系統中顯示新鮮周期移植率從67.7%下降到53.1%,2016年繼續下降為47.8%[13]。
為什么胚胎“凍一凍”會更好?首先從母體方面看,新鮮胚胎移植時超排卵周期母體處在高雌激素水平環境及促排卵藥物使用超出正常生理范疇,對子宮產生不利影響,冷凍胚胎保存后,待母體恢復到自然的狀態再解凍移植,可以避免新鮮周期母體超生理水平狀態移植產生的不利影響。在妊娠期高血壓、妊娠期糖尿病、圍產期出血等妊娠并發癥方面,FET是否較新鮮胚胎移植增加上述風險目前各種研究結果不一、尚無定論,有研究認為FET妊娠期高血壓增高[14]、胎盤粘連發病率高[15]、產后出血的發生率高[16]、也有研究認為子癇、妊娠期糖尿病、產后出血并無差異[17-18],各研究不一致可能與研究人群、研究方案不同有關。
從胚胎方面看,冷凍保存的胚胎經過了冷凍、解凍過程,可以“優勝劣汰”,此時仍然存活并正常發育的胚胎也許是更適應外界環境,更具有生存潛能的健康寶寶。國內外有學者研究報道全胚胎玻璃化冷凍復蘇移植患者分娩孕周、早產、出生胎兒體重等各項指標均與新鮮周期移植無差異[19-21]。王桂泉綜述了近年來FET與鮮胚移植的相關研究,報道FET組低出生體重、小于胎齡兒、早早產 、早產的發生率明顯低于新鮮胚胎組,而大于胎齡兒、巨大兒、過期妊娠、圍生期死亡的發生率高于新鮮胚胎組。新生兒先天畸形發生率、重癥監護室入院率無顯著差異。研究認為這可能與新鮮胚胎移植時母體的高雌激素水平,而FET后胚胎的表觀遺傳學改變有關[22]。
本中心數據依據獲卵數再進行組,統計顯示獲卵數>15個組和獲卵數≤15個組妊娠率無統計學差異,但獲卵數>15個組妊娠率有增高趨勢,提示在長方案促排卵獲卵數多的患者行全胚胎凍存可能可以減輕早發OHSS病情,避免晚發OHSS風險。對于非長方案促排卵及卵巢低反應患者,國外有學者回顧性研究顯示,在應用微刺激促排卵時,FET組與新鮮胚胎移植組各項臨床結局指標均無顯著差異,卵巢低反應全胚胎凍存似乎并無明顯獲益[23]。這有待進一步研究。
綜上所述,本研究顯示長方案促排卵高反應和正常反應患者全胚胎凍存后首次行經即可開始凍融移植準備,連續序貫治療縮短移植時間,并不降低妊娠率且可縮短患者TTLB,使患者更加獲益。但非長方案促排卵及卵巢低反應患者結局是否一致有待進一步研究。因此,是否全胚胎凍存需根據患者的促排卵方案及卵巢反應性,在患者充分知情同意后選擇個體化的移植策略。

