乳腺浸潤(rùn)性導(dǎo)管癌潛在核心基因的生物信息學(xué)分析
羅茂珍 權(quán) 毅
乳腺浸潤(rùn)性導(dǎo)管癌(IDC)是乳腺癌主要亞型,發(fā)病率逐年上升,且呈現(xiàn)年輕化趨勢(shì)[1-2]。目前對(duì)于IDC發(fā)生、轉(zhuǎn)移具體機(jī)制不詳。全基因組分子圖譜能夠揭示腫瘤發(fā)生發(fā)展過(guò)程中的分子變化,并已被證明是識(shí)別關(guān)鍵基因的一種高效方法。本研究旨在通過(guò)生物信息學(xué)方法對(duì)從公共基因芯片數(shù)據(jù)庫(kù)(GSE29044)下載的IDC組織與正常乳腺組織的芯片數(shù)據(jù)進(jìn)行分析,探討在IDC發(fā)生和預(yù)后中潛在的關(guān)鍵基因和關(guān)鍵途徑。
1 資料與方法
1.1 資料
本研究從美國(guó)國(guó)立生物技術(shù)信息中心(NCBI)的公共基因芯片數(shù)據(jù)庫(kù)(GEO)[3]下載編號(hào)為GSE79058基因芯片數(shù)據(jù),該芯片包含了103個(gè)樣本,其中67個(gè)IDC樣本數(shù)據(jù),36個(gè)正常乳腺組織樣本數(shù)據(jù),并均由GPL570實(shí)驗(yàn)平臺(tái)(Affy-metrix公司的HG-U133-Plus-2芯片)進(jìn)行分析。
1.2 方法
1.2.1 差異基因分析 用GEO2R在線分析工具分析IDC與正常乳腺組織樣本的差異基因,并計(jì)算P值及l(fā)ogFC值。設(shè)置P<0.01、logFC>2或<-2獲得DEGs。
1.2.2 GO功能及KEGG通路富集分析 GO分析大規(guī)模功能是富集研究中常用的一種方法,基因功能可分為細(xì)胞成分(cellular component,CC)、分子功能(molecular function,MF)和生物過(guò)程(biological process,BP)。KEGG是一個(gè)廣泛應(yīng)用的數(shù)據(jù)庫(kù),它存儲(chǔ)了大量有關(guān)基因組、生物途徑、疾病、化學(xué)物質(zhì)和藥物的數(shù)據(jù)。應(yīng)用DAVID在線數(shù)據(jù)庫(kù)[4]的GO功能、KEGG功能對(duì)DEGs進(jìn)行分析。
1.2.3 構(gòu)建差異表達(dá)基因的蛋白質(zhì)-蛋白質(zhì)相互作用網(wǎng)絡(luò)(PPI) 應(yīng)用STRING在線數(shù)據(jù)庫(kù)[5]對(duì)DEGs進(jìn)行PPI分析,將結(jié)果導(dǎo)入Cytoscape軟件可視化。運(yùn)用Cytoscape軟件中的MCODE插件構(gòu)建模型,篩選出連接度較高的樞紐基因。
1.2.4 樞紐基因的生存分析 運(yùn)用Kaplan-Meier在線繪圖儀生存分析工具來(lái)評(píng)估樞紐基因在乳腺癌患者中的預(yù)后價(jià)值。根據(jù)mRNA表達(dá)的中位數(shù),將癌癥患者分為2組。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 DEGs篩選
根據(jù)P<0.01,logFC>2或<-2篩選出398個(gè)DEGs,其中有110個(gè)上調(diào)差異基因和288個(gè)下調(diào)差異基因(火山圖見(jiàn)圖1)。
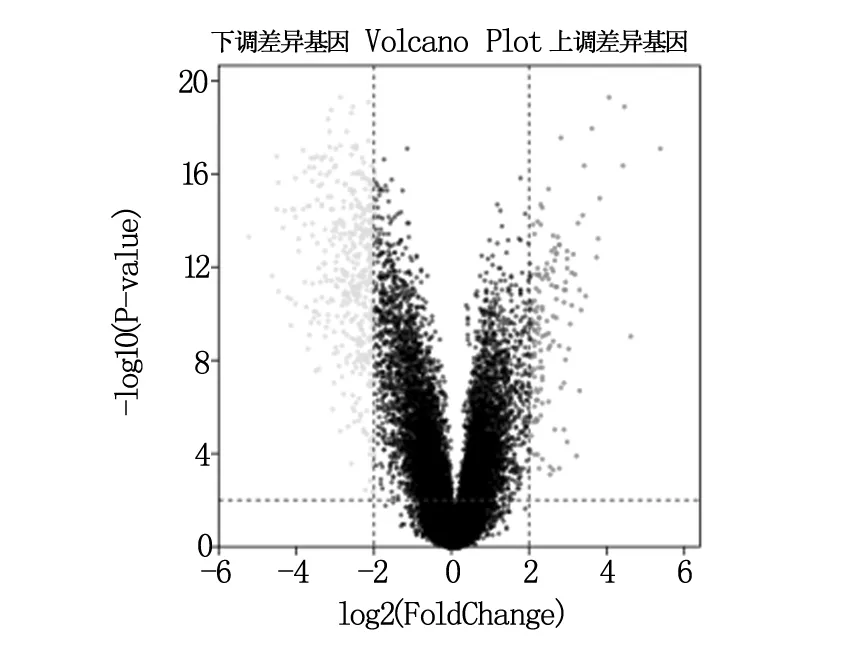
圖1 差異基因火山圖
2.2 DEGs的GO功能和KEGG富集分析
使用DAVID在線數(shù)據(jù)庫(kù)對(duì)DEGs進(jìn)行GO功能和KEGG富集分析。在生物過(guò)程方面,上調(diào)差異基因主要富集在核有絲分裂、細(xì)胞分裂、細(xì)胞增殖、膠原蛋白分解代謝的過(guò)程、內(nèi)皮細(xì)胞分化、有絲分裂細(xì)胞周期的G2/M轉(zhuǎn)變和促進(jìn)后期復(fù)雜依賴(lài)的分解代謝過(guò)程,下調(diào)差異基因富集在細(xì)胞趨化作用、細(xì)胞粘附、積極的調(diào)控細(xì)胞增殖和半橋粒裝配。細(xì)胞組分方面,上調(diào)差異基因富集在細(xì)胞中間體、紡錘體、紡錘體微管和蛋白質(zhì)的細(xì)胞外基質(zhì),下調(diào)差異基因富集在細(xì)胞外空間、細(xì)胞外區(qū)域、細(xì)胞外基質(zhì)外來(lái)體、蛋白質(zhì)的細(xì)胞外基質(zhì)和受體復(fù)合物。在分子功能方面,上調(diào)差異基因富集在蛋白結(jié)合、ATP結(jié)合和蛋白絲氨酸/蘇氨酸激酶活性,下調(diào)差異基因主要是與在肝素結(jié)合。上調(diào)差異基因富集在細(xì)胞周期、卵母細(xì)胞減數(shù)分裂、細(xì)胞外基質(zhì)受體相關(guān)作用和p53信號(hào)通路,下調(diào)差異基因富集在細(xì)胞黏著斑連接聯(lián)和PPAR信號(hào)通路(結(jié)果見(jiàn)表1、2,圖2、3所示)。
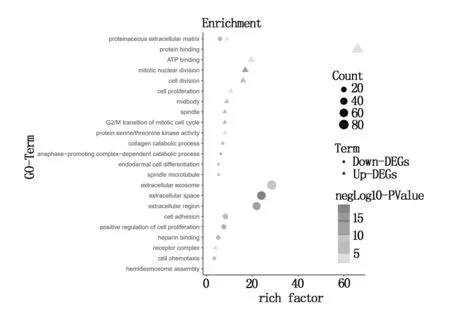
圖2 差異基因GO功能富集結(jié)果
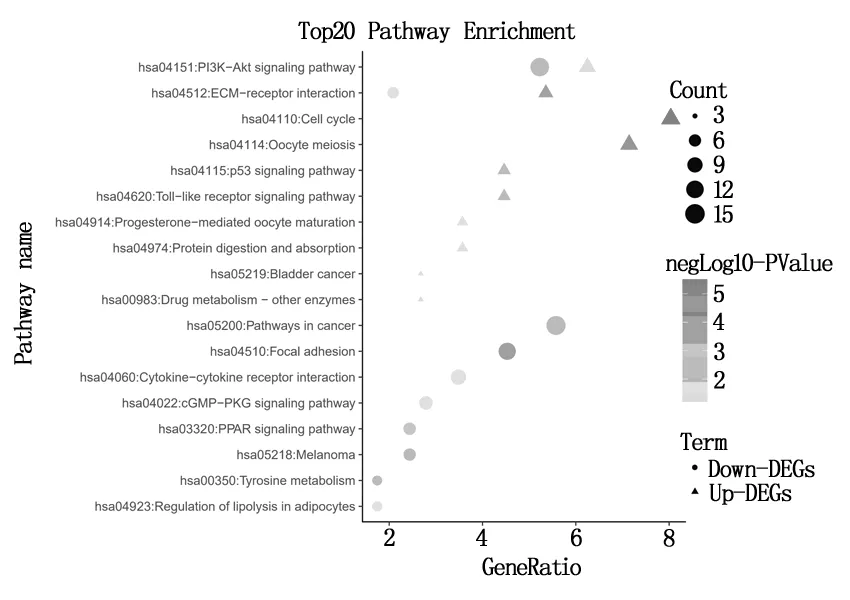
圖3 差異基因信號(hào)通路富集結(jié)果
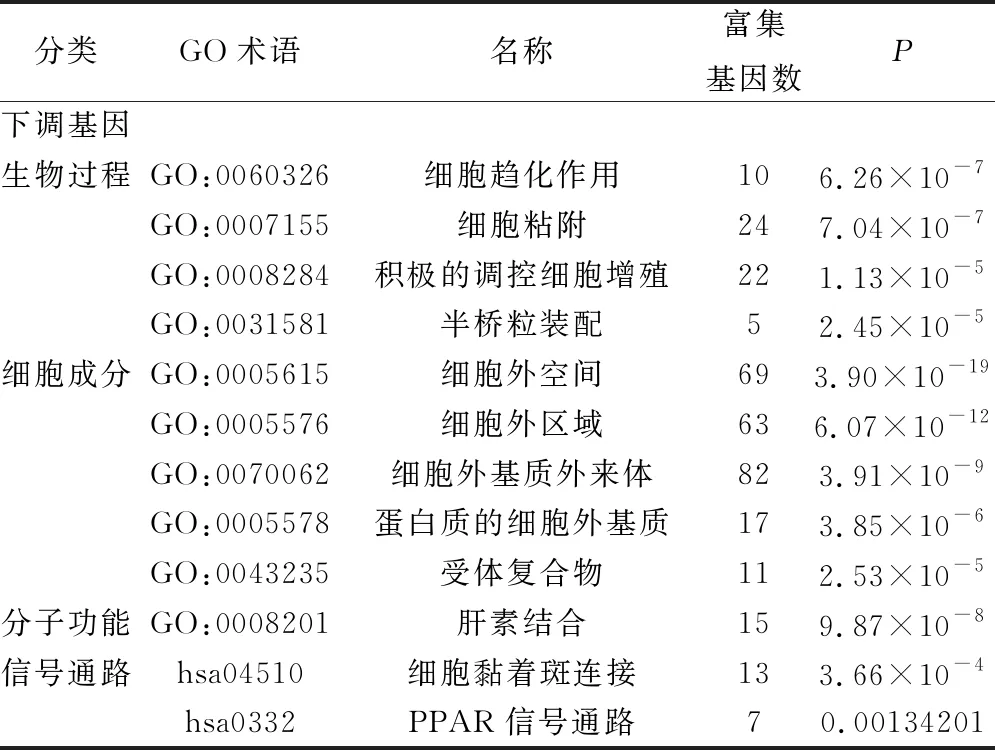
表1 下調(diào)差異基因富集分析
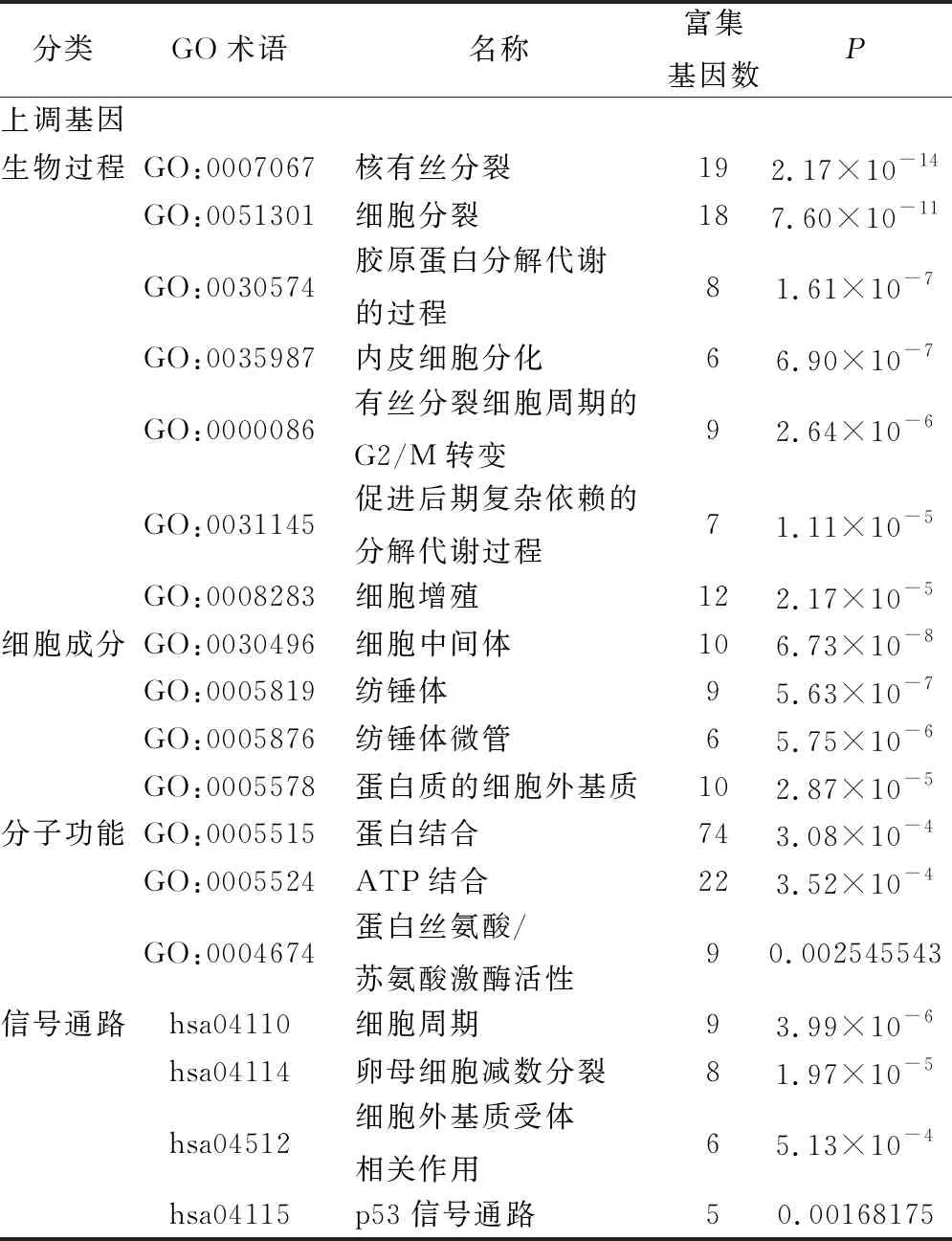
表2 上調(diào)差異基因富集分析
2.3 蛋白互作網(wǎng)絡(luò)(PPI)分析和樞紐基因篩選
使用STRING在線數(shù)據(jù)庫(kù)分析DEGs,構(gòu)建復(fù)雜DEGs相互作用網(wǎng)絡(luò),PPI網(wǎng)絡(luò)中共有348個(gè)節(jié)點(diǎn)和2090條邊,將結(jié)果導(dǎo)入Cytocscape(結(jié)果見(jiàn)圖4)。為了在PPI網(wǎng)絡(luò)中檢測(cè)出重要的聚類(lèi)模塊,使用MCODE插件進(jìn)行模塊分析,得分最高的模塊1中包含42個(gè)蛋白(結(jié)果見(jiàn)圖5),均為上調(diào)基因編碼。從模塊1中篩選出連接度較高的HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55等10個(gè)與乳腺癌研究較少的樞紐基因。
2.4 樞紐基因生存分析
將HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55等10個(gè)樞紐基因上傳至Kaplan-Meier在線繪圖儀生存分析平臺(tái),HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55的高表達(dá)均與乳腺癌不利總體生存相關(guān)(結(jié)果見(jiàn)圖6)。

圖4 差異基因蛋白互作網(wǎng)絡(luò)

圖5 模塊1的42個(gè)基因(得分40.39,42個(gè)節(jié)點(diǎn),828條線)
3 討論
本研究通過(guò)從GEO數(shù)據(jù)庫(kù)里獲取乳腺浸潤(rùn)性導(dǎo)管癌(IDC)組織與正常乳腺組織的基因表達(dá)芯片數(shù)據(jù),對(duì)二者的差異基因(DEGs)進(jìn)行分析,篩選出得分最高的模塊1,主要參與核有絲分裂及調(diào)控、紡錘體、減數(shù)分裂細(xì)胞周期過(guò)程、細(xì)胞中間體、促進(jìn)后期復(fù)雜依賴(lài)的分解代謝過(guò)程和微管細(xì)胞骨架組織參與有絲分裂等生物過(guò)程。參與細(xì)胞周期、卵母細(xì)胞減數(shù)分裂和p53信號(hào)通路等信號(hào)通路。最終篩選出HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55等10個(gè)高表達(dá)與乳腺癌不利總體生存相關(guān)的樞紐基因。透明質(zhì)酸介導(dǎo)的運(yùn)動(dòng)受體(HMMR)是一種以透明質(zhì)酸(HA)為底物與微管蛋白相互作用的多功能細(xì)胞外蛋白,HMMR具有調(diào)節(jié)細(xì)胞運(yùn)動(dòng),干擾細(xì)胞有絲分裂,促進(jìn)血管生成等作用[6],其表達(dá)水平與結(jié)膀胱癌[7]、胃癌[8]等癌癥的潛在不良預(yù)后有關(guān)。同時(shí)HMMR具有抗腫瘤作用,為結(jié)直腸癌等癌癥提供抗原表位,有望成為免疫治療的靶點(diǎn)[9]。而HMMR與乳腺癌關(guān)系的研究目前較少,Liu等[10]的研究發(fā)現(xiàn)HMMR-AS可以抑制Basal-like型乳腺癌細(xì)胞的增殖和轉(zhuǎn)移,有可能成為其潛在治療靶點(diǎn)。Liu等[11]研究發(fā)現(xiàn)抑制細(xì)胞周期蛋白依賴(lài)性激酶1(CDK1)能夠抑制三陰性乳腺癌的腫瘤生長(zhǎng)和誘導(dǎo)凋亡。Tonnessen-Murray C[12]、Li Jie[13]認(rèn)為CDK1、人細(xì)胞周期蛋白B2(CCNB2)可能通過(guò)調(diào)節(jié)G2/M轉(zhuǎn)換參與乳腺癌的發(fā)生過(guò)程。CCNB2[13]、CDK1[14]的高表達(dá)與乳腺癌惡性程度成正相關(guān)。研究認(rèn)為[15]在乳腺癌中絲氨酸/蘇氨酸激酶Akt(PKB)通過(guò)PI3K/PKB信號(hào)通路調(diào)節(jié)癌細(xì)胞浸潤(rùn)和轉(zhuǎn)移,通過(guò)抑制此通路可誘導(dǎo)細(xì)胞凋亡,因此成為近年來(lái)乳腺癌分子靶向治療研究熱點(diǎn)。TPX2參與細(xì)胞有絲分裂紡錘體微管形成過(guò)程,Yang等[16-17]的研究發(fā)現(xiàn)TPX2在乳腺癌中明顯高表達(dá),促進(jìn)乳腺癌細(xì)胞增殖、遷移和侵襲。高水平TPX2與三陰性乳腺治療后總生存期(OS)相關(guān)[18]。有絲分裂極光激酶(AURKA)促進(jìn)G2/M事件,且AURKA通過(guò)增強(qiáng)乳腺癌干細(xì)胞(BCSC)表型,在惡性細(xì)胞中引起明顯的致癌特性[19]。核仁和紡錘體相關(guān)蛋白1(NUSAP1)可通過(guò)調(diào)節(jié)AURKA影響乳腺癌細(xì)胞的增殖、轉(zhuǎn)移,下調(diào)NUSAP1可增強(qiáng)乳腺癌對(duì)表阿霉素的敏感性[20]。XU[21]、Yang[22]認(rèn)為乳腺癌患者TOP2A的低表達(dá)較高表達(dá)有更好的無(wú)病生存期(DFS)和總生存期(OS)。在HER-2陽(yáng)性乳腺癌患者中,TOP2A若擴(kuò)增,采用蒽環(huán)類(lèi)藥物進(jìn)行新輔助化療可能改善預(yù)后[23]。中心體相關(guān)蛋白(CEP55)是細(xì)胞有絲分裂的關(guān)鍵調(diào)控因子,其過(guò)表達(dá)與基因組不穩(wěn)定相關(guān)[24]。在小鼠實(shí)驗(yàn)中,MiR-144通過(guò)抑制CEP55抑制乳腺癌細(xì)胞的侵襲和轉(zhuǎn)移[25]。目前CEP55與乳腺癌相關(guān)臨床研究較少,在本研究中CEP55在IDC中高表達(dá),且與乳腺癌OS不良結(jié)果相關(guān)。
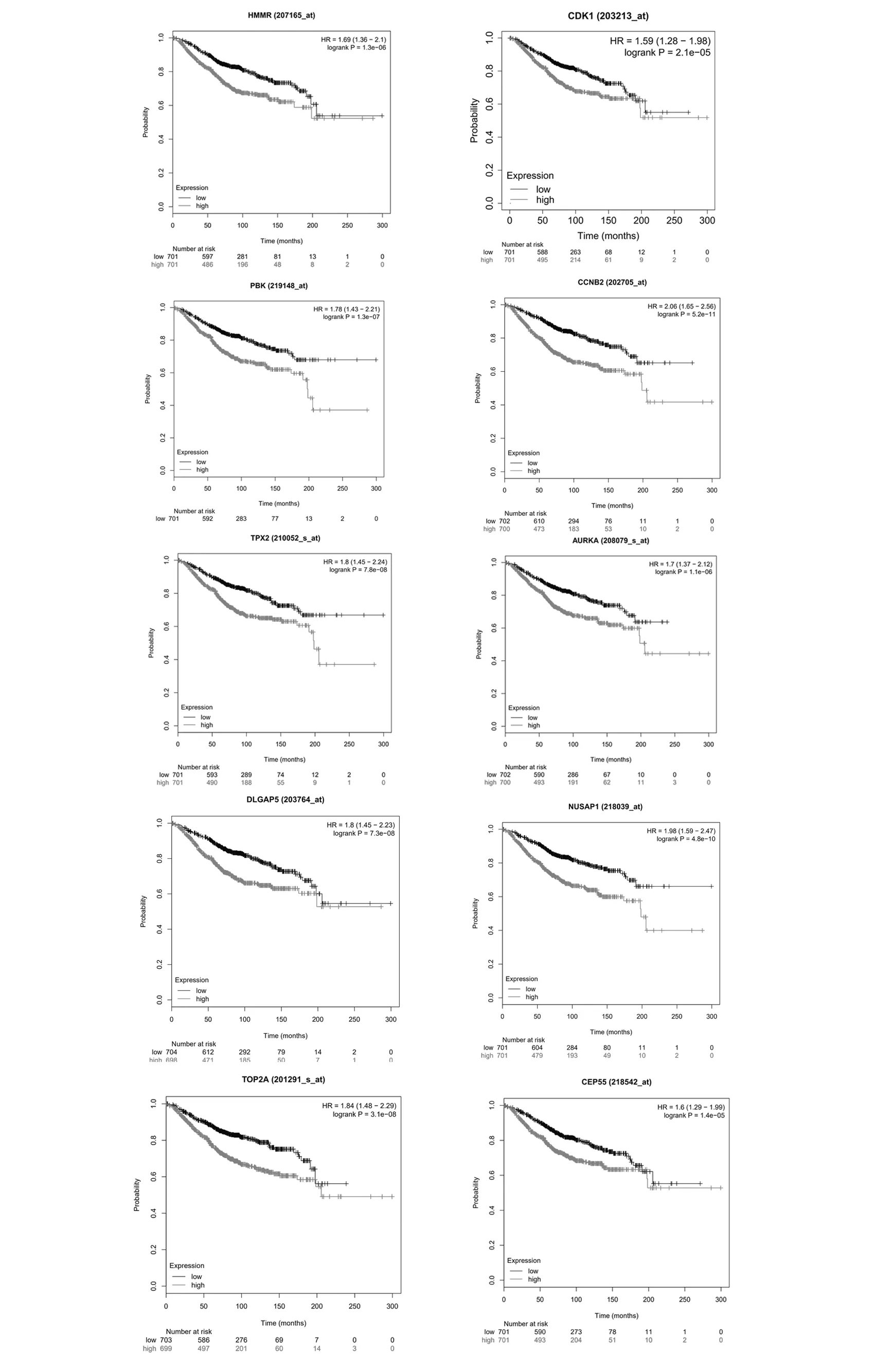
圖6 HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55表達(dá)與乳腺癌患者生存的關(guān)系
綜上所述,通過(guò)GEO芯片數(shù)據(jù)庫(kù)進(jìn)行基因差異分析,我們發(fā)現(xiàn)HMMR、CDK1、PBK、CCNB2、TPX2、AURKA、DLGAP5、NUSAP1、TOP2A和CEP55等10個(gè)樞紐基因,樞紐基因過(guò)表達(dá)均與乳腺癌患者總體生存差相關(guān)。因此,通過(guò)差異分析有助于發(fā)現(xiàn)乳腺癌潛在發(fā)病基因和發(fā)病機(jī)制,這些樞紐基因可能成為乳腺癌的預(yù)后生物標(biāo)志物和潛在治療靶點(diǎn),但仍有待于大量前瞻性臨床研究和實(shí)驗(yàn)驗(yàn)證。
- 實(shí)用癌癥雜志的其它文章
- 心臟粘液瘤栓塞事件發(fā)生與患者心功能及肺動(dòng)脈壓的相關(guān)性
- 甲磺酸伊馬替尼聯(lián)合VDLD化療方案治療急性淋巴細(xì)胞白血病患兒的療效及對(duì)T細(xì)胞免疫功能的影響
- 電凝鉤用于胸腔鏡下前縱隔腫瘤手術(shù)對(duì)手術(shù)時(shí)間和術(shù)后患者恢復(fù)速度的影響
- 老年NSCLC放化療患者醫(yī)院感染致病菌的耐藥性篩查及對(duì)策研究
- 七氟烷聯(lián)合丙泊酚用于胸腔鏡非小細(xì)胞肺癌切除術(shù)對(duì)術(shù)后患者炎性與氧化、抗氧化狀態(tài)的影響
- 直徑≤3 cm浸潤(rùn)性肺腺癌脈管侵犯的危險(xiǎn)因素分析

