B7H3、B7H4在上皮性卵巢癌組織及血清中的表達及其臨床意義
張麗靜 薛惠英 胡 捷
卵巢癌作為女性最常見的惡性腫瘤之一,5年生存率僅40%,尋找有效可靠的生物標志物對該病的病情及預后進行判斷具有重要的臨床價值[1-2]。B7H3、B7H4蛋白均屬于B7蛋白超家族成員,在免疫系統中可通過抑制T細胞或巨噬細胞功能參與抗腫瘤免疫反應,影響腫瘤的增殖及免疫調控過程。在肺癌、乳腺癌等實體腫瘤中,B7H3、B7H4蛋白已被證明對腫瘤的病理分期及預后具有一定的判斷價值[3-4]。在卵巢癌的免疫治療中,同屬B7超蛋白家族成員的程序性死亡受體-1(Programmed death receptor-1,PD-1)的單克隆抗體已被美國食品藥品管理局(FDA)批準用于包括卵巢癌在內的實體腫瘤的治療,取得了良好的效果[5]。本研究通過對卵巢上皮癌組織中B7H3、B7H4蛋白表達改變進行研究,旨在為該病的生物標志物發掘及免疫靶向治療藥物開發提供有價值的研究基礎,現報告如下。
1 材料與方法
1.1 研究對象
選擇本院婦產科2018年3月至2020年3月收治上皮性卵巢癌患者106例作為研究對象,納入研究組。納入標準:①均經病理檢查診斷明確為上皮性卵巢癌,符合《卵巢癌診療規范(2018年版)》[6];②同意接受病理檢查;③臨床資料完整。排除標準:①合并其它惡性腫瘤者;②合并慢性感染性疾病者;③入院前接受過放化療、靶向治療者;④治療中途轉院者。選擇同期醫院收治的卵巢良性患者50例作為對照組,收集其卵巢組織,研究組年齡32~75歲,平均年齡(53.18±5.24)歲,絕經前34例,絕經后72例,對照組年齡33~71歲,平均(52.29±4.94)歲,絕經前29例,絕經后43例,兩組患者年齡、絕經狀態比較差異無統計學意義。本研究納入對象均簽署對研究的知情同意書并經醫院醫學倫理委員會審核通過。
1.2 卵巢癌組織B7H3、B7H4檢測
將本院病理科收集的組織蠟塊只做為組織切片,經DAB免疫染色、恒溫烘烤、二甲苯脫蠟及梯度乙醇脫水等步驟后,加入一抗進行孵育,孵育完成后將倍比稀釋的B7H3及B7H4抗體加入組織切片表面,4 ℃孵育過夜后,采用PBS洗滌,二抗再次孵育完成后加入DAB顯色液進行脫水顯色、封片,所用抗體購自北京中杉金橋公司。由兩名病理科醫師進行獨立盲法結果判定:根據切片的陽性細胞比例及著色深度進行計分,以半定量法統計結果,視野下陽性細胞百分率判定:0分:>5%,1分:5%~25%,2分:26%~50%,3分:51%~75%,4分:>75%。陽性細胞著色深度判定:0分:無色或與背景色重疊,1分:淺棕黃色,2分:棕黃色,3分:棕褐色,將細胞陽性百分率判定得分與著色深度判定得分相乘結果為免疫組化染色評分。
1.3 血清中可溶性B7H3、B7H4檢測
患者在入院后抽取其外周靜脈血2 ml,常規離心分離血清后,采用酶聯免疫吸附法檢測血清中可溶性B7H3、B7H4蛋白水平,試劑盒購自上海酶聯生物有限公司,均按照試劑盒說明書中操作。
1.4 統計學分析
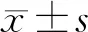
2 結果
2.1 不同卵巢癌患者病灶組織及血清中B7H3、B7H4蛋白表達水平比較
上皮性卵巢癌患者病灶組織、血清中B7H3、B7H4水平均高于卵巢良性腫瘤患者,差異具有統計學意義(P<0.05),見表1。

表1 不同卵巢癌患者病灶組織及血清中B7H3、B7H4蛋白表達水平比較
2.2 上皮性卵巢癌病灶組織中B7H3、B7H4蛋白表達水平與臨床病理特征的相關性
上皮性卵巢癌患者病灶組織中B7H3、B7H4表達水平與FIGO分期、腫瘤大小、淋巴結轉移有關,差異具有統計學意義(P<0.05),與年齡、組織學類型、腹腔積液無關,差異無統計學意義(P>0.05),見表2。
2.3 上皮性卵巢癌血清中B7H3、B7H4蛋白表達水平與臨床病理特征的相關性
上皮性卵巢癌患者病灶血清中B7H3、B7H4表達水平與FIGO分期、腫瘤大小、淋巴結轉移有關,差異具有統計學意義(P<0.05),與年齡、組織學類型、腹腔積液無關,差異無統計學意義(P>0.05),見表2。
3 討論
據研究統計我國每10萬人中有5人患有卵巢癌,每年新發死亡病例超過15萬例,對女性健康具有較大的危害性[7]。根據病理學分型,卵巢癌可分為上皮性卵巢癌和非上皮性卵巢癌兩種,其中上皮性卵巢癌(epithelial ovarian cancer,EOC)是卵巢癌最常見的病理類型,占比超過90%,其組織學類型又可進一步分為漿液性癌、黏液性癌、子宮內膜樣癌及透明細胞癌型[1,8]。早期卵巢癌5年生存率較高,最高可達90%,由于卵巢癌在疾病初期癥狀缺乏特異性,待其侵犯至盆腔后,才會出現明顯的癥狀,因此在發現疾病時多已處于晚期階段,即便治療技術不斷發展,其5年生存率也沒有明顯的提高[9]。目前臨床中可用于卵巢癌早期診斷的生物標志物相對較少,特異性不足,因此需發掘可靠的生物標志物為患者的早期診治提供依據。

表2 上皮性卵巢癌病灶組織中B7H3、B7H4蛋白表達水平與臨床病理特征的相關性

表3 上皮性卵巢癌血清中B7H3、B7H4蛋白表達水平與臨床病理特征的相關性
以負性共刺激為代表的免疫療法近年來在各種惡性腫瘤的臨床治療中受到廣泛關注,在腫瘤組織中負性共刺激分子可通過抑制腫瘤特異性免疫應答而維持免疫耐受功能,最終逃脫T淋巴細胞的免疫殺傷作用[10-11]。B7家族蛋白中B7H3、B7H4蛋白主要發揮負性調控作用,其中B7H3可抑制T淋巴細胞活化而對下游輔助型T細胞1/輔助型T細胞2及輔助型T細胞17/調節型T細胞的功能產生影響,而B7H4蛋白可對T細胞的增殖產生負反饋調節作用,過表達B7H4蛋白可導致腫瘤相關因子逃逸而造成腫瘤的進展。B7H3、B7H4在乳腺癌、前列腺癌、宮頸癌等疾病中的臨床價值已有文獻報道,但在卵巢癌中報道相對較少[12-13]。本研究首先通過免疫組化法檢測了上皮性卵巢癌及良性卵巢癌組織中B7H3、B7H4的表達水平,結果顯示,上皮性卵巢癌組織中B7H3、B7H4的表達水平水平明顯增加,因此B7H3、B7H4可能參加了惡性卵巢癌的發生過程,與國外學者報道[14]一致。血清中表達的B7H3、B7H4是二蛋白的可溶性形式,為該蛋白全長序列的胞外段形式,呂鑫等[15]研究結果顯示,可溶性B7H3在繼發性嗜血細胞型淋巴組織增多癥患者血清中表達增加,且與疾病進展及不良預后有關。陳欣然等[16]研究結果表明,可溶性B7H4濃度隨食管癌癌前病變的程度增加而提高,對于食管癌癌前病變具有良好的判斷價值。本研究結果顯示,血清中B7H3、B7H4水平明顯高于良性卵巢腫瘤患者,考慮到經濟性的問題,檢測血清中B7H3、B7H4水平對于判斷良、惡性卵巢腫瘤具有一定價值。本研究進一步探討了上皮性卵巢組織及血清中B7H3、B7H4蛋白水平與臨床病理特征的相關性,結果表明,在卵巢組織及血清中,B7H3、B7H4蛋白均與FIGO分期、腫瘤大小、淋巴結轉移有關,說明B7H3、B7H4在腫瘤免疫微環境中可能參與了上皮性卵巢癌的發生、發展進程,對于判斷疾病分期及轉移情況具有一定的意義。
動物研究發現,利用單克隆抗體技術阻斷B7H3、B7H4的表達可有效抑制部分實體腫瘤的生長進程,因此B7H3、B7H4作為上皮性卵巢癌免疫靶向治療的靶點也具有一定的潛力[17]。本研究結果受限于病例數較少,且隨訪年限較短,未對不同B7H3、B7H4蛋白表達水平上皮性卵巢癌患者預后做進一步的分析,本研究的結論及后續的機制研究有待更多體內、體外實驗的進一步檢驗。

