MiR-125b在甲狀腺癌患者中的表達及其意義
姚彩云 馮 蕾 范震霆
甲狀腺癌占內分泌惡性腫瘤的90%,嚴重危害患者的健康。近年來,雖然手術已成為治療甲狀腺癌的有效手段,但仍有患者反復發作[1]。微小RNA(miRNA)是長度約22 nt的內源性單鏈非編碼RNA,其在細胞增殖、粘附和分化等多種生物過程中起重要作用。據估計,miRNAs可靶向超過1/3的人類基因[2]。越來越多的證據表明,大量miRNAs可能參與了癌癥過程,一些miRNAs的過表達可能抑制腫瘤基因的表達,相反另一些miRNAs的下調則可能會導致腫瘤發展[3]。例如,miR-146、miR-221和miR-222在甲狀腺腫瘤組織中表達增加11至19倍,與甲狀腺外侵襲或癌癥的發生有關[4]。 miR-218-2及其宿主基因SLIT3的下調可促進甲狀腺癌的侵襲和進展[5]。之前的研究報道miR-125b可通過靶向PIK3CD來抑制甲狀腺未分化癌細胞的遷移和侵襲[6]。然而,miR-125b與順鉑(用于治療對放射性碘無反應的甲狀腺癌)間的相互作用及機制還尚未完全闡明。本研究旨在探討miR-125b在經超聲診斷的甲狀腺癌患者中的表達及其對甲狀腺癌順鉑敏感性的影響及機制。
1 材料與方法
1.1 甲狀腺癌組織采集
選取2017年7月至2019年2月陜西省康復醫院病理科采集并保存的甲狀腺乳頭狀癌組織及其配對的癌旁組織各20例。所有患者均經陜西省康復醫院影像科二維超聲多切面探查甲狀腺病灶的部位、數目、大小、邊界、內部回聲、鈣化、后方回聲及頸部淋巴結腫大等情況,彩色多普勒超聲觀察腫瘤內部和周圍血管分布。超聲表現疑似甲狀腺乳頭狀癌后,在超聲引導下穿刺活檢,經病理確診。外科手術切除甲狀腺癌組織及鄰近的癌旁組織,送至病理科于-80 ℃儲存至實時熒光定量PCR檢測。
1.2 細胞培養及分組
人甲狀腺乳頭狀癌細胞系MDA-T32購自美國ATCC公司,將細胞接種于含有10%胎牛血清的DMEM培養基中,置于37 ℃、5% CO2飽和濕度環境中常規培養、傳代。取對數生長期的細胞經消化后按5×103個細胞/孔的密度接種于6孔板,將細胞分為3組:對照組、陰性對照組和miR-125b組,每組各4孔。常規培養至細胞匯合度達到85%以上時,進行細胞轉染。
1.3 細胞轉染
對照組不處理,陰性對照組采用脂質體3000轉染無義序列,miR-125b組采用脂質體3000轉染miR-125b mimics,嚴格按照說明書操作。miR-125b mimic序列為:上游:5'-UCCCUGAGACCCUAACUUGUGA-3',下游:5'-ACAAGUUAGGGUCUCAGGGAUU-3'。miR-125b mimic序列由上海生工公司設計及合成,脂質體3000購自大連Takara公司。采用實時熒光定量PCR檢測轉染效果。
1.4 實時熒光定量PCR
采用RNeasy Mini試劑盒從組織樣本及轉染48 h后的細胞中提取總RNA,以RNA為模板采用NCode miRNA First-Stand cDNA Synthesis Kit試劑盒反轉錄合成第一鏈cDNA。實時熒光定量PCR擴增的反應體系(10 μl)為:1 μl cDNA、1 μl 2.5 μmol上下游引物混合物、5 μl SYBR Green qPCR SuperMix和3 μl雙蒸水。根據2-△△Ct計算目的基因的相對表達量。U6為內參。
1.5 順鉑敏感性分析
采用MTT法檢測各組細胞對順鉑的敏感性。將轉染48 h后的細胞重新以5×103個細胞/孔的密度接種于96孔板中,每孔100 μl。設只含有培養基的空白對照。采用0、15、30、60、120 μg/ml 的順鉑干預48 h,換液,每孔加入30 μl MTT試劑,孵育4 h后棄去培養基,加入100 μl DMSO,在酶標儀上于570 nm處讀取吸光值(A)。細胞活性(%)= (A測試孔-A空白孔)/ A空白孔×100%。
1.6 Western Blot
采用RIPA試劑從組織樣本及轉染48 h后的細胞中提取總RNA,蛋白定量用BCA試劑盒。將20 μg的總蛋白加入上樣緩沖液中,用10% SDS-PAGE凝膠分離總蛋白,之后將總蛋白轉染至PVDF膜上,用5%胎牛血清封閉45 min,孵育一抗,4 ℃孵育過夜,孵育二抗,室溫搖床孵育1 h,采用電化學發光試劑ECL于暗室發光。用Image J軟件統計分析目的條帶。內參為GAPDH。
1.7 統計學分析
2 結果
2.1 MiR-125b在甲狀腺癌組織及甲狀腺癌細胞系中的表達
與癌旁組織[(0.81±0.13)%]對比,甲狀腺癌組織中miR-125b mRNA的表達[(0.35±0.07)%]顯著降低(t=13.722,P<0.05)。與對照組[(0.65±0.11)%]相比,miR-125b組細胞中miR-125b mRNA的表達[(1.49±0.24)%]顯著增加(t=29.557,P<0.05),陰性對照組miR-125b mRNA的表達[(0.68±0.15)%]無顯著變化。
2.2 MiR-125b對甲狀腺癌中Foxp3的影響
應用Targetscan軟件(www.targetscan.org/vert_72/)預測,發現miR-125b可與Foxp3 3’UTR的519-525位點結合。如表1所示,與癌旁組織對比,甲狀腺癌組織中Foxp3蛋白表達顯著增加(P<0.05)。與對照組相比,miR-125b組細胞中Foxp3蛋白表達顯著降低(P<0.05),陰性對照組Foxp3蛋白表達無顯著變化(P>0.05)。

表1 各組Foxp3蛋白表達的對比
2.3 MiR-125b過表達對甲狀腺癌順鉑敏感性的影響
如圖1所示,與對照組相比,在順鉑濃度為30 μg/ml時,miR-125b組細胞活性顯著降低(P<0.05)。在順鉑濃度為0、15、60、120 μg/ml時,各組間細胞活性的對比無顯著差異。
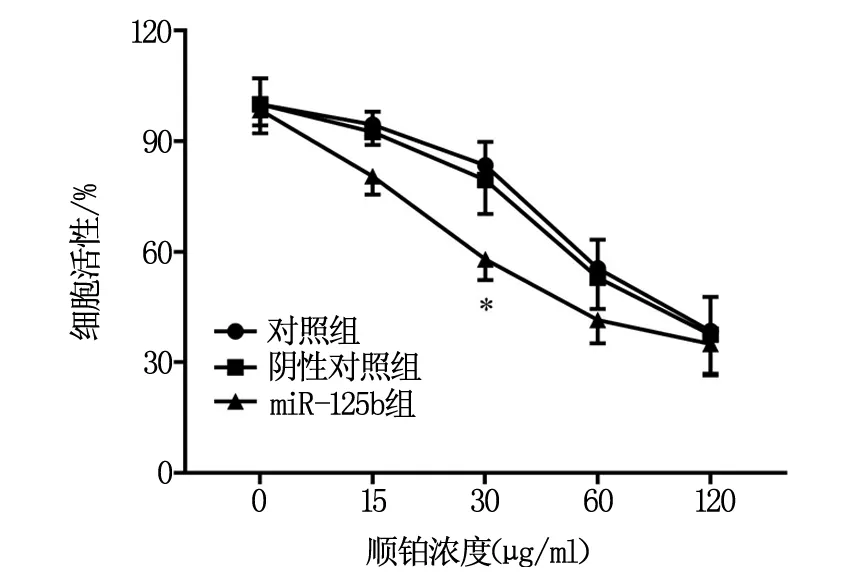
圖1 各組細胞對順鉑的敏感性對比
2.4 MiR-125b對甲狀腺癌中自噬的影響
如表2所示,與癌旁組織對比,甲狀腺癌組織中LC 3I蛋白的表達無顯著變化,而LC 3II蛋白的表達顯著增加(P<0.05)。與對照組相比,miR-125b組細胞中LC 3II蛋白的表達顯著降低(P<0.05),陰性對照組LC 3II蛋白的表達無顯著變化。各組細胞中LC 3I蛋白的表達對比無顯著差異(P>0.05)。

表2 各組織中LC 3Ⅰ和LC 3Ⅱ蛋白表達比較
3 討論
miR-125b首次是在急性淋巴細胞白血病和骨髓增生異常中發現的,在細胞分化、增殖和凋亡中起重要作用。Klusmann等發現miR-125b可以降低MUC1癌蛋白的表達,促進白血病中DNA損傷劑誘導的細胞凋亡[7],提示miR-125b可能作為腫瘤抑制性miRNA發揮作用。研究表明,由于miR-125b下調可促進腫瘤細胞的遷移和增殖,因此其也可作為膽囊癌和結直腸癌的腫瘤抑制因子[8-9]。僅有少量幾篇關于miR-125b和甲狀腺癌的報道,大都是在甲狀腺未分化癌(ATC)中,雖然我們沒有ATC的甲狀腺組織樣本來證實這一發現(一部分原因是因為ATC是罕見腫瘤,另一部分原因是因為ATC通常不能手術,因此很少被切除),但這些報道均顯示miR-125b在ATC中表達降低[10]。而本研究在甲狀腺乳頭狀癌組織中也得到了類似的結果,與癌旁組織對比,甲狀腺癌組織中miR-125b mRNA的表達顯著降低,表明miR-125b在甲狀腺乳頭狀癌中可能起腫瘤抑制因子的作用。
越來越多的研究表明Foxp3是調節性T細胞的典型生物標志物,可在包括甲狀腺癌細胞等多種實體腫瘤細胞中表達[11]。但是誘導癌細胞中Foxp3表達的機制仍然未能徹底闡明。本研究中,我們通過對比Foxp3蛋白在甲狀腺癌組織及癌旁組織中的表達發現,與癌旁組織對比,甲狀腺癌組織中Foxp3蛋白的表達顯著增加,提示Foxp3蛋白在甲狀腺乳頭狀癌中可能是腫瘤促進蛋白,似乎與miR-125b的作用相反。因此我們推測miR-125b可能直接靶向Foxp3基因并調控其表達,為了驗證這一推測,首先我們采用生物信息學Targetscan軟件預測發現miR-125b可與Foxp3 3’UTR的519-525位點結合。接下來我們將miR-125b mimics轉染入人甲狀腺乳頭狀癌細胞系中,檢測miR-125b過表達對Foxp3蛋白的影響,結果顯示,與對照組相比,miR-125b組細胞中Foxp3蛋白的表達顯著降低,結合生物信息學的結果預測可證實我們之前的推測,miR-125b可直接靶向Foxp3 3’UTR的519-525位點結合,并抑制Foxp3蛋白的表達。
近期的研究表明Foxp3與膀胱癌的順鉑耐藥有關[12]。為了確定在甲狀腺癌中miR-125b下調和Foxp3上調的治療意義,首先,我們進行了miR-125b對甲狀腺癌細胞順鉑敏感性的實驗。細胞增殖結果顯示,與對照組相比,在順鉑濃度為30 μg/ml時,miR-125b組細胞活性顯著降低。而在順鉑濃度為0、15、60、120 μg/ml時,各組間細胞活性的對比無顯著差異。這些結果提示miR-125b過表達可顯著增強化療藥順鉑在甲狀腺癌細胞中的效力。其次,對于自噬的研究也顯示,與癌旁組織對比,甲狀腺癌組織中LC 3II蛋白的表達顯著增加。與對照組相比,miR-125b組細胞中LC 3II蛋白的表達顯著降低。LC 3II是哺乳動物自噬標記蛋白,是觀察自噬激活公認的生物學標記物[13]。這些結果表明,在甲狀腺癌組織中細胞自噬的活性增加,而miR-125b過表達可抑制甲狀腺癌中自噬的激活。因此miR-125b抑制自噬活性可能是其增強甲狀腺癌細胞對順鉑敏感性的原因之一。自噬不僅參與維持細胞自我穩態,還與腫瘤的發生發展及腫瘤耐藥密切相關[14]。研究表明,miR-9可通過抑制自噬增強非小細胞肺癌A549細胞對順鉑的敏感性[15]。因此miR-125b抑制自噬活性是其增加甲狀腺癌細胞對順鉑敏感性的機制之一。
總之,本研究揭示了miR-125b在甲狀腺癌中下調,miR-125b介導的Foxp3下調可抑制自噬,并增強甲狀腺癌細胞對順鉑的敏感性,這表明miR-125b在甲狀腺癌化療中具有治療意義。

