miR-3122靶向CMTM5調控口腔鱗癌細胞GNM凋亡的分子機制
劉一鵬 喬永明 朱保玉 王海業 耿玉東 張月蘭
口腔鱗狀細胞癌(OSCC)是全球常見的高度致死性癌癥,這歸因于其復發和轉移[1]。盡管已觀察到OSCC的治療持續改善,但患者的存活率并未顯著提高[2]。為了提高口腔癌患者的生存率,重要的是了解口腔腫瘤發生的分子機制。Manikandan M等[3]通過高通量測序描繪了OSCC的miRNA表達譜,發現了許多表達異常的miRNA,包括miR-29b,miR-142-3p,miR-144,miR-3122。然而,miR-3122在OSCC中的生物學功能尚不明確。基于此,本研究以口腔鱗癌細胞GNM為研究對象,旨在探討miR-3122靶向CMTM5調控口腔鱗癌細胞GNM凋亡的分子機制。
1 材料與方法
1.1 材料
口腔鱗癌細胞GNM購自廣州一科生物科技有限公司(貨號:CL-0086)。GCSAM,PSMC4,SKP1,LIAS,SMAD2,ZNF704,CMTM5,STK17A,YWHAQ的siRNA、CMTM5過表達質粒、miR-3122 mimics和miR-3122 inhibitor均由天津擎科合成。CMTM5抗體購自上海群己生物科技有限公司(貨號:H00116173-B01)。GAPDH抗體購自武漢市武昌區科邁實驗用品經營部(貨號:KF703)。Annexin V-PE凋亡檢測試劑盒購自廣州威佳科技有限公司(貨號:C1065L)。TRIzol試劑購自生工生物工程(上海)股份有限公司(貨號:B610409-0100)。pEZX-MT01質粒購自BioVector質粒載體菌種細胞基因保藏中心(貨號:pEZX-MT01)。熒光素酶標記試劑盒購自廣州一科生物科技有限公司(貨號:A1001-8)。BCA蛋白定量試劑盒購自北京邁瑞達科技有限公司(貨號:M052460-500T)。Lipofectamine?2000購自廣州泰勒生物科技有限公司(貨號:11668-019)。青鏈霉素混合液(100×)購自上海億言生物科技有限公司(貨號:SL6040-100ml)。第一鏈cDNA合成試劑盒購自北京蘭博利德商貿有限公司(貨號:C1802)。
1.2 方法
1.2.1 細胞培養與轉染 口腔鱗癌細胞GNM在DMEM培養基中培養,添加10%胎牛血清,青霉素100 U/ml,鏈霉素0.1 mg/ml,37 ℃,100%空氣。GNM細胞以2×105/孔的密度接種于6孔板,用于轉染。使用Lipofectamine?2000進行GCSAM,PSMC4,SKP1,LIAS,SMAD2,ZNF704,CMTM5,STK17A,YWHAQ的siRNA、CMTM5過表達質粒、miR-3122 mimics和miR-3122 inhibitor的轉染。轉染后48 h進行下游實驗。
1.2.2 RNA抽取與實時熒光定量PCR 納入2018年6月至2020年6月我院收治的口腔鱗癌患者60例,收集此60例患者的口腔鱗癌組織和癌旁組織。采用qRT-PCR檢測基因表達。使用TRIzol試劑提取組織或細胞的總RNA,并使用第一鏈cDNA合成試劑盒根據生產協議進行逆轉錄。在ABI 7500系統上進行qRT-PCR,條件為:95 ℃ 30 s;95 ℃ 5 s(40次循環);60 ℃ 30 s,72 ℃ 15 s。以GAPDH為內參對照,計算基因的相對表達量。每個樣本檢測3次。
1.2.3 免疫印跡 收集細胞裂解液后,用BCA蛋白檢測試劑盒檢測蛋白濃度。等數量的蛋白用10% sds-聚丙烯酰胺凝膠分離電泳,然后轉移到聚偏二氟乙烯(PVDF)膜上。用5%脫脂牛奶封閉后,以抗GINS2抗體為一抗,抗GAPDH抗體為內參,4 ℃孵育過夜。隨后,膜與適當的二抗孵育在室溫下1 h。用化學發光基質試劑盒對信號進行成像,用凝膠成像系統檢測。Western blotting實驗進行了3個重復。
1.2.4 熒光素酶報告實驗 熒光素酶報告質粒pEZX-MT01包含CMTM5的野生型或突變型3'UTR。使用熒光素酶報告基因系統分析熒光素酶活性前,將miR-3122 mimic或陰性對照(NC)和熒光素酶報告基因共轉染至口腔鱗癌細胞GNM。
1.2.5 細胞凋亡水平的檢測 根據制造商的說明,使用Annexin V-PE凋亡檢測試劑盒對不同處理的細胞進行凋亡分析。簡而言之,經過不同處理后,收集在6孔板上生長的漂浮口腔鱗癌細胞GNM和胰蛋白酶分離的細胞,并用冷的1×PBS洗滌。然后將細胞沉淀物用結合緩沖液重懸,并根據試劑盒方案用Annexin-V染色。熒光顯微鏡觀察。將實驗組中凋亡細胞的百分比與對照轉染組進行比較。所有樣品一式三份測量。
1.3 統計學分析

2 結果
2.1 miR-3122在口腔鱗癌組織和癌旁組織中的表達
收集60例口腔鱗癌組織和癌旁組織后,通過RNA抽取和實時熒光定量PCR發現,miR-3122在癌旁組織中的表達水平高于口腔鱗癌組織(P<0.05),見圖1。
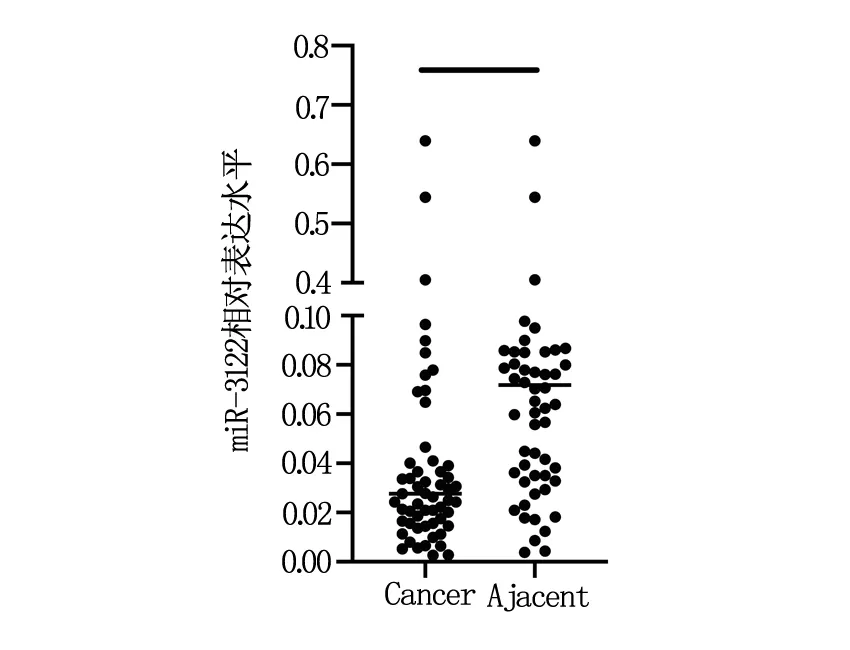
圖1 miR-3122在口腔鱗癌組織和癌旁組織中的表達
2.2 miR-3122促進口腔鱗癌細胞GNM的凋亡
使用miR-3122 mimics過表達miR-3122后,口腔鱗癌細胞GNM的凋亡水平上升(P<0.05),而使用miR-3122 inhibitor敲低miR-3122后,口腔鱗癌細胞GNM的凋亡水平下降(P<0.05),見圖2。
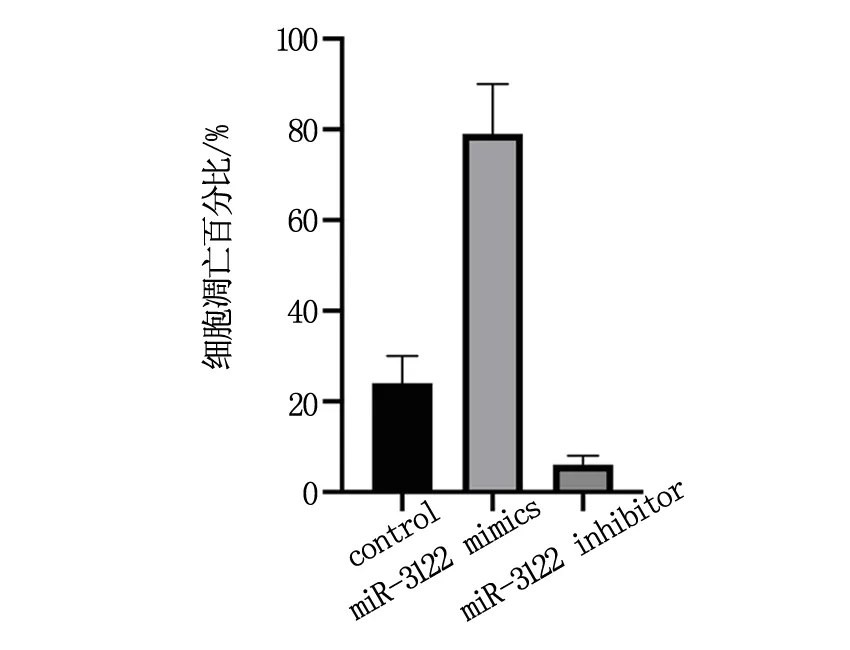
圖2 miR-3122對口腔鱗癌細胞GNM凋亡的影響
2.3 miR-3122靶向CMTM5的3端非編碼區
TargetScan、miRcode、miRDB在線分析發現miR-3122分別潛在靶向69、82、184個基因,通過取三者交集發現miR-3122共同潛在靶向22個基因,見圖3A。使用miR-3122 mimics過表達miR-3122后,口腔鱗癌細胞GNM中GCSAM,PSMC4,SKP1,LIAS,SMAD2,ZNF704,CMTM5,STK17A,YWHAQ的表達水平下降(P<0.05),見圖3B。使用siRNA敲低口腔鱗癌細胞GNM中上述基因后,發現敲低CMTM5后口腔鱗癌細胞GNM的凋亡水平上升(P<0.05),見圖3C。通過熒光素酶報告實驗發現miR-3122靶向CMTM5的3端非編碼區(P<0.05),見圖4A。同時,過表達miR-3122后,CMTM5的mRNA水平和蛋白水平均下降(P<0.05),而敲低miR-3122后,CMTM5的mRNA水平和蛋白水平均上升(P<0.05),見圖4B,圖4C和圖4D。
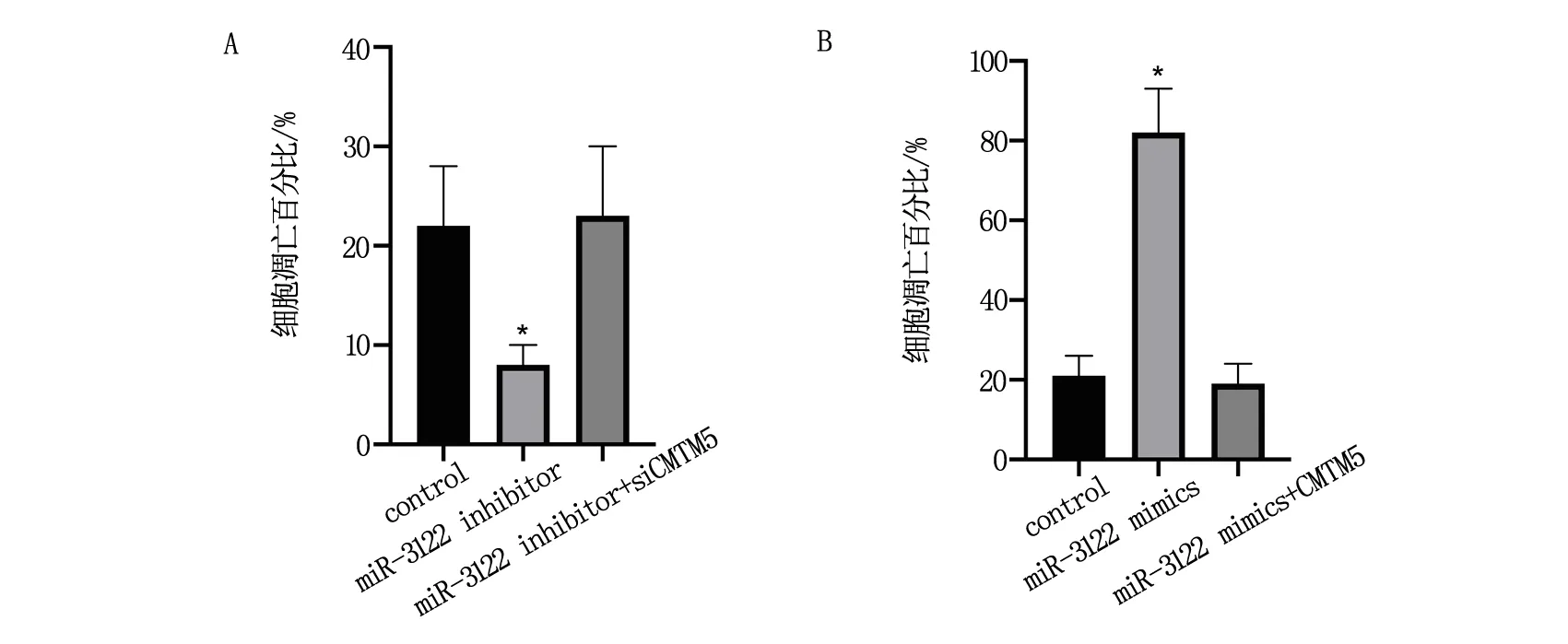
2.4 miR-3122靶向CMTM5調控口腔鱗癌細胞GNM凋亡
同時敲低miR-3122和CMTM5時,口腔鱗癌細胞GNM凋亡水平無顯著變化(P<0.05),見圖5A;同時過表達miR-3122和CMTM5時,口腔鱗癌細胞GNM凋亡水平無顯著變化(P<0.05),見圖5B。
3 討論
口腔癌的腫瘤分布廣泛,包括嘴唇、硬腭、上、下牙槽嵴、舌前三分之二、舌下、頰黏膜、臼齒后三角區和口底[4]。2012年,OSCC在全世界造成14.5萬人死亡[5]。OSCC的發展阻礙了多模式治療的成功,導致預后不良和5年生存率低[6]。因此,研究OSCC的發生發展的分子機制對治療OSCC是必不可少的。
在本研究中,miR-3122在癌旁組織中的表達水平高于口腔鱗癌組織(P<0.05)。過表達miR-3122后,口腔鱗癌細胞GNM的凋亡水平上升(P<0.05),而敲低miR-3122后,口腔鱗癌細胞GNM的凋亡水平下降(P<0.05)。提示miR-3122是一個潛在的抑制腫瘤發生發展的分子。
MicroRNAs(miRNAs)是一種短(19-25nt)單鏈非編碼RNA,通常與目標mRNA的3端非編碼區中的互補序列結合,并通過隨后招募RNA誘導的沉默復合物來抑制其翻譯[7]。由于大于30%的人類基因被預測受到miRNAs的調控,這些miRNA控制著所有的細胞的生理和發育過程[8]。TargetScan,miRcode,miRDB在線分析發現miR-3122分別潛在靶向69,82,184個基因,三者交集為22個基因。過表達miR-3122后,口腔鱗癌細胞GNM中GCSAM,PSMC4,SKP1,LIAS,SMAD2,ZNF704,CMTM5,STK17A,YWHAQ的表達水平下降(P<0.05)。敲低上述基因后,敲低CMTM5后口腔鱗癌細胞GNM的凋亡水平上升(P<0.05)。盡管敲低除CMTM5外的其他基因并不能引起口腔鱗癌細胞GNM凋亡水平的改變,但是這些基因在OSCC發生發展中的生物學功能值得進一步探索。此外,miR-3122靶向CMTM5的3端非編碼區(P<0.05)。過表達miR-3122后,CMTM5的mRNA水平和蛋白水平均下降(P<0.05),而敲低miR-3122后,CMTM5的mRNA水平和蛋白水平均上升(P<0.05)。因此miR-3122通過靶向CMTM5的3端非編碼區來抑制其翻譯。
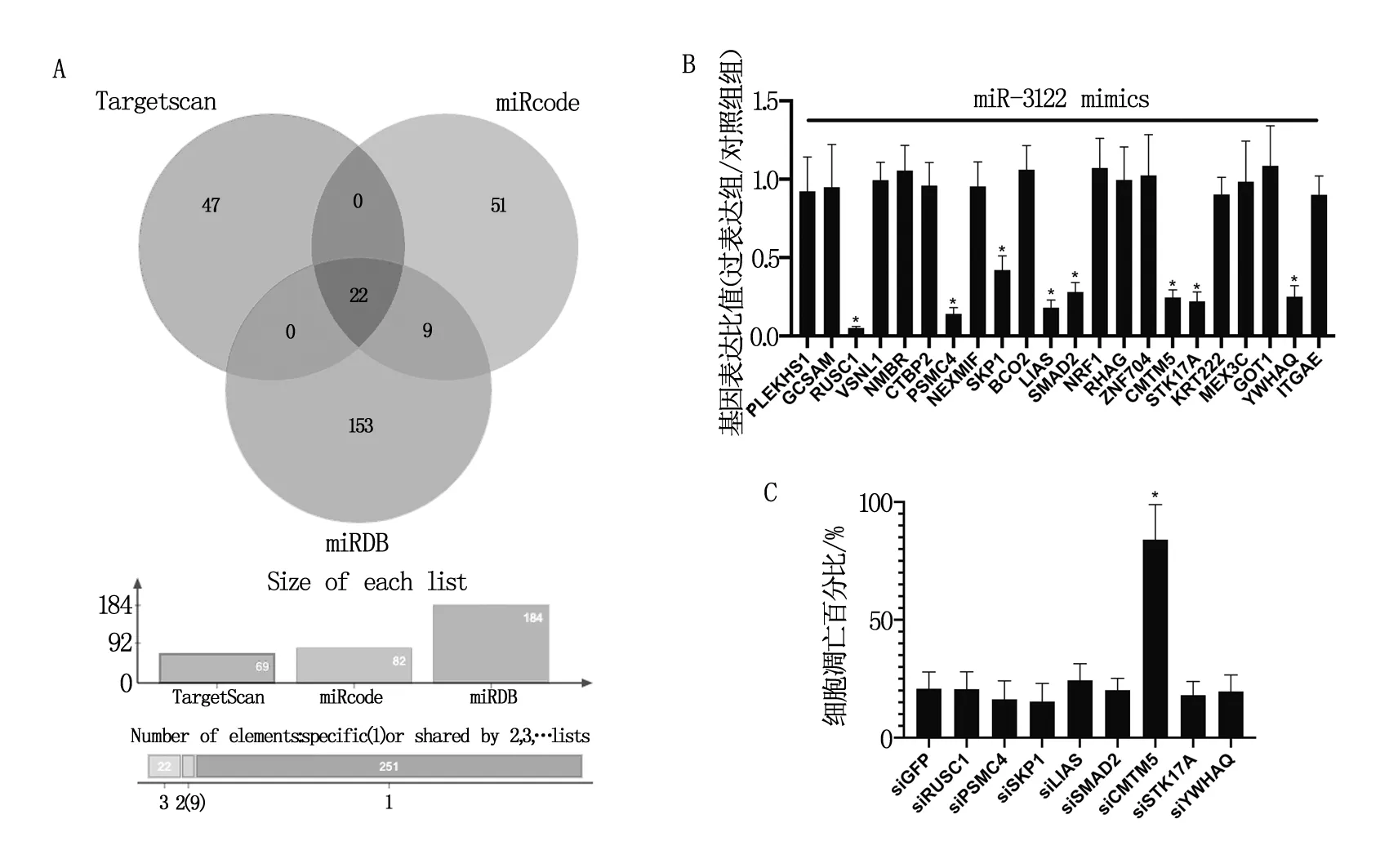
注:*P<0.05。
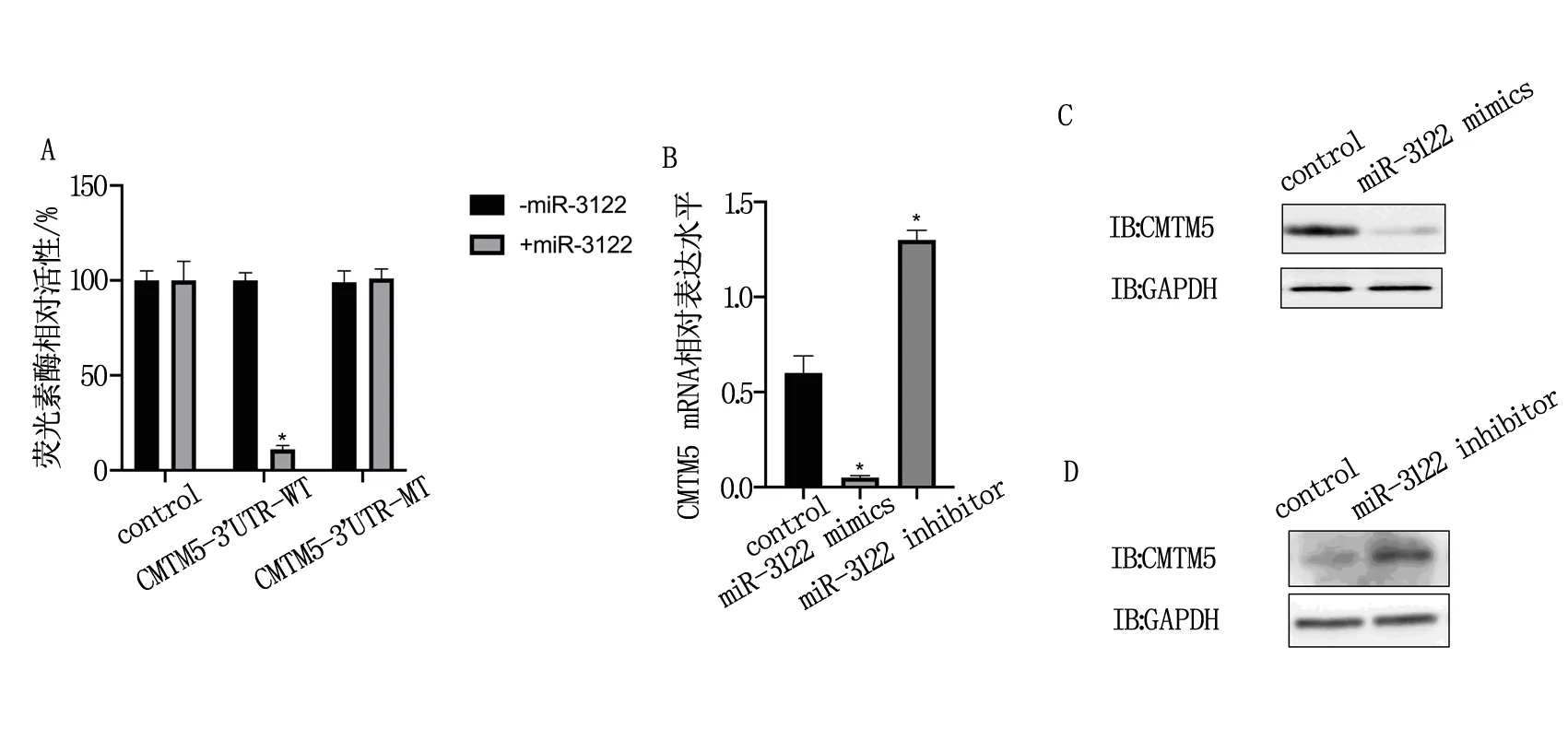
注:*P<0.05。
先前的研究表明,CMTM5通過啟動子甲基化作用在許多腫瘤中發揮抑癌功能,并頻繁發生表觀遺傳失活[9]。CMTM5位于14q11.2,這是一個包含與多種癌相關的多個基因的基因座[10]。研究表明,染色體14q11.2上的基因異常會導致各種癌癥的產生或生長,例如鼻咽癌,白血病,膠質母細胞瘤,腦膜瘤和口腔鱗癌[11-12]。這些結果表明CMTM5在致癌作用中具有重要作用。本研究同時敲低miR-3122和CMTM5時,口腔鱗癌細胞GNM凋亡水平無顯著變化(P<0.05);同時過表達miR-3122和CMTM5時,口腔鱗癌細胞GNM凋亡水平無顯著變化(P<0.05)。因此,可以通過體外合成miR-3122 mimics,再通過合適的呈遞方式將miR-3122 mimics運送到口腔鱗癌組織中可能起到緩解或治療OSCC的效果。
注:*P<0.05。
綜上所述,miR-3122通過靶向CMTM5 mRNA的3端非編碼區后,降解了CMTM5的mRNA并降低了CMTM5的蛋白水平,隨后促進了口腔鱗癌細胞GNM的凋亡。

