NOD1和NOD2在Hp陽性胃癌發生、發展中的作用機制研究
申學東,王紅衛,呼延智偉
(1.武警第一機動總隊醫院門診部,河北定州 073000;2.山西省晉中市第一人民醫院消化科 030600)
當前世界范圍內胃癌發病率不斷升高,相關死亡病例已居惡性腫瘤的第2位,有數據顯示我國惡性腫瘤死亡患者中約1/4為胃癌患者[1]。胃癌的危險因素包括幽門螺桿菌(Hp)感染、高鹽攝入、吸煙、飲酒和宿主遺傳易感性等,據估計有65%的胃癌與Hp感染有關[2]。先天免疫系統作為人體抵抗Hp感染的第一道防線,其抵抗力強弱與Hp感染的臨床結局直接相關。核苷酸結合寡聚化結構域(NOD)1和NOD2蛋白可通過核因子-κB(NF-κB)通路誘導天冬氨酸蛋白水解酶-3(caspase-3)活化,促進細胞凋亡,在免疫系統抵御Hp感染過程中發揮著重要作用[3]。因此,本研究分析NOD1和NOD2在Hp陽性胃癌發生、發展中的作用機制,為臨床診療提供幫助。
1 資料與方法
1.1 一般資料
收集2016年1月至2019年6月于山西省晉中市第一人民醫院行手術治療的124例胃癌患者標本,患者均經病理檢查診斷明確,其中男67例,女57例,年齡27~74歲。根據13C呼氣試驗和快速尿素酶試驗結果,將患者分為Hp陽性胃癌組(n=83)和Hp陰性胃癌組(n=41);根據組織病理結果,將Hp陽性胃癌患者分為早期胃癌組(n=29)和中晚期胃癌組(n=54)。早期胃癌指病灶局限于黏膜及黏膜下層,不考慮病灶大小和淋巴結轉移情況;中晚期胃癌指病灶達肌層或漿膜層[4]。排除標準:(1)合并其他惡性腫瘤;(2)合并甲狀腺功能異常;(3)術前曾口服激素、非甾體抗炎藥、避孕藥或進行抗Hp治療者;(4)臨床資料缺失者。
1.2 實驗試劑
鼠抗人β-肌動蛋白(β-actin)、NOD1、NOD2、NF-κB及caspase-3抗體均購自美國R&D公司;山羊抗兔IgG二抗、中性樹脂及DAB顯色液試劑盒均購自北京百奧萊博科技有限公司;實時熒光定量聚合酶鏈反應(PCR)試劑盒購自日本TaKaRa公司。
1.3 方法
1.3.1免疫組織化學法檢測NOD1和NOD2的表達水平
將124例胃癌患者胃癌組織的石蠟標本連續切片5張,用5%血清于室溫下封閉40 min,分別加入NOD1和NOD2的單抗進行孵育,置于4 ℃條件下過夜。復溫后加入二抗,37 ℃孵育30 min,PBS清洗后加入SP進行40 min恒溫反應,顯色后使用中性樹脂封片。顯微鏡下可見細胞內的棕黃色顆粒,即為NOD1和NOD2陽性表達。隨機選擇顯微鏡下的6個高倍視野(×40),計算平均光密度(mean optical density,MOD),MOD=累計光密度/面積。
1.3.2實時熒光定量PCR檢測NOD1和NOD2的mRNA表達水平
以Trizol法提取總RNA,再將RNA逆轉錄合成cDNA,最后以β-actin為內參進行實時熒光定量PCR。NOD1上游引物:5′-AAG CAT TTC TGC TAC CCG GAG-3′;下游引物:5′-AAG CAT TTC TGC TAC CCG GAG-3′。NOD2上游引物:5′-CCG TGT CCT GTT AAC CTT TG-3′;下游引物:5′-AGG ATC AGC AGG TAC ATG TC-3′。內參上游引物:5′-ACC ACA GTC CAT GCC ATC AC-3′;下游引物:5′-TCC ACC ACC CTG TTG CTG TA-3′。根據2-ΔΔCt公式計算目的基因mRNA的相對表達水平。
1.3.3Western blot檢測caspase-3和NF-κB的表達水平
將標本在冰上裂解2 h后離心,使用 BCA試劑盒檢測蛋白濃度,將樣本蛋白濃度調整至30 μg/μL。蛋白樣本電泳后轉至聚偏氟乙烯(PVDF)膜,按照1∶1 000加入一抗和二抗。樣本進行ECL顯色后,使用Bio-Pro凝膠分析儀和Quantity-one 軟件進行灰度掃描,得出各條帶蛋白表達水平。
1.4 統計學處理
2 結 果
2.1 一般臨床資料比較
兩組患者一般臨床資料比較,差異無統計學意義(P>0.05),見表1。

表1一般臨床資料比較
2.2 Hp陰性胃癌組和Hp陽性胃癌組NOD1、NOD2蛋白的表達水平比較
Hp陰性胃癌組和Hp陽性胃癌組NOD1、NOD2蛋白的免疫組織化學染色強度差異均有統計學意義(P<0.05),見圖1、2;經光密度檢測,Hp陰性胃癌組和Hp陽性胃癌組NOD1、NOD2蛋白表達水平差異均有統計學意義(P<0.05),其中Hp陽性胃癌組中NOD1和NOD2蛋白均呈高表達,見表2。

A:Hp陰性胃癌(×400);B:Hp陽性胃癌(×400)。

A:Hp陰性胃癌(×400);B:Hp陽性胃癌(×400)。
2.3 Hp陰性胃癌組和Hp陽性胃癌組NOD1、NOD2 mRNA的表達水平比較
Hp陰性胃癌組和Hp陽性胃癌組NOD1、NOD2 mRNA的表達水平差異均有統計學意義(P<0.05),其中Hp陽性胃癌組NOD1和NOD2 mRNA均呈高表達,見表3。
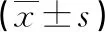
表2 NOD1和NOD2蛋白表達水平比較
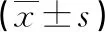
表3 NOD1和NOD2 mRNA的表達水平比較
2.4 Hp陽性的早期和中晚期胃癌caspase-3、NF-κB的表達水平比較
Hp陽性的早期和中晚期胃癌組間caspase-3、NF-κB的表達水平差異均有統計學意義(P<0.05),其中中晚期胃癌組caspase-3和NF-κB的表達水平均高于早期胃癌組,見圖3和表4。

圖3 Hp陽性早期和中晚期胃癌組caspase-3和NF-κB的表達水平
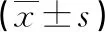
表4 caspase-3和NF-κB的表達水平比較
3 討 論
流行病學研究表明,胃癌與Hp感染有很強的相關性,早在1994年WHO已將Hp列為胃癌的Ⅰ類致癌因子[5-6]。我國Hp感染率超過50%,這也是中國胃癌發生率和死亡率較高的重要原因。目前關于Hp感染的致病機制主要有以下幾種學說,即基因學說、促胃液素聯系學說、漏頂學說和免疫學說,其中免疫學說越來越為人們所關注。該觀點認為Hp長期定植于胃黏膜表面,可通過黏附作用和產生多種毒力因子對胃黏膜細胞造成直接損傷[7]。此外,機體對Hp的炎性反應而導致的組織損傷也是胃潰瘍、慢性胃炎、胃癌及胃黏膜相關淋巴組織淋巴瘤發生的原因之一。Hp感染后機體免疫系統被激活,單核細胞和中性粒細胞可誘導產生一氧化氮(NO)、白細胞介素(IL)-2、IL-6及氧自由基,進而導致炎癥損傷[8]。
大多數感染Hp的患者表現為胃炎,只有少部分患者發展為胃癌,這其中宿主免疫應答對Hp的感染結局至關重要[9]。Hp通過激活識別病原體相關分子模式(pathogen-associated molecular patterns,PAMPs)的受體來觸發炎癥,而這些PAMPs是通過一組生殖系編碼的模式識別受體(pattern recognition receptors,PRRs)識別的。PRRs的激活可誘導一系列促炎細胞因子的表達迅速增加,其在先天和獲得性免疫反應中均發揮著重要作用。NOD1和NOD2是一類位于細胞質中的PRRs,它們的分子結構包括1個中心節點、1個N端效應器結合結構域和1個由富含亮氨酸重復序列組成的C端配體識別結構域。NOD1可識別主要存在于革蘭陰性細菌中的神經肽,而NOD2可識別肽聚糖合成或降解過程中產生的成分[10]。目前已有研究[11]表明,NOD1和NOD2可通過激活NF-κB、STAT1等轉錄因子,在炎癥相關腫瘤的發生發展中發揮重要作用。NF-κB是一種具有多向調節作用的核蛋白因子,參與機體氧化應激、炎癥及細胞增殖等病理生理過程,被激活后可活化效應性caspase-3,參與調控凋亡基因的轉錄,最終導致細胞核DNA鏈斷裂和細胞凋亡[12]。
本研究發現Hp陰性和Hp陽性胃癌患者一般臨床資料無明顯差異,具有可比性;NOD1和NOD2在Hp陽性胃癌標本中蛋白和mRNA的表達水平均高于Hp陰性胃癌標本,表明NOD1和NOD2在Hp陽性胃癌的發生過程中發揮重要抑制作用。Hp陽性中晚期胃癌標本中NF-κB和caspase-3的表達水平高于Hp陽性早期胃癌標本,表明隨著胃癌的發展NF-κB通路和caspase-3的活化增強,NOD1和NOD2所發揮的凋亡效應也隨之增強。有報道[13]指出,中國漢族人群NOD1的基因多態性與胃癌發生相關。另有動物研究[14]發現,NOD1缺陷的小鼠更容易受到具有功能型Ⅳ分泌系統的HP菌株感染,在野生型小鼠中,Hp感染后NOD1信號通路被激活,致使IL-1β的表達增加,而IL-1β可誘導和放大天然及適應性免疫反應,這進一步證實了NOD1與Hp 感染相關性胃病發生發展的相關性。有研究[15]表明,在慢性萎縮性胃炎-胃黏膜腸上皮化生及不典型增生-胃癌這一病理進展過程中,NOD2的表達率和表達強度逐漸升高,推測NOD2與胃癌的發生發展存在聯系,并可在一定程度上作為診斷疾病的參考指標。
綜上所述,NOD1和NOD2通過激活NF-κB通路進而活化凋亡因子caspase-3,最終誘導腫瘤細胞的凋亡,在Hp陽性胃癌的發生發展過程中發揮著一定作用,但具體作用機制還有待進一步闡明。胃黏膜組織中NOD1和NOD2的表達增加,可在一定程度上提示Hp陽性胃癌的發生及發展程度,此外檢測NF-κB和caspase-3的表達水平也可為臨床診斷提供重要的參考信息。

