旋磨術輔助冠狀動脈介入治療的研究進展
朱晨迎,葉 萍,岳 斌,季曉飛,常兆華
冠狀動脈鈣化(coronary artery calcification,CAC)是冠狀動脈粥樣硬化斑塊發展而來,內膜鈣化是冠狀動脈鈣化的主要類型[1],嚴重的內膜鈣化可能會增加術后支架內血栓和穿孔的風險而增加PCI 的難度。血管內超聲(intravascular ultrasound,IVUS)和光學相干斷層顯像(optical coherence tomography,OCT)是兩種輔助診斷冠狀動脈鈣化病變的血管內成像方法,OCT 的分辨率優于IVUS,但是其組織穿透力較差,目前診斷CAC 的主要方法為IVUS,對于IVUS 檢查結果>270°范圍的內膜鈣化,可直接選擇旋磨術。旋磨術利用機械或激光消蝕作用,打磨修飾鈣化病變產生一個相對光滑的管腔[2],有效改善血管的順應性,從而使球囊容易通過及擴張,支架植入時有助于支架膨脹與貼壁,降低支架再狹窄(ISR)的發生率,極大提高了冠狀動脈內鈣化病變PCI 的手術成功率,降低支架內血栓的風險[3]。軌道旋磨術(OA)系統和冠狀動脈內旋磨術(RA)系統在嚴重鈣化的冠狀動脈病變中有相似的近期效果(死亡率、心肌梗死、急性腎損傷和/腦卒中等住院結果方面沒有差異)和手術成功率[4]。此外,美國 ShockwaveMedical 公司結合超聲碎石與球囊血管成形技術,開發了血管碎石(lithoplasty)系統,通過利用聲波治療鈣化動脈疾病。該系統的臨床研究DISRUPT CAD 已經進入第3 階段,已發布的結果表明該系統可減小對血管的損傷,治療冠狀動脈鈣化和外周動脈鈣化有較好的效果和安全性[5]。本文主要從機制、并發癥、適應證、設備及臨床研究進展等方面簡介不同的旋磨術系統。
1 旋磨設備及其臨床應用
1.1 RA 系統
RA 系統在20 世紀80 年代初由波士頓科學公司的David C Auth 等進行研制及開發,并在1988年Fourrier 等完成了首例RA 實驗。第一代RA 系統(RotablatorTM)主要由控制臺、腳踏板、氣源、推進器、橢圓形旋磨頭(圖1①)、 導引導絲 RotaWire(RW 0.009 英寸/0.014 英寸)和 RotaglideTM潤滑劑等組成(圖1②)。利用差異切割和垂直移動摩擦兩個原理,選擇性地切割較堅硬的鈣化病變而不損傷正常血管組織,磨頭在高速旋轉期間始終保持縱向移動[2],RA 系統的旋磨頭尺寸為1.25~2.5 mm 范圍內多種規格,治療不同直徑的血管堵塞時需要根據不同情況更換旋磨頭尺寸。操作過程中旋磨頭的旋轉速度可達到140 000~190 000 r/min,橢圓形的鍍鎳黃銅旋磨頭前端有2 000 到3 000 個金剛石顆粒,金剛石顆粒直徑尺寸為 20~30 μm[6]。
新一代RA 系統(ROTAPROTM)在原有系統上進行改進,主要優點是簡化操作程序,一方面取消腳踏板,且用于切換到Dynaglide 模式的腳踏板的小旋扭被推進器上端的按鈕取代,另一方面控制臺小型化,設置時間更簡便(圖1③)[7-8];Oscar 等[7]在波蘭首次使用ROTAPROTM治療重度鈣化病變。相比于上一代RA 系統,ROTAPROTM系統操作友好,同時使學習曲線變平,可能會鼓勵更多介入心臟病學家愿意進行旋磨術治療。但是新一代系統的改進主要在腳踏板方面,雖然簡化了一部分操作,但是在使用過程中旋磨頭的更換問題和導絲操作方面仍值得關注。

圖1 波士頓科學兩代旋磨系統設備圖
使用RA 系統的適應證、 禁忌證和并發癥在表1 中列出[3,9],其中并發癥會導致 ISR、支架內血栓形成、 心肌梗死和死亡等不良事件發生率的增加[10]。Azzalini 等[11]探討 RA 系統治療慢性完全閉塞病變(chronic total occlusion,CTO)的遠期療效,RA 系統與常規PCI 相比手術成功率(77%比89%)雖然較低,但長期隨訪結果顯示RA 系統和常規PCI 組之間的主要心血管不良事件(major adverse cardiovascular events,MACE)發生率沒有較大差異(15% 比 13%)。Zhang 等[12]報道 587 例 CTO 患者中 26 例采用 RA系統的治療結果,手術成功率為97.2%且圍手術期未觀察到MACE 發生。應用小直徑(<1.5 mm)旋磨頭冠脈旋磨術聯合藥物洗脫支架(drug-eluting stent,DES)治療冠脈重度鈣化病變血管造影成功率(100%)及手術成功率(91.7%)高,并發癥發生率低,近期療效滿意[13]。隨著 DES 的發展,RA 系統作為斑塊修飾的輔助療法可以改善斑塊的順應性,方便支架的遞送和擴張從而改善預后。
雖然RA 系統較普通PCI 在治療嚴重的鈣化病變有很好的即時效果,但也存在一些不容忽視的問題,有研究表明降低動脈粥樣硬化斑塊清除率的主要原因在于使用時間較長后旋磨頭上有較為嚴重的粘結[14]。若手術過程中需要更換旋磨頭,操作者需要根據經驗在合適的時機更換旋磨頭避免并發癥的發生。由于RA 系統操作時旋磨頭與斑塊持續接觸,摩擦產生的熱量會導致熱損傷和血小板活化。熱損傷可增加圍手術期心肌梗死的風險,血液溫度升高會引起血細胞團聚形成血栓。旋磨過程中磨削力過大是導致血管夾層、 痙攣和動脈穿孔等并發癥的直接原因[15]。操作過程中建議速度為135 000~180 000 r/min[16],速度超過 180 000 r/min 可能會引發血栓和激活血小板等并發癥,Kenichi 等[17]觀察導絲在最大速度下會發生旋轉,旋轉可能會引起導絲螺旋段解旋引發血管穿孔,速度過低雖然會降低溫度,但會使碎片的粒徑增大導致遠處栓塞[18]。嚴重減速會增加右冠狀動脈開口病變損傷率,還存在發生旋磨頭嵌頓和血管穿孔等并發癥的可能性。操作過程中 RA 速度減少應該小于 5 000 r/min[19]。旋磨頭嵌頓與病變類型和操作有較大關系,穿過長段、成角病變或嚴重鈣化病變時容易發生磨頭嵌頓,采取分段推進的方法可有效減小該并發癥的發生。導絲斷裂(穿孔)較為少見,但導絲打結、解旋伸長[20]和導絲在最大速度下旋轉都曾有報道[17]。Warisawa 等[20]報道1 例使用RA 系統治療嚴重鈣化病變,RW 導絲在220 000 r/min 下多次運行時出現遠端打結,當撤出時RW 導絲時導絲明顯伸長,通過對微導管的逐步推進和輕柔旋轉RW 導絲等操作使RW 成功撤回。

表1 RA 的適應證、禁忌證以及并發癥
1.2 軌道旋磨術OA 系統
OA 系統最初用于外周血管鈣化疾病取得良好效果,2013 年開始用于冠狀動脈鈣化治療。OA 系統代表裝置為DIAMONDBACK 360?冠狀動脈粥樣硬化切除系統,該裝置采用電機驅動,不需要腳踏板和氣源來啟動設備且操作手柄可以控制旋磨頭在血管內的位置(圖2①),采用直徑為1.25 mm 標準旋磨頭,導絲(ViperWire?)直徑為 0.012 /0.014 英寸,金剛石涂層磨頭偏心安裝在導引導絲上高速旋轉(圖2②),速度在80 000~120 000 r/min,結合離心力和差異切割來消除鈣化病變,可以通過控制臺的按鈕控制低高速的轉換從而實現對不同直徑血管病變的旋磨,在不更換磨頭的情況下僅使用6 F 的導管也可以實現對不同直徑血管的病變消除,相比RA 系統速度設置更快也更容易操作[6,21]。

圖2 DIAMONDBACK 360?系統
ORBIT Ⅰ[21]和 ORBIT Ⅱ[22]兩次關鍵性試驗評估OA 系統用于治療再狹窄嚴重鈣化病變后再植入支架后的安全性和有效性。ORBIT Ⅰ試驗治療重新嚴重鈣化病變,在入選的50 例患者中,使用OA 系統治療后植入DES,手術成功率為94%,住院期間、30 d 和 6 個月的累積 MACE 率分別為 4%、6%和8%,但是該實驗樣本數較少,存在一定局限。ORBIT Ⅱ是一項更大的試驗,手術成功率和支架植入成功率分別為88.9%和97.7%,住院期間和30 d的累積 MACE 率分別為 9.8%和 10.4%[22]。ORBITⅡ的1 年隨訪結果顯示MACE 率為16.4%,靶血管血運重建(target vessel revascularization,TVR)率為4.7%[23]。經濟學分析顯示使用 OA 系統治療 1 年后具有較好的成本效益。住院期間使用OA 系統比球囊血管成形術的標準治療費用平均少1702 美元,且死亡率降低[24]。Lee 等[25]評估了 OA 系統在真實世界中治療嚴重CAC 患者的安全性和有效性,30 d MACE 率為1.7%。血管造影和手術成功率高,支架植入成功率為99.1%。ORBITⅡ試驗的欠缺之處在于缺少對照組,與歷史對照組比較可能會使研究結果缺乏說服力。ECLIPSE 是目前正在進行的一項隨機試驗,該試驗將登記約2 000 例嚴重CAC 患者,對照OA 系統和傳統血管成形術治療嚴重CAC 的療效,主要終點為比較即刻最小支架面積和術后1年 TVF 率[26]。
1.3 準分子激光冠狀動脈粥樣硬化切除術
20 世紀80 年代激光被用于冠狀動脈血管成形術的輔助治療納入介入心臟病學的治療,CVX-300準分子激光系統是唯一被PMA 批準用于治療外周及冠狀動脈血管疾病的冠狀動脈應用激光系統(圖3①),導管(圖3②)可兼容 0.014 英寸導絲,尖端可采用同心或偏心設計[27]。采用氙氣(XeCl)氣體作為介質,通過光纖傳輸波長為308 nm 的紫外光能量。作用機制是光化學,光機械或光熱相互作用。由于準分子激光穿透深度較低,在較短的相互作用時間(脈沖)內可以獲得較高的能量,這使化學鍵只在激光接觸的組織中斷裂,而不會破壞周圍的組織或增加熱量[28]。ELCA 除了無保護主干病變及缺少知情同意等相對禁忌證外沒有絕對的禁忌證[29]。
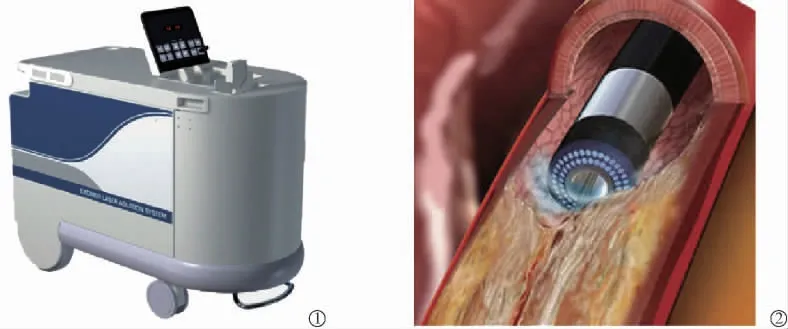
圖3 準分子激光旋磨術設備
Goldman 在1962 年報道了激光的首個醫學應用,并于1963 年用于動脈粥樣硬化斑塊的實驗性消融,且第一次臨床應用是在1983 年由Choy 和Ginsburg 完成的。Nakabayashi 等[27]報道可使用 ELCA系統簡化治療復雜鈣化病變的PCI 程序,包括側支病變、急性冠脈綜合征(acute coronary syndrome,ACS)、支架擴張不足、ISR、血栓等。Mohandes 等[30]報道 6例使用ELCA 系統輔助治療CTO 和功能性閉塞患者,手術成功率為 83.3%。Nishino 等[31]使用多中心注冊表(ULTRAMAN)來分析DES 時代在日本使用ELCA 系統治療各種冠狀動脈疾病后的臨床經驗和結果,328 例患者中主要病變類型為ACS(53.4%)和ISR(32.3%),使用 ELCA 系統治療 ACS 和 ISR 的成功率分別為92.5%和91.5%。使用ELCA 系統和藥物洗脫球囊(DEB)成形術治療80 例ISR,結果顯示91%的患者在臨床和血管造影方面取得了長期的成功。心肌梗死和死亡的發生率低于支架內普通球囊血管成形術后的發生率[32]。Ichimoto 等[33]研究表明使用ELCA 系統治療DES 后ISR 與常規PCI 相比,前者管腔增大程度明顯大于后者[(1.64 ±0.48) mm比(1.26 ± 0.42) mm,P<0.001)。
1.4 不同旋磨術的比較與展望
關于OA 系統與RA 系統的治療結果對比研究,Xenogiannis 等[34]和 Aggarwal 等[35]均報道了使用OA 系統和RA 系統分別治療CTO 等鈣化病變,結果顯示OA 系統和RA 系統的手術成功率以及總體MACE 率相似,在促進冠狀動脈鈣化PCI 方面兩者有相似的安全性和有效性。在并發癥方面,OA 系統與RA 系統相比有以下優勢: 鈣化組織旋磨產生的磨屑堵塞毛細血管是引發血液慢血流/無復流和痙攣等并發癥的主要原因。RA 系統的磨屑平均顆粒大小為5 μm,顆粒以團狀方式釋放,OA 磨頭處于間斷接觸狀態,連續釋放2 μm 顆粒,使用OA 系統的遠端栓塞與慢/無血流率較少[36-37]。與 RA 系統相比,OA 系統運轉軌道為橢圓形則允許血液和微小碎屑流經旋磨頭,從而不斷地分散顆粒,冷卻旋磨頭,理論上降低目標血管熱損傷和緩慢回流的風險[21,38]。OA 系統是雙向運轉的,降低了血管夾層的風險[6]。OCT 掃描結果顯示,相比于RA 系統,OA 系統治療明顯具有更長的切口和更深的解剖,同時OA 系統治療后支架支撐貼壁不良的百分比較低以及支架擴張較好[39]。
ELCA 系統相比OA 和RA 系統的關鍵優勢在于,RA 系統和OA 系統需要專用的旋磨導絲,ELCA系統可以在標準0.014 英寸導絲上遞送。ELCA 系統與前兩者的作用機制不同,若在嚴重鈣化病變出現旋磨導絲無法通過病變時可先行ELCA,為后續旋磨術創造條件。另外,準分子激光具有獨特的抑制血小板聚集的作用[40]。
綜上,對于血液慢血流和局部溫度過高等并發癥,旋磨設備的旋磨頭采用偏心設計理論上可以有效降低該并發癥的發生,但技術問題值得考慮,且旋磨頭的成本問題較為突出,價格較低的旋磨頭有更大的需求。更為理想的旋磨操作系統,其導管應能與目前臨床常用的標準導引導絲(直徑為0.014英寸)兼容,導管在旋磨過程中高速旋轉,保持導管與導絲的完整性成為考慮的重點問題,包括操作過程中保持導絲不斷裂和兩者的表面涂層完整性等,針對此問題,在結構設計方面,導管的扭矩需要使其達到必要的使用速度且柔性必須滿足通過不同形態的血管的需求。另一方面,選擇在血液環境中摩擦力較小、耐高溫和生物相容性較好的材料作為涂層,例如聚四氟乙烯和聚酰亞胺等,提高涂層的牢固性與基體的粘合性也可以減小操作過程中兩者產生的摩擦。
2 結語
冠狀動脈斑塊旋磨術是治療嚴重鈣化病變的主要術式,雖然目前的臨床研究說明旋磨術對嚴重鈣化病變或是復雜病變的治療具有較好的安全性和有效性,但是減少并發癥的發生還需設備開發人員和操作者的共同努力,成本低、操作簡便、適用性廣的旋磨術設備可以實現對更多患者的治療。

