完全腹腔鏡賁門周圍血管離斷術聯合脾切除術治療肝硬化門靜脈高壓癥
尕藏東周 喻定剛 羅斯滿 陳見中 唐正勇
(阿壩藏族羌族自治州人民醫院外二科,四川 馬爾康 624000)
肝硬化門靜脈高壓(cirrhotic portal hypertention,CPH)是肝硬化常見并發癥,相關研究顯示,CPH-食管胃底靜脈曲張在肝硬化患者中發生率為24%~80%,且病死率較高[1-2]。由于肝移植治療CPH有其適應征,且供肝不易獲得,因此近年來外科手術是治療CPH的主要手段,其中脾切除聯合賁門周圍血管離斷術是重要術式之一。近年來,隨著腹腔鏡器械的進步及國內醫師腹腔鏡術式經驗的豐富,腹腔鏡術式在外科應用范圍越來越多,使患者受益更多。國內已有相應單中心病例報告和部分臨床研究顯示,為CPH并食管胃底靜脈曲張患者行腹腔鏡下脾切除聯合賁門周圍血管離斷術獲得良好效果[3-4]。但多樣本量較小或為病例報告,且僅關注患者圍術期狀況及并發癥。基于此,本研究選取140例CPH患者作為研究對象,以探究完全腹腔鏡賁門周圍血管離斷術聯合脾切除術治療CPH的臨床療效,現將結果報告如下。
1 資料與方法
1.1 一般資料 納入2016年6月~2019年10月間我院收治的140例CPH患者作為研究對象,采用隨機數表法分為觀察組和對照組,每組各70例。納入標準:①由臨床及生化特征判斷門靜脈高壓,由影像學檢查,必要時參考肝靜脈壓力梯度[5]、組織病理學檢查明確CPH。②參考術前影像學檢查、胃鏡示明顯脾大、脾功能亢進、食管胃底靜脈曲張者。③年齡>18歲者。④知情同意。⑤經我院倫理委員會審核通過者。排除標準:①其他病因所致門靜脈高壓者。②Child-pugh分級C級者。③其他嚴重器官功能不全、惡性腫瘤者。④中重度腹水者。
1.2 手術方法 觀察組患者采用完全腹腔鏡賁門周圍血管離斷術聯合脾切除術:患者均采用氣管插管全麻、取平臥位,常規術前準備;臍下1 cm做一長約1 cm弧形切口,氣腹針插入形成氣腹(壓力10 mmHg~12 mmHg),將10 mm錐鞘于該切口送入腹腔,并植入10 mm 30°腹腔鏡,檢查內臟情況;于右腹直肌外側緣肋緣下2 cm穿刺送入10 mm錐鞘,于左鎖骨中線與臍水平線交點穿刺送入5 mm錐鞘,于左腋前線肋緣下3 cm穿刺送入10 mm錐鞘、于右側臍外上3 cm穿刺送入穿刺送入10 mm錐鞘,置入超聲刀、抓鉗等器械;將患者由平臥位改為頭高足低、右傾30°體位,打開大網膜,分離脾動脈,預先夾閉脾動脈主干,自脾下極開始依次處理胃韌帶、脾腎韌帶、脾膈韌帶、脾與后腹膜之間的疏松組織和脾蒂,切除脾臟過程中若術中出現脾包膜撕裂出血立即予以紗布壓迫止血,脾臟置入標本袋暫時置于盆腔;分離脾胃韌帶、胃膈韌帶及胃結腸韌帶,向上至賁門左側上6~8 cm處,超聲刀凝斷胰腺上緣走向胃底食管后壁的靜脈支;牽開肝左葉和胃,從胃小彎幽門切跡開始,使用超聲刀凝斷胃右靜脈,逐步凝斷胃左靜脈通向胃壁的分支,向上達食管下段和賁門上6~8 cm左右血管支;逐步離段胃冠狀靜脈的胃支、食管支、高位食管支,完成賁門周圍血管離段術;手術結束后延長臍下切口,碎脾后取出。對照組采用開腹賁門周圍血管離斷術聯合脾切除術:患者均采用氣管插管全麻、取平臥位,常規術前準備;肋緣下做一長約20 cm的弧形切口,逐層切開組織進入腹腔,切開胃結腸韌帶、脾胃韌帶,暴露脾動脈后雙重結扎,分道切斷結扎脾胃韌帶、脾結腸韌帶、脾腎韌帶及脾膈韌帶,切斷脾與后腹膜粘連,游離脾蒂并切斷結扎其上下級血管蒂,移除脾臟,縫扎脾蒂斷端并縫合后腹膜剝離面;向右上方翻開胃體大彎,賁門周圍血管離斷術步驟同腹腔鏡下手術。
1.3 評估方法 術前、術后1天、術后1周時均采集患者外周空腹靜脈血,使用TBA-2000FR型全自動生化分析儀(日本東芝株式會社生產)測定谷丙轉氨酶(ALT)、谷草轉氨酶(AST);術前、術后1天、術后1周時使用酶聯免疫法(ELISA)測定C反應蛋白(CRP)、腫瘤壞死因子-α(TNF-α)、白介素-6(IL-6)水平。
1.4 觀察指標 比較兩組圍術期狀況(術中出血量、手術時間、術后下床時間、術后住院時間),評估術前、術后1周患者肝功能(ALT、AST),評估術前、術后1天、術后1周時血清炎癥因子(CRP、TNF-α、IL-6),記錄兩組術后并發癥發生率,觀察術后1年遠期隨訪結果。
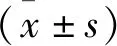
2 結果
2.1 兩組患者一般資料比較 兩組一般資料對比,差異無統計學意義(P>0.05),見表1。

表1 兩組患者一般資料對比Table 1 Comparison of general information of the two groups
2.2 兩組患者圍術期狀況對比 觀察組70例患者均完成腹腔鏡手術,無中轉開腹者。觀察組較對照組術中出血量少、手術時間長、術后下床時間及術后住院時間短(P<0.05),見表2。
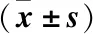
表2 兩組患者圍術期狀況對比Table 2 Comparison of perioperative status between the two groups
2.3 兩組患者肝功能對比 術后1周時,兩組ALT、AST均低于術前(P<0.05),但觀察組與對照組組間對比差異無統計學意義(P>0.05),見表3。
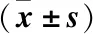
表3 兩組患者肝功能對比Table 3 Comparison of liver function between the two groups
2.4 兩組患者血清炎癥因子對比 術前、術后1天及術后1周時,兩組CRP、TNF-α、IL-6均上升后降低(P<0.05),觀察組術后1天及術后1周時CRP、TNF-α、IL-6水平均低于對照組(P<0.05),不同術式CRP、TNF-α、IL-6與時間存在交互效應(P<0.05),見表4。
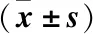
表4 兩組患者血清炎癥因子對比Table 4 Comparison of serum inflammatory factors between the two groups
2.5 兩組患者并發癥發生率對比 觀察組并發癥總發生率低于對照組(P<0.05),見表5。

表5 兩組并發癥發生率對比[n(×10-2)]Table 5 Comparison of the incidence of complications between the two groups
2.6 兩組患者遠期隨訪結果對比 140例CPH患者中116例患者獲得術后1年隨訪資料,其中觀察組64例、對照組52例。術后1年隨訪,觀察組2例再發上消化道出血、無死亡病例,對照組無上消化道出血病例、1例肝功能衰竭死亡。兩組再發上消化出血、死亡率對比差異均無統計學意義(2=0.324、0.000,P=0.570、1.000)。
3 討論
腹腔鏡手術作為微創術式,具有手術創傷小、住院時間短、術后恢復快等優點,因此多種微創術式受到患者及醫師的認可[6]。既往多認為CPH患者存在凝血功能障礙、門靜脈周圍血管迂曲擴張、血管壁薄且質地脆等病理特點,腹腔鏡脾切除聯合賁門周圍血管離斷術難度較大,容易導致難控制性大出血[7-9]。有學者發現,在嚴格把握腹腔鏡手術適應征的前提下,對可以進行開腹賁門周圍血管離斷術聯合脾切除術的患者行腹腔鏡手術也安全有效[10-12]。張安澎等[13]學者的研究顯示,腹腔鏡脾切除術的近期療效優于傳統開腹手術,且相對于開腹術式,腹腔鏡術式并未增加門靜脈血栓的發生率。故本研究對照分析不同術式對患者肝功能、免疫應激的影響,以進一步腹腔鏡術式的安全性和優勢。
本研究結果顯示,在CPH患者圍術期情況方面,觀察組雖較對照組手術時間更長,但在控制患者術中出血量、術后下床時間和住院時間方面均更有優勢,提示腹腔鏡脾切除聯合賁門周圍血管離斷術有利于減少術中創傷、縮短患者恢復進程,體現了腹腔鏡微創的優勢。包漢康等[14]學者的研究也獲得類似結論。在并發癥方面,本研究數據顯示,術后隨訪3個月觀察組并發癥發生率低于對照組,進一步證明腹腔鏡術式的安全有效性。同時,在術后1年遠期隨訪中,觀察組再發上消化出血、死亡率均與對照組相近,表明在預防方面腹腔鏡術式與開腹術式的非劣效性。首先,本研究患者均采用頭高足低右斜傾30°的體位,這一體位便于術中根據實際情況調整為仰臥位和右側臥位,更有利于擴展腔鏡下視野,處理脾周血管韌帶更便利。其次,在腔鏡下處理凝血時,本研究將超聲刀、Ligasure系統、鈦夾等多種工具綜合使用,既可直接進行血管閉合切割,又可有效使血管腔永久閉合,故在處理脾臟血管時造成意外出血的風險更低。
肝臟的血流動力學對肝功能影響較大,在肝臟血流增加時,肝細胞能夠獲得更多的營養物質,肝功能增強;反之,肝功能降低[15-17]。本研究發現,兩組ALT、AST水平均低于治療前。這說明腹腔鏡術式也能減少對肝功能的損害。其原因是,對肝動脈而言,由于脾動脈及胃左動脈結扎,腹腔干動脈流出道減少,直接增加肝動脈血流量,同時門靜脈血流量減少,降低肝血竇壓力,相應增加肝動脈血流,流量及流速也相應增加[18]。但橫向對比發現兩組各肝功能指標水平相近,提示腹腔鏡術式和開腹術式均有益于保護患者肝功能,與謝翔等[19-20]學者研究存在差異,考慮與兩研究觀察時長不一致有關。本研究還發現,觀察組術后1天、術后1周時各血清炎癥因子水平均低于對照組,表明腹腔鏡術式對CPH患者造成的免疫應激影響更小,這也與術后感染相關并發癥發生率低有關,繼而使患者總并發癥發生率更低[20]。
4 結論
完全腹腔鏡與開腹賁門周圍血管離斷術聯合脾切除術均有利于改善CPH患者肝功能,但接受完全腹腔鏡術式患者術中出血量小、術后恢復快,血清炎癥因子水平及并發癥發生率均更低。

