化濕湯對潰瘍性結腸炎模型大鼠的治療作用及機制研究※
劉會麗 聶曉博 李艷紅 陳艷從 袁榴翼 劉曉蘭
(石家莊醫學高等專科學校中醫基礎教研室,河北 石家莊 050599)
潰瘍性結腸炎(ulcerative colitis,UC)是一種慢性免疫介導性疾病,其發病原因仍不十分清楚,臨床上多以氨基水楊酸類藥物或激素類藥物進行治療,療效雖好卻不良反應較多[1]。近年來,研究人員開始關注采用中醫藥治療UC,并認為UC多為濕邪積滯所致,臨床常以健脾行氣利濕為法[2]。自擬化濕湯是我們治療UC的經驗方,由經典方劑胃苓湯加減而來,臨床應用其治療UC效果顯著。為進一步研究其作用機制,本研究通過觀察化濕湯對UC模型大鼠的治療作用,并從抗炎、抗氧化損傷角度初步進行機制探討。
1 材料與方法
1.1 實驗動物 SD雄性大鼠60只,無特定病原體(SPF)級,體質量180~220 g,飼養于屏障環境,喂飼滅菌常規飼料,自由飲用去離子水,購自斯貝福(北京)生物技術有限公司,實驗動物許可證號:SCXK(京)2019-0010。
1.2 實驗藥物 化濕湯(藥物組成:炒蒼術8 g,炒白術8 g,制厚樸5 g,茯苓8 g,澤瀉5 g,陳皮5 g,炙甘草3 g,以上藥材均由河北省中醫院中藥房提供,并水煎濃縮至生藥含量2 g/mL);美沙拉秦緩釋顆粒(上海愛的發制藥有限公司,國藥準字H20143164)。
1.3 實驗試劑及儀器 白細胞介素1β(IL-1β)及IL-10酶聯免疫吸附(ELISA)試劑盒(上海森雄科技實業有限公司);一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)及髓過氧化物酶(MPO)試劑盒(南京建成生物工程研究所有限公司);CMax Plus光吸收型單功能酶標儀(美國Molecular Devices公司);DM500生物顯微鏡(德國Leica公司)。
1.4 實驗方法
1.4.1 模型制備 所有大鼠適應性飼養3 d后,隨機取50只大鼠采用三硝基苯磺酸(TNBS)制作UC模型[3]。首先用10%水合氯醛大鼠腹腔注射麻醉,然后將直徑0.4 mm的膠管用石蠟油浸潤后探入大鼠直腸內部,深約7~8 cm,注入TNBS,給藥劑量為100 mg/kg,并將大鼠倒置30 s,使藥液充分滲入腸腔,最后將大鼠四肢捆扎,限制自由活動5 d。
1.4.2 分組與給藥 第6 d造模成功后,將模型大鼠隨機分為模型組、陽性藥物組(0.036 g/mL)、化濕湯低劑量組(0.5 g生藥/mL)、化濕湯中劑量組(1 g生藥/mL)、化濕湯高劑量組(2 g生藥/mL),每組10只。另設10只大鼠為空白組。各組大鼠均按10 mL/kg灌胃,空白組及模型組予蒸餾水灌胃,陽性藥物組予0.036 g/mL美沙拉秦緩釋顆粒藥液灌胃,化濕湯低、中、高劑量組分別予化濕湯0.5、1.0、2.0 g/mL藥液灌胃,每日1次,連續灌胃10 d。
1.4.3 取材 各組大鼠在末次灌胃后,禁食12 h,將大鼠腹腔麻醉后通過腹主動脈取血,并分離血清備用。然后脫頸處死大鼠,剪取結腸組織,部分以4%多聚甲醛固定,-80 ℃冷凍保存。
1.5 觀察指標及方法
1.5.1 一般情況 從開始造模第1、3、6、9、12、15 d分別記錄各組大鼠的體質量,并觀察毛色、糞便性狀等一般情況。
1.5.2 結腸組織病理形態學觀察 將4%多聚甲醛固定的結腸組織取出,石蠟包埋,切成4 μm組織切片,二甲苯脫蠟,乙醇梯度洗脫,蘇木素-伊紅(HE)染色,最后于100倍顯微鏡下觀察組織病理形態學變化。
1.5.3 血清炎癥因子檢測 對各組大鼠血清IL-1β、IL-10及NO水平進行測定,IL-1β及IL-10采用ELISA法進行檢測,NO采用硝酸還原酶法進行檢測,均按試劑盒說明書進行操作。
1.5.4 結腸組織氧化損傷檢測 各組取500 mg結腸組織置于勻漿管中打成勻漿,對結腸組織中MDA、SOD及MPO含量進行測定,MDA采用硫代巴比妥酸法(TBA)檢測,SOD采用WST-1法檢測,MPO采用化學比色法檢測,均按試劑盒說明進行操作。
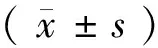
2 結 果
2.1 各組大鼠體質量及一般情況 空白組大鼠體質量逐漸增加,大鼠狀態正常,毛色光亮,糞便成形。模型組大鼠體質量增加緩慢,精神萎靡不振,毛色枯槁,糞便稀溏,提示造模成功。陽性藥物組及化濕湯低、中、高劑量組大鼠在灌胃治療后體質量增加情況、精神狀態、毛色及糞便性狀均好于模型組。各組大鼠造模后第1、3、6、9、12、15 d體質量變化比較 見表1。

表1 各組大鼠造模后第1、3、6、9、12、15 d體質量變化比較
由表1可見,模型組大鼠造模后第3、6、9、12、15 d的體質量均低于空白組(P<0.05)。陽性藥物組及化濕湯中、高劑量組造模后第15 d體質量均明顯高于模型組(P<0.05),化濕湯低劑量組大鼠體質量雖較模型組也有增加,但差異無統計學意義(P>0.05)。化濕湯高劑量組大鼠造模后第15 d體質量明顯高于化濕湯低劑量組(P<0.05),化濕湯中劑量組大鼠體質量雖較化濕湯低劑量組比較,也有升高趨勢,但差異無統計學意義(P>0.05)。
2.2 各組大鼠結腸組織病理形態學變化 空白組大鼠結腸黏膜隱窩結構排列整齊,橫截面可見杯狀細胞。模型組大鼠結腸黏膜隱窩有分支,結構扭曲,表面不平整。陽性藥物組大鼠結腸黏膜隱窩排列較整齊,僅上皮細胞有損傷。化濕湯低劑量組大鼠結腸黏膜隱窩排列雜亂,上皮細胞有明顯損傷。化濕湯中劑量組大鼠結腸黏膜隱窩扭曲,上皮細胞損傷。化濕湯高劑量組大鼠結腸黏膜隱窩排列較整齊,但可見上皮細胞損傷。見封3,圖1。
2.3 各組大鼠末次灌胃后血清IL-1β、IL-10及NO水平比較 見表2。
由表2可見,與空白組比較,模型組大鼠血清IL-1β和NO水平明顯升高(P<0.05),IL-10水平明顯下降(P<0.05)。與模型組比較,陽性藥物組及化濕湯高劑量組大鼠血清IL-1β和NO水平明顯降低(P<0.05),IL-10水平明顯升高(P<0.05);化濕湯中劑量組大鼠血清IL-1β和NO水平較模型組明顯降低(P<0.05),IL-10水平與模型組比較差異無統計學意義(P>0.05);化濕湯低劑量組大鼠血清IL-1β、IL-10及NO水平較模型組雖也都有改善,但差異均無統計學意義(P>0.05)。與化濕湯低劑量組比較,化濕湯高劑量組血清IL-10水平升高(P<0.05),NO水平降低(P<0.05),化濕湯中劑量組血清NO水平降低(P<0.05)。
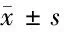
表2 各組大鼠末次灌胃后血清IL-1β、IL-10及NO水平比較
2.4 各組大鼠末次灌胃后結腸組織MDA、SOD及MPO水平比較 見表3。
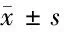
表3 各組大鼠末次灌胃后結腸組織MDA、SOD及MPO水平比較
由表3可見,與空白組比較,模型組大鼠結腸組織中MDA和MPO水平均明顯升高(P<0.05),SOD水平明顯降低(P<0.05)。與模型組比較,化濕湯中、高劑量組大鼠結腸組織中MDA和MPO水平均明顯降低(P<0.05),SOD水平均明顯升高(P<0.05);陽性藥物組MPO水平降低(P<0.05),MDA和SOD水平與模型組比較差異均無統計學意義(P>0.05);化濕湯低劑量組大鼠腸組織MDA、SOD及MPO水平雖較模型組也都有改善,但差異均無統計學意義(P>0.05)。與化濕湯低劑量組比較,化濕湯高劑量組中MDA水平降低(P<0.05),SOD升高(P<0.05),化濕湯中劑量組MDA水平降低(P<0.05)。
3 討 論
UC又稱非特異性結腸炎,主要表現為大腸黏膜的慢性炎癥和潰瘍性病變。目前已知與UC有關的發病機制主要為氧化應激、腸通透性增高、某些炎癥介質或硫化物生成增加、短鏈脂肪酸氧化或甲基化減少、黏膜變性、糖胺聚糖含量異常改變等[4],其中是氧化應激和炎癥介質釋放增加在臨床研究中均被明確證實與UC的發病密切相關[5]。研究發現,在結腸炎癥局部黏膜內的活性氧代謝物過量產生,如過氧化氫、羥基自由基及氧化劑衍生物等,可能是炎癥性腸病的主要致病因素[6]。腸黏膜損傷與自由基的產生增多及內源性抗氧化物質濃度的降低有關[7]。自由基誘導的脂質過氧化是TNBS誘導的結腸黏膜損傷的機制之一[8]。MDA是氧化應激的標志產物,是脂質過氧化過程的最終產物,自由基活性的增加會導致MDA的過量產生[9]。SOD被認為是細胞內抑制氧自由基有害作用的重要的內源性因子[10],多項研究表明UC患者的結腸組織中SOD水平明顯下降[11]。MPO活性檢測對評價腸道炎癥也有重要意義,MPO常見于中性粒細胞,其活性與中性粒細胞浸潤呈線性相關,在UC活動期病例中,糞便中MPO水平顯著高于緩解期患者及正常對照者[12]。
多種炎癥細胞因子,如IL-1β、IL-10及NO在炎癥性腸病的發病機制中也扮演著重要的角色。臨床研究顯示,與健康人群相比UC患者的IL-1β及NO水平明顯增高,IL-10水平降低[13]。IL-1β作為促炎因子,廣泛參與了人體組織破壞、水腫形成等多種病理損傷過程,UC發生時其水平可明顯升高[14]。IL-10是具有免疫調節功能的抗炎細胞因子,主要由T淋巴細胞分泌,對炎性反應有非特異性的抑制作用,研究表明IL-10的水平與UC的炎癥反應嚴重程度呈負相關,促進IL-10的表達能夠明顯減輕炎性反應[15]。NO在炎性反應過程中則扮演了雙重角色,既有促炎作用也有保護作用,當組織細胞受到大量炎癥因子刺激時,NO也會大量產生,并且生成具有較強毒性的過氧亞硝酸鹽,對組織結構和功能造成破壞[16]。
目前治療UC的首選藥物是5-氨基水楊酸、柳氮磺吡啶等,美沙拉秦緩釋顆粒是臨床常用的藥物之一,其可緩慢而勻速的釋放5-氨基水楊酸,從而達到抗炎的作用,因此本研究以此作為陽性藥物[17]。近年來,臨床上采用中醫藥治療UC的研究日益增多,并因其療效顯著、不良反應輕微而受到了醫學界的廣泛關注。UC屬中醫腸癖、泄瀉等范疇,認為UC發病的中心環節在于脾虛濕困,多與濕邪侵及、恣食生冷、郁怒思慮、情志不遂等有關,脾胃受損,升降失司,運化失常,濕熱內生,水濕聚集,下注大腸,腸絡受損,腐敗化為膿血而痢下赤白,故治療應以健脾益氣、祛濕止瀉為原則。化濕湯是由《丹溪心法》中胃苓湯加減而來,方中蒼術健脾燥濕,升陽散邪;白術燥濕健脾,利尿消腫;制厚樸溫中止痛,行氣化濕;茯苓利水消腫,滲濕健脾;澤瀉利水滲濕泄熱;陳皮理氣燥濕,可助蒼術、白術益氣,使脾氣以運,濕邪得除;炙甘草補脾益氣,緩急止痛,調和諸藥。諸藥合用,共奏健脾行氣、祛濕止瀉之功。
以TNBS灌腸復制UC大鼠模型,依據的是TNBS在體內與蛋白結合后成為抗原,可引起免疫反應,誘導結腸炎癥的發生。本研究結果也顯示,與空白組大鼠比較,模型組大鼠血清中IL-1β及NO水平升高,IL-10水平降低,結腸組織中MDA及MPO水平升高,SOD水平降低。而經過化濕湯灌胃治療后,大鼠血清中IL-1β及NO水平降低,IL-10水平升高,結腸組織中MDA及MPO水平降低,SOD水平升高,且高劑量效果更明顯。綜上所述,化濕湯治療UC模型大鼠療效確切,可明顯改善大鼠臨床癥狀,改善病變結腸組織病理形態,其作用機制可能與抑制炎性反應,減輕氧化損傷有關,且高劑量效果更好。

