施氏假單胞菌氮代謝調控蛋白GlnK與碳信號分子α-酮戊二酸的體外互作研究
王珊珊,毋少宇,劉一超,戰崳華,柯秀彬,陸偉,燕永亮
中國農業科學院生物技術研究所, 北京 100081
PⅡ蛋白廣泛分布于古細菌、細菌和高等植物中,是較為古老的蛋白家族之一[1]。長期以來,PⅡ蛋白GlnB、GlnK被認為是氮代謝系統的關鍵信號轉導蛋白,通過感知并傳遞細胞內的碳氮代謝信號,級聯調控glnKamtB、nifLA和nifHDK等固氮相關基因表達[2-3]。谷氨酰胺是氨同化的主要產物,也是細胞內氮狀態的主要指標。PⅡ蛋白在固氮網絡中的信號轉導功能,一方面由谷氨酰胺濃度介導,另一方面還受碳信號α-酮戊二酸濃度的影響,二者都可以改變PⅡ蛋白的構象,影響其與相應蛋白靶標的結合,最終達到級聯調控固氮網絡的作用[4-5]。細胞內α-酮戊二酸的濃度不僅表示細胞的碳狀態,還可以衡量細胞的氮可用性,在碳氮代謝平衡中發揮重要的作用[6-7]。PⅡ蛋白可以與α-酮戊二酸結合,每個蛋白含有3個α-酮戊二酸結合位點,不同細胞狀態的PⅡ蛋白結合α-酮戊二酸數量不同,具有α-酮戊二酸傳感器的功能。在PⅡ蛋白穩定的三聚體內,具有序列保守、結構靈活的T環、B環與C環,三環之間可以形成亞基間的裂縫,構成了蛋白質與配體結合的位點[8]。α-酮戊二酸主要結合于相鄰亞基之間的外側裂隙中,一般需要二價陽離子(如Mg2+)的參與。
施氏假單胞菌(Pseudomonasstutzeri)A1501是γ變形桿菌中的聯合固氮菌,固氮過程受到嚴格的調控,大多數細菌中含有GlnB與GlnK 2種PⅡ蛋白,但在該菌中僅存在唯一的PⅡ蛋白GlnK,編碼該蛋白的glnK基因突變后,固氮酶活完全喪失,表明該蛋白在固氮調控中具有十分重要的作用[9]。但是A1501菌中GlnK蛋白與信號分子互作機制尚不清楚,需要進一步的研究。本研究通過異源表達GlnK蛋白并采用微量熱涌動技術體外檢測了GlnK及突變蛋白與碳信號分子α-酮戊二酸的互作,以期了解A1501中碳信號分子α-酮戊二酸與關鍵調控蛋白的信號轉導過程,進一步解析固氮菌的碳氮代謝偶聯機制。
1 材料與方法
1.1 菌株、質粒及培養條件
施氏假單胞菌A1501、原核表達載體pET28a為本實驗室保存;高頻轉化受體菌株Top10、BL21(DE3)購自北京康為世紀生物技術公司。大腸桿菌培養采用LB培養基(0.5%酵母提取物,1%胰蛋白胨,1%氯化鈉及蒸餾水),37 ℃培養。
1.2 主要試劑及儀器
質粒小提試劑盒、DNA凝膠回收試劑盒及細菌DNA提取試劑盒購自上海美吉生物醫藥科技有限公司;無縫克隆試劑盒購自中美泰和生物技術(北京)有限公司;普通Taq酶GreenTaqMix及高保真DNA聚合酶Phanta購自南京諾唯贊生物科技股份有限公司;內切酶購自美國NEB公司;His Pur Ni-NiA瓊脂糖樹脂購自賽默飛世爾;TGX Stain-Free丙烯酰胺免染制膠試劑盒購自美國Bio-Rad公司;α-酮戊二酸標準品購自美國Sigma公司;蛋白標記試劑盒、優化毛細管均購自德國Nano Temper公司;實驗涉及到的引物合成及測序均由生工生物工程(上海)股份有限公司完成。
Eppendorf 5424低溫離心機(德國Eppendorf公司);HITACHI U-3010紫外分光光度計(日本HITACHI公司);Branson Digital SFX550超聲波破碎儀(美國Branson公司);Bio-Rad Gel Doc XR+凝膠成像系統(美國Bio-Rad公司);Bio-Rad Mini-Protean 3 Electrophoresis System蛋白質電泳儀(美國Bio-Rad公司);Bio-Rad GeneAmp PCR System 9700 PCR儀(美國Bio-Rad公司);Biotek Cytation 5細胞成像微孔板檢測系統(美國Biotek公司);Nano Temper Monolith NT.115微量熱泳動儀(德國Nano Temper公司)。
1.3 GlnK蛋白的生物信息學分析
從Uniprot(www.uniprot.org)獲得施氏假單胞菌A1501中glnK基因序列和GlnK蛋白的氨基酸序列及蛋白質分子量大小,利用NCBI和軟件DNAMAN、MEGA7進行多序列比對、同源性分析及系統發育樹的構建;利用Swiss modle(https://swissmodel.expasy.org)進行GlnK蛋白同源建模,利用VMD軟件進行特定氨基酸顯示。
1.4 GlnK、GlnK-G89A蛋白表達重組載體的構建
本研究以pET28a為目的載體,通過同源重組原理設計擴增目的片段的引物,利用無縫克隆試劑盒將目的片段與pET28a載體相連,最終通過大腸桿菌BL21(DE3)外源表達GlnK與GlnK-G89A蛋白。具體構建過程如下:選擇pET28a載體的BamHⅠ和NdeⅠ作為glnK基因與GlnK蛋白G89位點突變為丙氨酸(Ala,A)的基因glnK-G89A的插入位點,根據同源重組原理設計相關基因引物(表1)。GlnK蛋白的G89位點所對應的堿基序列為基因的第265~267位的GGC,為了獲得glnK-G89A基因片段,需將該位點突變為A,該氨基酸的密碼子有GCU、GCC、GCA、GCG,在A1501的glnk序列中GCC較多,因此本研究選擇將原堿基序列GGC突變成GCC。將含有突變位點的glnK基因片段前部分命名為glnk-G89A-1基因,含有突變位點的glnK基因片段后部分命名為glnk-G89A-2基因。利用引物GlnK-G89A-F1與GlnK-G89A-R1擴增glnk-G89A-1基因,利用引物GlnK-G89A-F2與GlnK-G89A-R2擴增glnk-G89A-2基因,最終通過引物GlnK-G89A-F1與GlnK-G89A-R2融合PCR得到含有突變位點的整個基因片段。單片段PCR反應體系(共50 μL):含50~100 ng的A1501基因組1 μL,上、下游引物各1 μL,高保真DNA聚合酶25 μL,ddH2O 22 μL。融合PCR反應體系(共50 μL):擴增得到的glnK-G89A-1和glnK-G89A-2基因產物各1 μL,上、下游引物各1 μL,高保真DNA聚合酶25 μL,ddH2O 22 μL。載體構建中涉及的PCR反應程序為:95 ℃預變性5 min ;95 ℃ 變性30 s,55 ℃退火30 s(所有基因片段,包括融合PCR,退火溫度與時間相同),72 ℃延伸 3 min,30個循環 ;72 ℃終延伸5 min。載體與目的基因片段連接后轉化至大腸桿菌Top10中獲得克隆重組載體,測序成功后,提取質粒轉化至大腸桿菌BL21(DE3)獲得GlnK、GlnK-G89A蛋白表達菌株。

表1 實驗所用引物列表Table 1 PCR primers used in this work
1.5 GlnK、GlnK-G89A蛋白誘導表達純化
將37 ℃過夜培養的含有GlnK、GlnK-G89A蛋白表達載體的大腸桿菌按1%的接種量接種至含50 μg·mL-1卡那霉素(kanamycin,Km)的新鮮LB液體培養基中,37 ℃培養至OD600為0.8左右,加入IPTG使其終濃度為0.1 mmol·L-1,16 ℃、200 r·min-1培養15 h,誘導蛋白表達。5 000 r·min-1離心10 min收集菌體,加入1/20體積NTA Buffer(300 mmol·L-1NaCl,50 mmol·L-1NaH2PO4,pH 7.5)重懸菌體,超聲破碎細胞(超聲波破碎儀工作程序:工作3 s,間隔5 s,功率為30%,工作時長為10 min),12 000 r·min-1、45 min離心收集上清。分別使用鎳柱親和層析純化GlnK與GlnK-G89A蛋白,使用不同咪唑濃度(10、20、60、80 和200 mmol·L-1)的NTA緩沖液梯度洗脫,EP管分別收集各梯度洗脫液,SDS-PAGE電泳檢測蛋白純化情況,確定最終洗脫濃度,大量收集GlnK、GlnK-G89A融合蛋白,采用Brandford法測定蛋白濃度,-80 ℃保存備用。
1.6 GlnK、GlnK-G89A與碳信號分子α-酮戊二酸的互作分析
利用蛋白標記試劑盒進行標記已經純化的GlnK、GlnK-G89A蛋白,首先利用試劑盒中的Labeling Buffer置換掉目的蛋白所處的緩沖液環境,利用細胞成像微孔板檢測系統測定Labeling Buffer中目的蛋白的濃度,利用公式C(μmol·L-1)=蛋白(mg·mL-1)×103/分子量(kD)計算交換完Buffer的目的蛋白的濃度;根據試劑盒熒光標記體系標記各蛋白。利用微量熱泳動(microscale thermophoresis,MST)儀器的Pretest模塊檢測蛋白的熒光標記效率,檢測合適后進行蛋白與α-酮戊二酸互作體系準備。準備16個PCR小管,1~16進行標號,向各管中加入10 μL MST Buffer,取10 μL用蒸餾水稀釋好的α-酮戊二酸(pH 7.8)加入1號小管中,吸吹混勻30次,再取10 μL 1號管中混好的液體加入2號管中,吸吹混勻30次,依次2倍梯度稀釋配體,最后一管吸吹混勻完畢后吸取10 μL混合液丟棄。依次向稀釋好的各PCR管中加入10 μL標記好的且熒光檢測合格的目的蛋白,吸吹混勻30次。向1~16號小管中放入毛細管將反應體系吸入其中。將吸滿液體的1~16號毛細管依次放置于檢測板,最終將檢測板放入MST儀器中進行檢測。
2 結果與分析
2.1 GlnK蛋白的生物信息學分析
A1501中glnK基因全長339 bp,編碼蛋白含有112個氨基酸,預測分子量為12.286 kD。為了分析A1501中GlnK蛋白與其他不同屬菌株蛋白的親源關系,采用Blastp程序以A1501的GlnK氨基酸序列,與NCBI的UniProtKB/Swiss-Prot(swissport)數據庫進行了序列比對,選擇序列一致性高于70%的13個來自不同屬菌株的蛋白序列進行了進化分析,利用MEGA7軟件的非加權組平均(UPGMA)方法構建系統發育樹,選擇步長檢驗方法(Bootstrap method)對構建好的進化樹進行檢驗,檢驗次數設置為500次。建樹結果如圖1所示。結果表明,A1501中GlnK蛋白與模式固氮菌棕色固氮菌(Azotobactervinelandii)的親源關系最近,序列一致性可達96.43%,其次為大腸桿菌(Escherichiacoli)和肺炎克雷伯菌(Klebsiellapneumoniae),序列一致性分別為78.57%和76.79%,表明A1501中GlnK蛋白與棕色固氮菌中同源蛋白在各自體內發揮的功能可能最為相似。
利用軟件MEGA7中的Clustal W對GlnK蛋白系統發育樹構建過程中涉及的不同屬菌株的氨基酸序列進行多序列比對,結果如圖2所示,A1501中GlnK蛋白與其他12個不同屬菌株中的同源蛋白相似,都具有較多的保守位點。在該蛋白中也包含PⅡ蛋白最保守的TGxxGDGKI基序,大腸桿菌點突變實驗表明第89位點甘氨酸(Gly,G)的突變會使PⅡ蛋白在任何條件下都無法與小分子物質α-酮戊二酸結合,而該位點位于該基序的第7位,這表明了G89位點可能在PⅡ蛋白與α-酮戊二酸結合的過程中具有十分重要的作用。
為了進一步的了解G89位點在A1501的GlnK蛋白空間結構中所處的位置,利用Swiss-model在線建模服務器(https://swissmodel.expasy.org)的簡捷模式(automatic mode)對GlnK蛋白進行結構預測,將編碼GlnK蛋白的氨基酸序列通過網頁提交,服務器自動在蛋白質數據庫(PDB)中為目標序列尋找已知結構的同源蛋白,并以此作為模板,為A1501的GlnK蛋白建立結構模型,預測得到了多個GlnK蛋白同源模型且均完全覆蓋該蛋白的所有氨基酸序列。選擇與GlnK蛋白序列相似性最高的1glnk.2.A(存在于大腸桿菌)為建模模板,二者序列一致性可達78.8%,可信性較高。建模結果利用VMD蛋白結構可視化軟件重新顯示后如圖3所示,此結構表明A1501的GlnK為同源三聚體結構,由多個α螺旋、β折疊和環狀結構所組成,與已經報道的PⅡ蛋白的結構相似。α-酮戊二酸可以與PⅡ蛋白結合,一般結合位點位于蛋白環與環形成的裂縫中。在同源建模所得的GlnK蛋白三維結構可知,G89位于一個β折疊之上,較接近于環狀區域。可能與環與環之間含有的由共價鍵形成的α-酮戊二酸結合位點相關,此處氨基酸的改變可能會影響原有蛋白與α-酮戊二酸的共價結合。

圖1 系統發育分析GlnK同源蛋白在不同物種中的遺傳與進化距離Fig.1 Phylogenomic analysis depicting the genetic and evolutionary distances of GlnK homologous proteins in different species
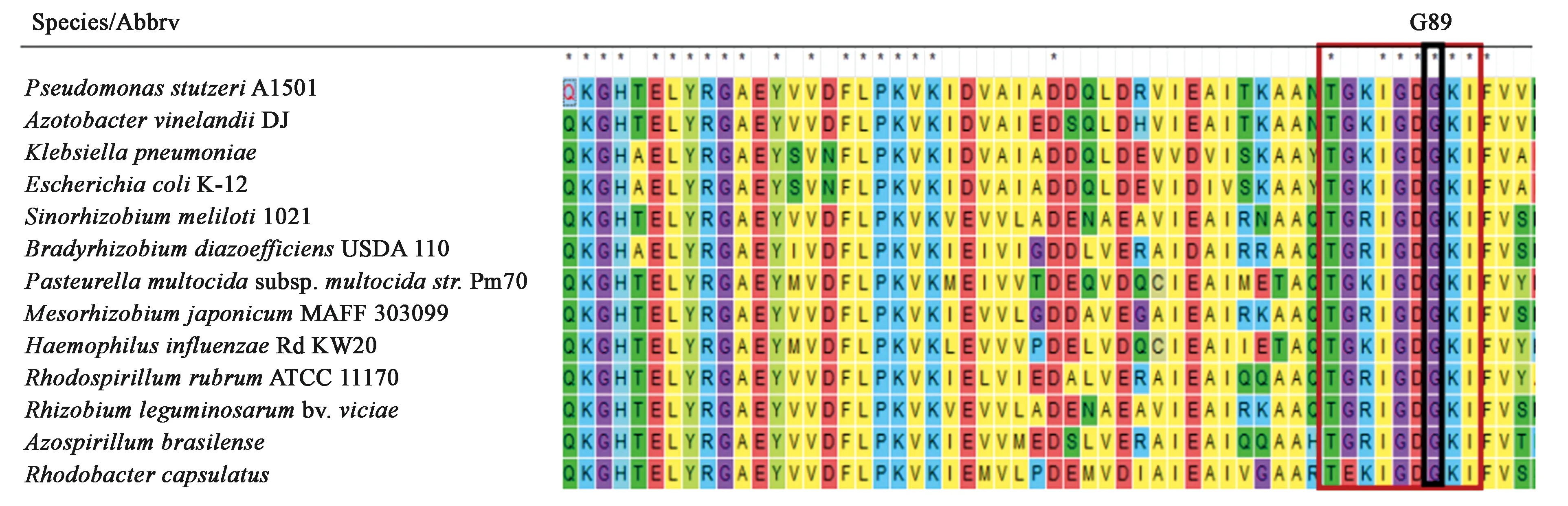
注:紅色框標記序列為GlnK蛋白最保守基TGxxGDGKI,黑色框標記為G89。圖2 利用CLUSTAL W對不同物種中GlnK同源蛋白的序列比對Fig.2 CLUSTAL W alignment of GlnK homologous proteins from different species
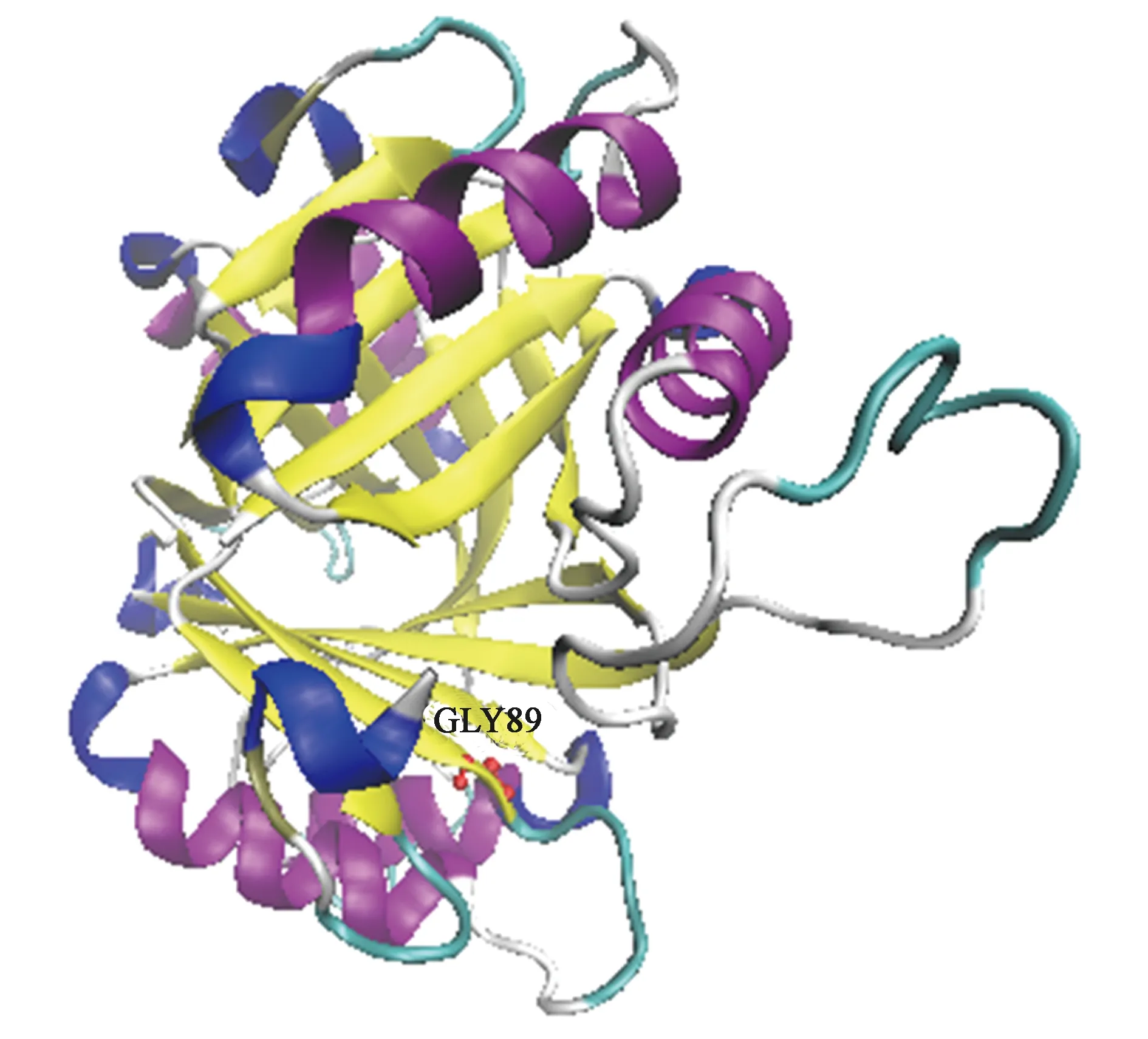
注:紅色球棍為保守的GLY89。圖3 側面觀察GlnK的晶體結構Fig.3 The crystal structure of GlnK viewed from the side
2.2 GlnK、GlnK-G89A蛋白的表達與純化
為了體外得到GlnK與GlnK-G89A蛋白,構建了重組載體pET28a-glnk及pET28a-glnk-G89A,轉化到宿主菌BL21(DE3)后PCR結果驗證如圖4、圖5所示。PCR擴增片段與各目的基因片段大小一致,經測序比對為含有特定的glnK基因片段,表明表達GlnK、GlnK-G89A蛋白的菌株構建成功。隨后對GlnK及GlnK-G89A蛋白進行誘導表達純化,分別以未誘導的含有pET28a-glnK及pET28a-glnk-G89A重組載體的表達菌體為對照。SDS-PAGE凝膠電泳發現二者只有在200 mmol·L-1咪唑洗脫時分別在標準蛋白Marker的10~15 kDa處有一蛋白條帶,與GlnK蛋白的分子量12.286 kDa大小較為符合,為目的條帶,表明GlnK、GlnK-G89A蛋白在含有200 mmol·L-1咪唑的NTA緩沖液中被洗脫下來,并且洗脫后電泳背景清晰,沒有其他的蛋白質條帶,如圖6、7所示,表明分離后的目的蛋白純度較高。
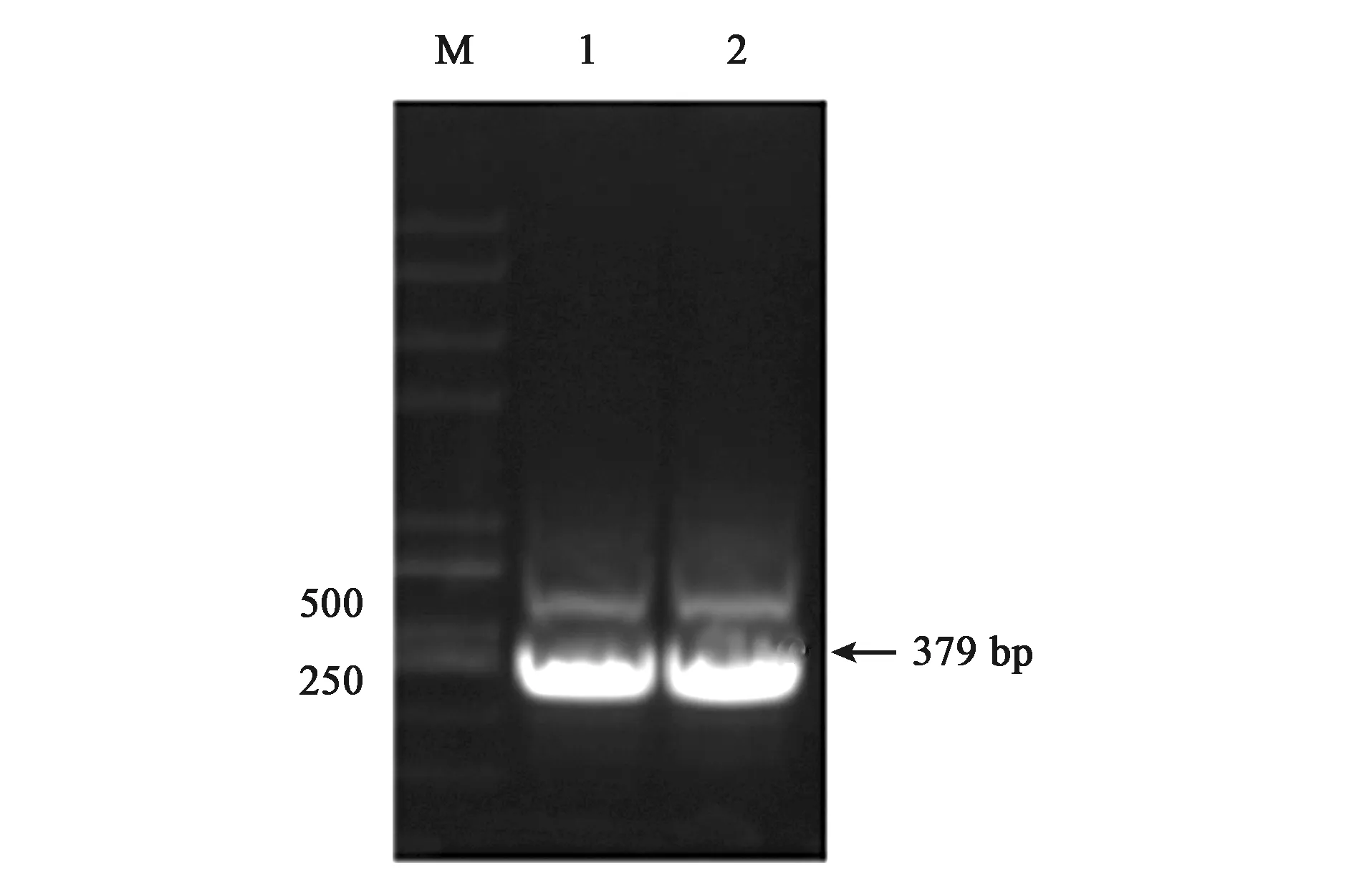
注:M—Trans2K PlusⅡ DNA Marker,1~2—全長glnk基因PCR擴增產物。圖4 重組載體pET28a-glnk PCR驗證Fig.4 Verification of recombinant pET28a-glnk prokaryotic expression vector
2.3 GlnK及GlnK-G89A蛋白與小分子物質α-酮戊二酸的體外互作
利用MST對GlnK、GlnK-G89A蛋白與小分子物質α-酮戊二酸的體外互作進行探索,2個蛋白在MST Buffer存在下,利用優化毛細管進行互作實驗效果最好,不易發生吸附、聚集現象,可能是由于GlnK、GlnK-G89A蛋白的特殊生理特性所造成的。GlnK、GlnK-G89A蛋白與α-酮戊二酸MST互作結果如圖8所示,當反應體系中GlnK蛋白濃度為1.55 μmol·L-1、α-酮戊二酸最高濃度為1.25 mmol·L-1時,可以擬合出S型曲線,信噪比為7.3,說明二者可以結合,Kd值為(9.75±4.72) μmol·L-1;而GlnK-G89A蛋白與α-酮戊二酸互作,卻無法擬合出S型曲線,不能判定二者發生了結合。表明GlnK蛋白在體外可以與α-酮戊二酸結合,G89位點可能與二者互作有關,這也進一步的說明了在A1501菌中GlnK可能通過與α-酮戊二酸互作,從而參與固氮調控過程。
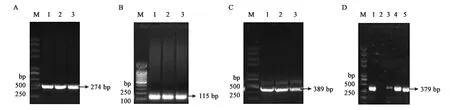
A:glnk-G89A-1基因片段擴增;B:glnk-G89A-2基因片段擴增;C:glnk-G89A-1與glnk-G89A-2片段的融合;D:重組載體pET28a-glnk-G89A PCR驗證;M—Trans2K Plus II DNA Marker;圖中數字均代表相應的PCR產物。圖5 pET28a-glnk-G89A重組載體的PCR驗證Fig.5 Verification of recombinant pET28a-glnk-G89A prokaryotic expression vector
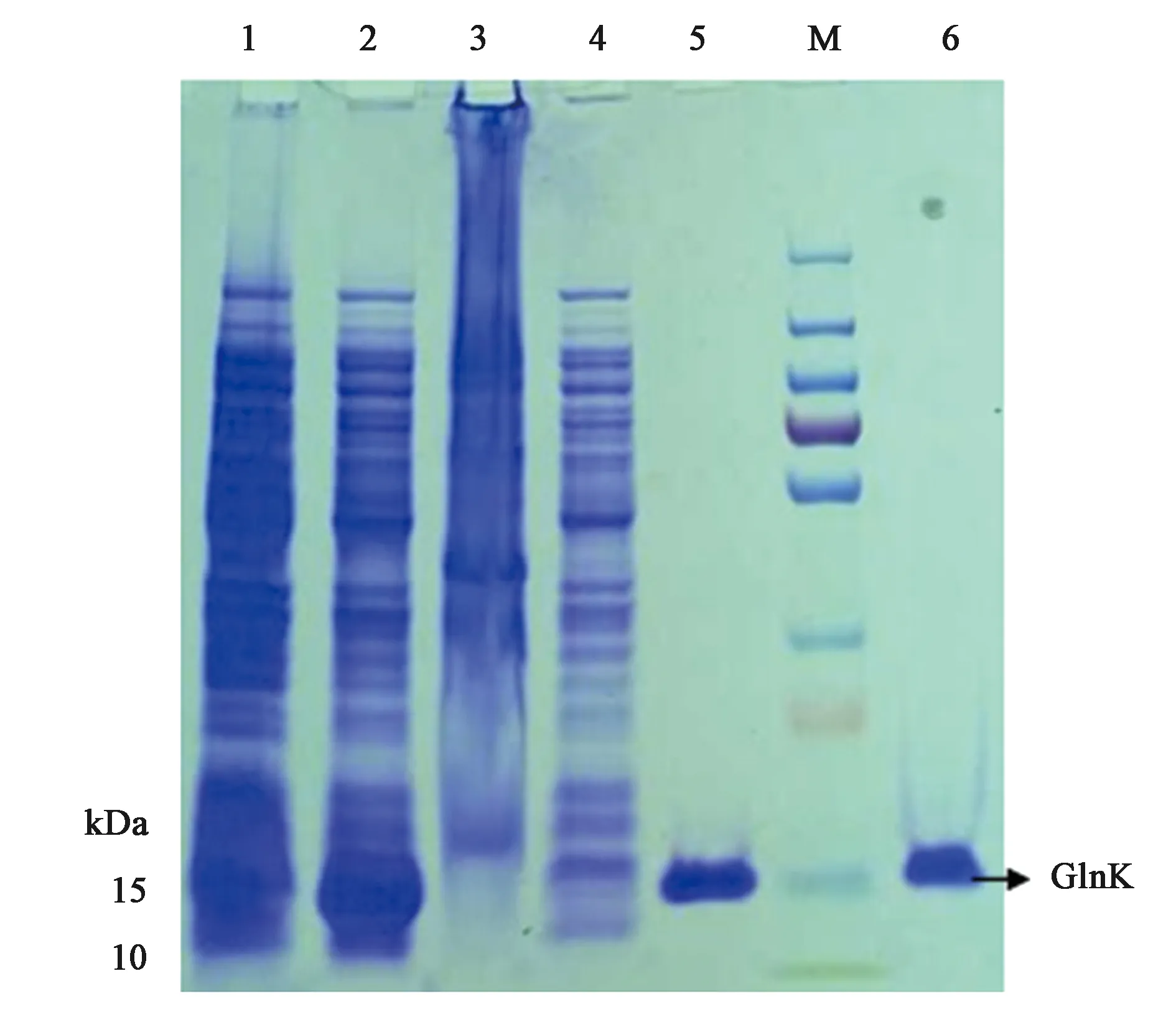
注:M—標椎蛋白分子量Marker(kD);1—未誘導細胞;2—破碎后上清;3—破碎后沉淀;4—破碎后上清第一次過分離柱濾液;5~6—洗脫液中的GlnK蛋白。圖6 SDS-PAGE分析GlnK蛋白純化Fig.6 SDS/PAGE analysis of the purification of GlnK
3 討論
PⅡ蛋白在大多數生物中結構較為保守,在GlnB/K亞家族中,一級氨基酸序列通常含有112個氨基酸,高級結構呈現較為統一的結構構像。大腸桿菌PⅡ蛋白三聚體通常形成約30 A°的緊湊桶,每個單體包含2個α螺旋和6個β折疊,對于T環、B環與C環的穩定具有十分重要的作用[10-11]。T環是含有氨基酸最多的環,在大多數情況下,該環為PⅡ蛋白與其他靶蛋白相互作用的表面,該蛋白與小分子物質α-酮戊二酸、ATP等配體結合后會影響T環的構像,進而影響該蛋白與其他靶標蛋白的結合。B環與C環較小,B環位于中央核心位置,含有十分保守的Walker A基序,而C環的Arg101和Arg103也是PⅡ蛋白中較為保守的集團[12]。PⅡ與α-酮戊二酸的結合是該蛋白的一般特性,不同的生物體中也存在差異,研究表明枯草芽孢桿菌(Bacillussubtilis)中GlnK只能較弱的結合α-酮戊二酸,而古生菌(Archaeoglobusfulgidus)中未發現GlnK2與α-酮戊二酸的結合,但該菌的GlnK3卻可以與α-酮戊二酸結合[13-14]。
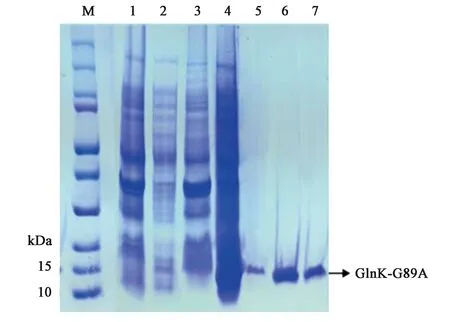
注:M—標準蛋白分子量Marker(kD);1—未誘導細胞破碎后沉淀;2—未誘導細胞破碎后上清;3—誘導細胞破碎后沉淀;4—誘導細胞破碎后上清;5~7:洗脫液中的GlnK-G89A蛋白。圖7 SDS-PAGE分析GlnK-G89A蛋白純化Fig.7 SDS/PAGE analysis of the purification of GlnK-G89A
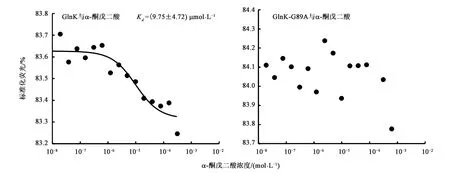
圖8 α-酮戊二酸分別與GlnK蛋白、GlnK-G89A蛋白結合能力鑒定Fig.8 Determination of the binding affinity of α-ketoglutarate to GlnK and GlnK-G89A respectively by microscale thermophoresis
聯合固氮菌施氏假單胞菌A1501,唯一的PⅡ蛋白GlnK在固氮調控中具有十分重要的作用,通過與其他菌株進行系統發育分析發現該菌與棕色固氮菌(Azotobactervinelandii)的親源關系最近,其次為大腸桿菌(Escherichiacoli)和肺炎克雷伯菌(Klebsiellapneumoniae),而與巴西固氮螺菌(Azospirillumbrasilense)進化關系相對較遠,可能A1501中GlnK與α-酮戊二酸結合位點與大腸桿菌的較為相似。在巴西固氮螺菌的PⅡ蛋白中,Lys58可以與α-酮戊二酸的羧基端形成鹽橋,Gln39為Mg2+提供第六配體,α-酮戊二酸、ATP與Mg2+三者共同結合于PⅡ蛋白相鄰亞基的裂縫及側向裂縫中[15]。在古生菌與細長聚球藻中α-酮戊二酸與PⅡ的結合位點與之相似,在PⅡ蛋白中Gln39與Lys58都較為保守,可能與α-酮戊二酸結合有關[16-17]。大腸桿菌PⅡ蛋白突變研究表明Gln39位點突變后,雖嚴重的影響了該蛋白的尿苷酰化修飾,但只在一定程度上影響了與α-酮戊二酸的相互作用,而Gly89位點突變后,PⅡ蛋白在任何條件下都不能與α-酮戊二酸和ATP結合[18]。Gly89位點十分保守,處于PⅡ蛋白最保守的區域之一的Walker A基序TGxxGDGKI之中,可能與α-酮戊二酸和ATP結合有關[19]。將A1501的GlnK蛋白與其他菌的蛋白序列比對發現,GlnK也含有Walker A基序TGxxGDGKI,G89位點位于第7位。對GlnK蛋白進行同源建模,結果表明該蛋白為同源三聚體,該建模結果與模板相似度可達78.8%,表明該蛋白與已報道的PⅡ蛋白結構較為一致。
為了解析碳信號分子α-酮戊二酸在A1501中的信號傳導機制,本研究采用微量熱泳動技術對GlnK蛋白與碳信號分子α-酮戊二酸的體外互作進行研究,該技術與經典的研究分子互作的等溫量熱滴定儀(isothermal titration calorimetry,ITC)相似,靈敏度高且操作簡便,并且本方法較接近天然的測定環境,可以快速的檢測離子、片段、大分子等各種生物分子之間的相互作用,是一種新的檢測生物分子互作技術[20-21]。微量熱泳動結果表明A1501的GlnK可以與α-酮戊二酸體外結合,并且與大腸桿菌相似,G89位點在結合的過程中起關鍵作用。本研究將G89位點突變為了A,根據K-D法所定義的20種氨基酸疏水特性的參數表[22]發現G疏水性參數為0.4,而G89突變后的A為1.8,疏水性增加,更加容易暴露于蛋白質表面,可能對結合于環與環裂縫的α-酮戊二酸產生了空間位阻,影響了二者的結合。然而該位點突變是否影響GlnK蛋白在固氮調控中的作用,還需進一步研究證實。但該結果為進一步的解析碳信號分子α-酮戊二酸在A1501中的信號轉導奠定了基礎,也為深入解析不同固氮菌的碳氮代謝偶聯機制提供了理論支持。

