肺外結核病微生物學診斷方法的研究和應用進展
玄琦月,韓雪,付英梅,2*
1.哈爾濱醫科大學微生物學教研室, 黑龍江省感染與免疫重點實驗室, 哈爾濱 150081;2.哈爾濱醫科大學伍連德研究所, 哈爾濱 150081
肺外結核病(extrapulmonary tuberculosis, EPTB)是指由結核分枝桿菌(Mycobacteriumtuberculosis, MTB)感染所引起的發生在肺部以外器官和部位的結核病,可累及人體的任何部位,胸膜、淋巴結和骨是EPTB最常見的病變部位,其次可見于腸道、腹膜、腎、生殖系統、腦膜等。EPTB目前沒有統一的分類標準,世界衛生組織(World Health Organization,WHO)對EPTB診斷的一般標準為:標本MTB培養陽性;或組織學檢測MTB陽性;或與活動性EPTB一致的典型臨床證據[1]。
根據WHO 2020年公布的全球結核病報告,2019年,全球新發結核病約7 100萬例,其中16%為EPTB,東亞和南亞地區EPTB的比率較高,為19%[2]。我國是全球22個結核病高負擔國家之一,EPTB的發病率也較高。天津市2015—2017年登記報告的新發EPTB共1 190例,占全部結核的10.4%,三年間,EPTB的總發病率從2.05/10萬上升到3.24/10萬[3];最新公布的一項研究顯示,近十年間,北京胸科醫院的住院結核患者中,EPTB占33.4%[4]。
早期診斷的EPTB患者,經正規抗結核治療多可治愈,但未得到早期有效治療的EPTB患者,可導致多種嚴重后果,例如,中樞神經系統結核有較高的死亡率,患者可在發病后的8~11周死亡[5-6];骨關節結核可并發畸形、截癱、甚至死亡[7];泌尿系統結核可并發膀胱攣縮、腎功衰竭等[8]。以前認為EPTB的傳染性不強,但新近研究發現,EPTB也具有一定傳染性[9]。因此,及早對EPTB做出有效診斷,有助于提高疾病治愈率、降低死亡率。目前,EPTB診斷的主要依據為臨床表現和病原學檢查,而多數EPTB患者的癥狀不典型,臨床和影像學表現可與多種其他疾病相似,因此,微生物學檢測方法對EPTB的診斷至關重要。近年來,EPTB的病原學檢測方法得到了快速的發展,除了傳統的細菌學檢查方法,標本中MTB抗原和核酸的檢測對EPTB的早期和快速診斷提供了豐富的參考證據。本文總結了近年來EPTB細菌學檢查方法、MTB抗原檢測與分子生物學檢測等微生物學診斷方法的概況及近年來的應用進展,并對這些檢測方法的特點、優劣勢和適用范圍等進行了分析、比較,以期為今后EPTB病原學診斷的研究提供相關信息。
1 細菌學檢查方法
細菌學檢查方法雖然總體陽性率不高,但仍是目前診斷結核病的主要方法,主要包括改良的涂片鏡檢法和MTB培養法。
1.1 涂片鏡檢法
涂片鏡檢法是國內外普遍應用的EPTB實驗室檢查方法,但因EPTB患者的體液樣本中細菌數量少,傳統的染色涂片法檢出率較低,多使用改良抗酸染色法與液體快速培養法以提高MTB檢出率。改良抗酸染色法是先將樣品置于Cytospin4型細胞離心涂片機中離心濃集菌,然后再使用抗酸染色劑染色[10]。在腦脊液樣本的檢測中,Cytospin制片染色法不僅提高了細胞外MTB的檢出率,還可檢出白細胞內的細菌[10]。但Cytospin制片染色法要求腦脊液中有足夠的MTB細菌數量,通常要求在5 000~50 000個·mL-1[11],而臨床上很多情況下,腦脊液含菌量平均僅10個·mL-1左右[12],所以,該法對結核性腦膜炎患者腦脊液中細菌的總檢出率僅在10.0%~20.0%[13]。此外,熒光染色技術也被應用于EPTB的檢查中,其是將抗酸染色法的復紅改為金胺類,借助熒光顯微鏡觀察,可將結核性腦膜炎細菌的檢出率提高至79.2%,特異度也顯著高于Cytospin制片染色法[14]。
1.2 MTB培養法
MTB培養法包括羅氏培養法和液體快速培養法。目前廣泛使用的是液體快速培養法,BACREC MGIT 960液體快速培養法的敏感度和特異度分別達43.7%和93.0%[15]。聯合顯微鏡觀察藥物敏感度檢測技術(microscopic observation drug susceptibility assay, MODS)可同時檢測MTB的存在及其藥物敏感性,其主要原理是利用MTB在適宜的液體培養基中生長速度快于固體培養基、且可形成特征性索狀結構的特性,采用添加抗結核藥物的液體培養基對標本進行直接培養,通過顯微鏡觀察特征性索狀結構,以判斷標本中是否存在MTB[16]。
2 MTB抗原檢測
EPTB患者的體液標本中含菌量較低,導致細菌學檢查方法敏感度低、特異度差,且培養法耗時較長,無法快速對EPTB患者進行診斷。而抗原檢測是檢測MTB特異性分泌蛋白或其細胞壁的特異性脂質成分[17-18],對標本含菌量的要求不高,且早期即可診斷。目前在診斷研究中使用較多的抗原包括MPT64、抗原85B(antigen 85B, Ag85B)、脂阿拉伯甘露糖(lipoarabinomannan, LAM)、早期分泌性抗原靶-6(early secretory antigenic target-6, ESAT-6)等,研究者對單一抗原和多抗原聯合的診斷效能都進行了測試。
2.1 單一抗原檢測
2.1.1MPT64檢測 MPT64是發現最早的MTB特異性分泌蛋白,僅存在于結核分枝桿菌復合物(mycobacterium tuberculosis complex, MTBC)中[17]。利用免疫細胞化學染色(immunocytochemistry, ICC)方法檢測MPT64抗原是一種簡單而直接的方法,可用于EPTB的早期診斷。Davidsen等[19]收集了67例結核性淋巴結炎患者的淋巴活檢標本,利用ICC法檢測MPT64抗原,發現敏感度和特異度可達69.0%和95.0%。Purohit等[20]的研究結果也同樣顯示了MPT64抗原檢測的高敏感度(96.0%)與高特異度(96.0%)。最近挪威的一項研究發現,MPT64抗原的檢測還可用于福爾馬林固定的活檢標本,敏感度為37%,盡管其敏感度不如培養法(50%),但其診斷效能優于細針穿刺和膿汁等液體樣本的檢查,為病理學實驗室的病原學診斷提供了快速、特異的診斷參考[17]。
2.1.2Ag85B檢測 Ag85B存在于MTB分泌蛋白中,可與人纖維結合蛋白結合,與MTB致病性密切相關[21]。Singh等[22]開發了一種新型的間接夾心免疫聚合酶鏈式反應(immuno-PCR,I-PCR)檢測法,該方法兼具PCR的指數擴增能力和酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)的靈活性,對105例EPTB患者的胸水、膿汁等液體樣本分別以I-PCR方法和傳統的ELISA法檢測Ag85B,結果發現,總體敏感度分別為68.6%和52.4%,特異度分別為92.0%和96.0%,但I-PCR檢測Ag85B可以更快速地獲得結果,且I-PCR檢測Ag85B的檢出限為1 fg·mL-1,能檢出比ELISA方法低106倍的抗原量,敏感度更高。
2.1.3LAM檢測 LAM是MTB細胞壁的一種脂多糖,尿脂阿拉伯甘露糖測定法(lateral flow urine lipoarabinomannan assay, LF-LAM)是一種新型的即時檢驗方法,可檢測活動性結核病患者尿中的LAM。研究表明,聯合使用LF-LAM與痰涂片鏡檢法檢測MTB的合并敏感度為59.0%,比單獨使用涂片法提高了19.0%,而特異度為92.0%,僅比單獨涂片法降低了6%,說明LF-LAM與痰涂片鏡檢聯合使用有助于結核病的診斷[18]。殷曉云等[23]使用蛋白芯片檢測了74例EPTB患者的血清LAM,結果顯示敏感度為56.8%,特異度為83.2%,提示LAM檢測對較難診斷的EPTB有重要意義。
2.1.4ESAT-6檢測 ESAT-6是由MTB短期培養濾液純化而來,屬早期特異性分泌蛋白[21]。Mehta等[24]通過I-PCR方法,單獨檢測42例EPTB患者胸水標本中的ESAT-6,結果顯示敏感度為38.1%,特異度為93.3%。
2.2 多種抗原聯合檢測
2.2.1Ag85B、ESAT-6與索狀因子聯合檢測 索狀因子(6,6-雙分枝菌酸海藻糖)是存在于有毒力的MTB細胞壁中的脂質成分[25]。利用I-PCR方法對40例EPTB患者血清中的Ag85B、ESAT-6與索狀因子進行聯合檢測,結果顯示敏感度和特異度分別為77.5%和92.0%[25]。在此研究的基礎上,同樣利用I-PCR方法,對40例EPTB患者的胸膜液標本進行抗原聯合檢測,結果表明其敏感度和特異度為61.9%和92.0%,均低于單獨檢測Ag85B[24]。
2.2.2培養濾液蛋白10與ESAT-6聯合檢測
培養濾液蛋白10(culture filtrate protein-10, CFP-10)也是由MTB短期培養濾液純化而來的,可刺激機體產生特異性抗體[21]。CFP-10和ESAT-6的表達可以作為MTB感染后的早期檢測,對于診斷活動性結核也具有重要意義。基于血清學的方法對21例EPTB患者的血清標本進行抗原聯合檢測,敏感度為85.7%,同時在健康人與高危人群中也表現出了高特異度(87.1%~100%)[26]。
2.2.3結核特異性抗原與植物凝集素比率的檢測 植物凝集素(phytohemagglutiinin, PHA)的值反映了免疫抑制的作用,可用于判斷不同免疫狀態的EPTB患者結核特異性抗原(tuberculosis-specific antigen,TBAg)檢測的可信度[27]。Wang等[28]選擇了CFP-10與ESAT-6聯合抗原作為TBAg,對734例EPTB血清標本通過結核感染T細胞斑點試驗(tuberculous T cell enzyme-linked immuno-spot assay,T-SPOT.TB)的方法分析TBAg/PHA比率,以0.2作為閾值來區分EPTB與非EPTB,結果表明敏感度和特異度為70.8%和91.6%。此外,在抗結核治療期間,TBAg/PHA比率顯著降低,表明該值也可用于監測治療效果[28]。
此外,還可根據結核感染時機體的免疫學反應,通過γ干擾素釋放試驗(interferon-gamma release assay, IGRA)及血清中多種抗體的檢測,對肺外結核進行輔助診斷[23,27]。
3 結核分枝桿菌的分子生物學檢測
分子生物學檢測方法將結核病的診斷提高到了分子和基因的水平。通過直接檢測標本中MTB的特異性靶基因,能夠更敏感、更快速地檢出標本中MTB的核酸成分,大幅度提高診斷的敏感度與特異度。
3.1 實時熒光定量PCR技術
實時熒光定量PCR(realtime fluorescence quantitative PCR, FQ-PCR)技術是在PCR指數擴增期間,通過連續監測熒光信號的變化,并與加入的已知定量標準品比較,來分析目的基因的拷貝數,實現對核酸的實時定量[29]。早期所用的FQ-PCR法檢測的靶標是MTB基因的保守片段,可動態檢測標本中MTB-DNA的含量,不受細菌表型和耐藥性影響[30]。FQ-PCR法用于結核病診斷,其敏感度和特異度明顯高于涂片法,且操作簡便、快速、便于推廣、無須特殊精密儀器,對于結核病尤其是EPTB的診斷具有較高的應用價值。李艷紅等[31]對22例EPTB患者的體液標本同步檢測,結果表明FQ-PCR法的陽性率、敏感度、特異度分別為86.4%、95.0%和100%,高于涂片法的59.0%、60.0%和50.0%。
目前,最常用的FQ-PCR法是Xpert Mtb/RIF [XpertMycobacteriumtuberculosis(MTB)/rifampicin (RIF) assay] 技術,該技術以ropB為靶基因,通過實時熒光PCR擴增,同時檢測MTB和利福平(rifampicin,RIF)耐藥[32]。2013年,WHO建議將Xpert MTB/RIF 用于諸如結核性淋巴結炎和結核性腦膜炎等EPTB的診斷[33]。選取238例EPTB患者的體液標本進行Xpert Mtb/RIF檢測,結果發現總體敏感度為65.5%,特異度為100%,其中膿液標本的敏感度最高,為88.5%,腦脊液標本的敏感度較低,為33.3%[15]。Tadesse等[34]對572例EPTB患者的肺外標本進行檢測,結果發現總體敏感度和特異度為75.0%和98.0%,其中敏感度最高的是淋巴結標本,為89.8%,表明Xpert Mtb/RIF檢測可用于結核性淋巴結炎患者淋巴結標本的初篩。
雖然Xpert Mtb/RIF檢測和結核診斷金標準培養法有很高的陽性一致性,且特異度更高,但Xpert MTB/RIF技術在低細菌負荷下具有較差的敏感性,并且無法區分MTB的活菌和死菌[35-36]。對于骨關節和活檢標本等需要研磨和均質化的標本,敏感性也較差[37]。為了克服這一局限,最近開發了新一代檢測技術Xpert MTB/ RIF Ultra(GX-Ultra),這個方法是在Xpert MTB/ RIF的基礎上,添加了MTBC的2個新靶標(IS1081和IS6119),較大提高了在低細菌負荷下的靈敏度[38-39]。通過GX-Ultra檢測82例涂陰肺外標本的敏感度可達75.9%[40]。使用208例胸膜結核患者的胸膜液標本對Xpert Ultra和Xpert的性能進行分析,Xpert Ultra的敏感性為44.2%,高于Xpert的19.23%,二者特異性均為98.7%[41]。
3.2 DNA探針技術
探針技術主要包括核酸雜交探針、線性探針測定和核酸擴增測試(nucleic acid amplification testing, NAAT)等[42],使用寡核苷酸探針鑒定DNA靶標,這些方法不依賴于核酸擴增來為測試提供足夠數量的靶分子。已經選擇的靶標包括來自16S或23S rRNA基因的基因間隔區(internal transcribed spacer, ITS)、MPB64基因、插入序列986或6110等[43]。Wang等[42]基于插入序列6110開發IS4引物和探針,設計了一種新型實時定量聚合酶鏈式反應的NAAT,并對130例臨床標本進行檢測,結果發現,肺部標本的臨床敏感度和特異度為92.0%和76.9%,肺外標本的臨床敏感度和特異度為92.3%和86.8%。值得注意的是,IS4雖可以區分MTB和非結核分枝桿菌,但不能區分活菌和死菌,因此不適于治療監測。
3.3 實時熒光核酸恒溫擴增檢測技術
實時熒光核酸恒溫擴增檢測技術(simultaneous amplification and testing, SAT)是近年研發的一項技術,以MTB特異的16S rRNA為檢測靶標,在同一溫度(42 ℃)以RNA為起始模板,通過莫洛尼鼠白血病病毒逆轉錄酶(moloney murine leukemia virus,MMLV-RT)產生1個雙鏈DNA拷貝,然后利用T7 RNA多聚酶(T7 RNA polymerase,T7RNP)從該拷貝產生100~1 000個RNA拷貝,通過恒溫RNA擴增技術擴增產物雜交后釋放出熒光信號,對熒光信號進行實時檢測,從而快速準確地判斷待檢樣本中是否有MTB存在[44]。對433例EPTB樣本進行檢測,結果表明,培養法的敏感度和特異度為29.3%和98.0%,而SAT檢測的敏感度和特異度為83.6%和79.4%[45]。由于RNA只存在于活菌中,在疾病活動性、藥物療效檢測方面有較高的臨床價值,且RNA極易降解,可有效避免污染。
3.4 液滴數字PCR技術
液滴數字PCR技術(droplet digital PCR, ddPCR)是最近開發的一種高靈敏PCR方法,可以成功量化結核病患者血液樣本中的CFP-10和結核分歧桿菌Rv1768基因DNA微量拷貝數,且比FQ-PCR更敏感,ddPCR對CFP-10檢測限為1.2拷貝·μL-1,而FQ-PCR為15.8拷貝·μL-1[46]。通過ddPCR對28名肺結核患者及28名EPTB患者的血液標本進行檢測,結果發現肺結核和EPTB標本的敏感度均為100%[47]。ddPCR可在感染3周后檢測到低水平的MTB-DNA,適合用于疫苗開發、體內細菌負荷評估和早期結核病的診斷[46]。
4 不同檢測方法對于診斷EPTB的效能比較
目前,EPTB的微生物學診斷方法主要包括細菌學檢查方法、MTB抗原檢測和MTB核酸檢測,不同檢測方法的優缺點、適用范圍存在差異(表1)。細菌學檢查方法是國內外普遍應用的實
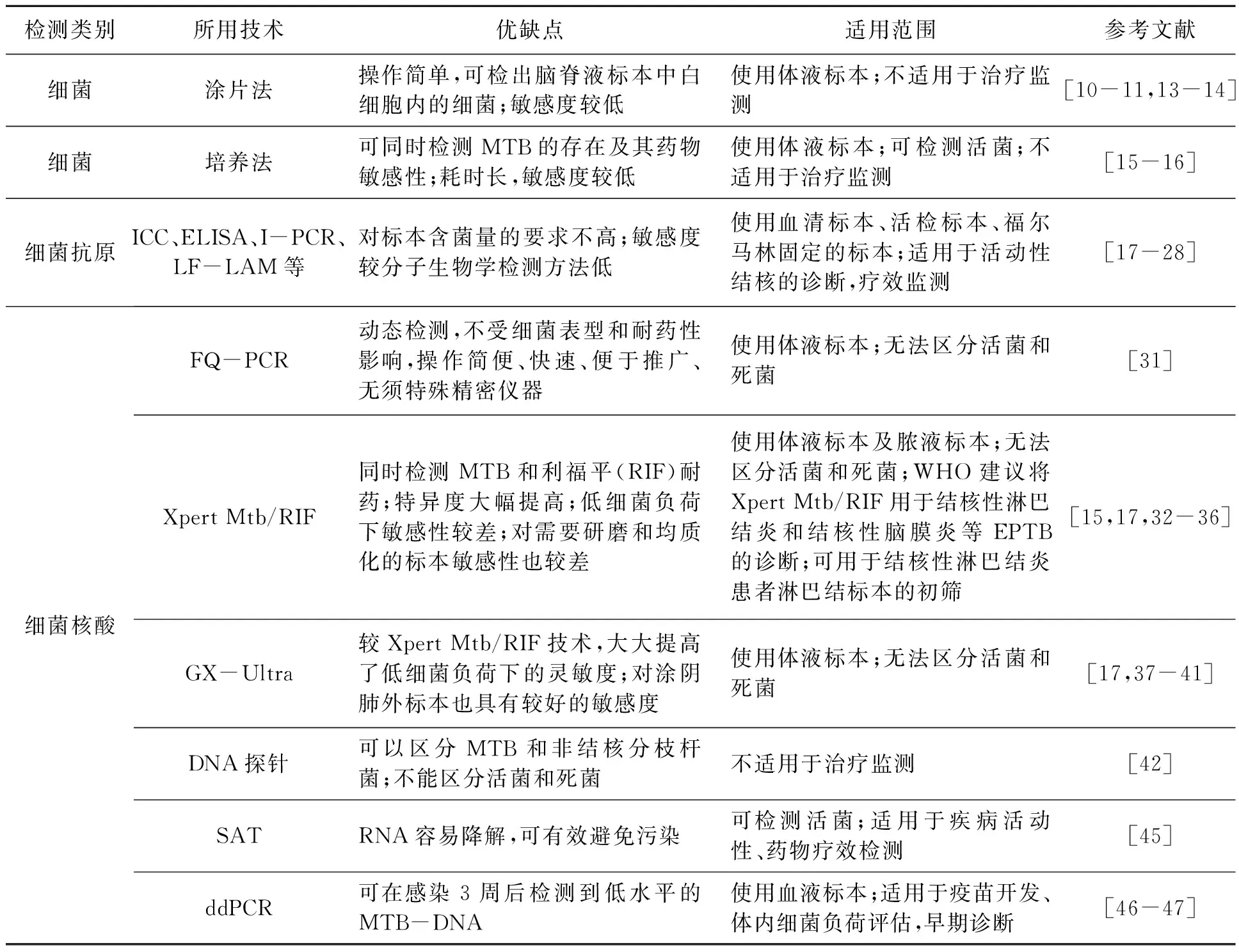
表1 EPTB常用微生物學檢測方法的比較Table 1 Comparison of microbiological detection methods for extapulmonary tuberculosis
驗室檢查方法,但臨床中的標本含菌量較低,難以達到涂片法要求的細菌數量,而培養法耗時較長,不適用于EPTB的快速診斷。抗原檢測可使用血清標本、活檢標本或福爾馬林固定的活檢標本,相較于細菌學檢查方法對標本的含菌量要求不高,且適用于EPTB的早期診斷,但不同的抗原敏感度和特異性仍存在一定差異。核酸檢測能夠更敏感、更快速地檢出標本中MTB的核酸成分,適用于EPTB的早期快速診斷。
5 展望
隨著免疫缺陷和免疫受損人群的增多,MTB的感染率增加,肺外組織和器官的感染也在增加。同肺內結核病相比,EPTB患者缺乏特異性的臨床表現, EPTB的早期診斷是臨床上的一大難題。由于EPTB不同感染部位的限制,在很大一部分病人中不易獲得適于實驗室檢查的標本,因此,探索不受標本類型限制的早期、快速、敏感、特異的新診斷方法,是今后研發新型標志物的方向。另一方面,目前正在研究和應用的診斷技術,對EPTB的診斷效能很大程度上受標本類型、結核病地區負荷的影響,在今后的研究中,應進一步評估影響這些技術診斷效能的因素。在此基礎上,兼顧診斷方法的經濟適用性和使用廣泛性,以提高EPTB實驗室診斷效能,早期、有效地對EPTB進行防控和治療。

