短鏈二烷基多硫的熱裂解
吳明清, 吳曉穎, 潘羅奇, 曾光樂, 李 濤
(1.中國石化 石油化工科學研究院,北京 100083;2.中國石化 大連石油化工研究院,遼寧 大連 116045;3.中國石化 巴陵分公司,湖南 岳陽 414014)
輕烴中常存在烴基二硫或多硫化合物,例如:穩定汽油、含硫醇凝析油中的硫醇常以C2~C4烷基硫醇為主,經Merox工藝處理后,硫醇轉化為烷基二硫或多硫[1];煉油廠精制液化石油氣(LPG)中殘余硫化物常以C1~C2烷基二硫或三硫為主[2-3]。在進一步的熱處理過程中這些硫化物的形態會繼續發生變化,大部分轉移到下游產品中[4],從而影響產品質量或下游加工。烴基二硫或多硫的熱穩定性一般低于多數烴類化合物[5],硫化物的熱裂解會產生腐蝕性更強的小分子硫化物[6-7]。
對烴基二硫及多硫熱裂解的研究發現,烴基多硫的熱裂解反應主要受溫度影響。Faragher等[8]研究了C2及C2以上的有機多硫(包括二烷基二硫(Dialkyl disulfide, DADS))在496 ℃下的熱裂解產物,其中二烷基二硫的熱裂解產物主要是H2S、S0、RSH、RSR和噻吩(THP)。Coope[9]和Patrick[10]研究了二甲基二硫(Dimethyl disulfide, DMDS)及二乙基二硫(Diethyl disulfide,DEDS)在氣相狀態下的熱裂解行為,提出了一級反應的自由基機理。Moldavskii等[11]研究了在MoS作催化劑及臨氫條件下,溶解在煤油中的二乙基二硫的熱裂解行為,發現在230 ℃時反應2 h就有超過75%的二硫醚發生熱裂解反應,產物以H2S和乙硫醇為主。Clark等[12]研究了烴基多硫的熱穩定性,發現二甲基多硫(CH3SnCH3,n≥3)在50 ℃時就可發生熱裂解反應,產生甲硫醇及硫化氫等小分子硫化物,且n值越大,熱裂解反應越易進行;而二芳基多硫(Diaryl disulfide, DArPS)的熱穩定要高得多,其他條件相同時在200 ℃也未發現其明顯熱裂解反應。徐海升等[13]用熱重及差示掃描量熱方法研究了二乙基多硫(CH3CH2SnCH2CH3,n為2~4)在常壓下的熱分解行為,發現在50 ℃開始就有熱裂解反應發生,至235 ℃時可裂解完全。
二烷基多硫(Dialkyl polysulfide, DAPS)用途廣泛,如作為潤滑劑[14]、催化劑預硫化劑、硫磺捕集劑[12]等;熱穩定性是其在制備及使用中的重要指標。
在含硫輕烴的熱加工過程中,烴基多硫的熱裂解會改變下游物料中硫的形態分布,影響最終產品或中間產品的質量。因此,有必要詳細研究溶解在輕烴中的短鏈二烷基多硫的熱裂解行為,為石油加工過程中涉及烴基多硫熱裂解的工藝控制提供依據。筆者以輕烴中比較常見的幾種短鏈二烷基二硫及三硫(為方便起見,以下將二烷基二硫及二硫以上的硫化物統稱為二烷基多硫)為代表,為避免實驗溫度下芳烴及烯烴與硫醇可能的反應[15],選擇化學穩定性及熱穩定性較好的飽和烴(90~120 ℃石油醚)作為溶劑,并以高純氮為平衡氣,探討反應溫度及壓力對輕烴溶劑中二烷基多硫的熱裂解產物分布的影響。
1 實驗部分
1.1 原料和試劑
H2S(100 mg/m3,N2平衡氣)、甲硫醇(50 mg/m3,N2平衡氣),北京華元標準氣體公司產品;石油醚(90~120 ℃)、乙硫醇、二甲基硫醚(Dimethyl sulfide, DMS)、叔丁硫醇、二甲基二硫、二甲基三硫(Dimethyl trisulfide, DMTS)、二乙基二硫、乙醇胺、硫磺(升華硫),均為分析純,Adamas試劑有限公司產品;二乙基三硫(Diethyl trisulfide, DETS),工業純,石家莊利達化學品有限公司產品;二叔丁基二硫(di-tert-Butyl disulfide, DTBDS),由實驗室合成[16]。
1.2 二烷基多硫熱裂解實驗方法
將二甲基二硫、二乙基二硫、二叔丁基二硫、二甲基三硫、二乙基三硫分別溶解在90~120 ℃石油醚中,配成硫質量分數為0.10%的溶液,作為不同二烷基多硫熱裂解反應的測試溶液。將高壓反應釜(KTFD05-20,有效體積500 mL,哈氏合金材質,煙臺科立化工設備有限公司產品)作為二烷基多硫熱裂解實驗的反應器。
分別將不同二烷基多硫的裂解測試液置于反應釜內,以高純N2置換釜內空氣,預置一定量的N2(預置初壓),進行以下3類實驗:
(1)將反應釜直接快速升溫至80 ℃,然后以升溫速率0.5 ℃/min緩慢升溫,溫度每升高5 ℃時,測定反應釜內壓力,采樣測定氣相中硫化物,直至氣相中可檢測到硫醇生成。
(2)將反應釜直接加熱至80~320 ℃,穩定 120 min 后快速冷卻至常溫,對氣相及液相分別采樣,以GC-SCD方法測定硫化物形態及其含量。
(3)常溫下對不同測試液繼續補充N2至0.1~1.0 MPa,然后升溫至200~290 ℃,再補充適量N2至壓力為0.9~6.0 MPa,穩定120 min后,快速冷卻至常溫,分別從氣相及液相采樣,以 GC-SCD 方法測定硫化物形態及其含量。
1.3 硫化物測試
采用美國Agilent公司的GC 7890A氣相色譜儀分析硫化物。PONA色譜柱起始溫度35 ℃,以升溫速率2 ℃/min升溫至180 ℃后,保持5 min;高純N2為載氣,流速0.60 mL/min;進樣器溫度280 ℃,液體進樣體積2.0 μL,氣體進樣體積1.0 mL,分流比50/1;凈化H2流速40 mL/min,凈化空氣流速6 mL/min;燃燒器溫度800 ℃;SCD設置在355 nm波長處檢測SO2信號。
以標準硫化物標定大部分相關硫化物的色譜保留時間。采用文獻[12]中方法制備二烷基四硫,并在相同色譜條件下進行GC-MS分析,得到相應二甲基四硫(Dimethyl tetrasulfide, DMTTS)及二乙基四硫(Diethyl tetrasulfide, DETTS)的保留時間。
以二甲基二硫為標樣、石油醚為溶劑,配制硫質量分數為0.002%~0.02%及0.02%~0.10%的兩個濃度系列的硫標準溶液,分別測定各標樣的GC-SCD色譜圖,根據SCD色譜峰響應與硫原子物質的量成正比[17]的原理,制備定硫標準曲線。熱裂解實驗中,對反應釜內的液相樣品與氣相樣品分別采樣,以 GC-SCD 測定硫形態及其含量(硫質量分數),根據反應釜內液相和氣相體積,將液相和氣相中相同硫形態的硫含量合并,折算到液相物料中,并計算各種形態硫在總硫中所占比率(本研究中定義為硫形態比率,ΦS)。由于未反應的二烷基多硫也存在于反應后物料中,為便于比較,也將其作為反應產物列出以進行對比。第i種硫化物在總硫中的硫形態比率(ΦS,%)的計算如式(1):
(1)
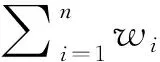
反應前測試溶液中二烷基多硫的ΦS為100%,其他硫化物的硫形態比率為0;反應后部分二烷基多硫裂解為其他形態的硫化物,反應前與反應后物料中二烷基多硫的ΦS之差即為二烷基多硫熱裂解率(ξ,%),如式(2)計算。
(2)
2 結果與討論
2.1 短鏈二烷基多硫的熱裂解起始溫度
在對二甲基二硫及二乙基二硫進行熱裂解實驗時發現,加熱過程中最先可檢測到的熱裂解產物是硫醇,與文獻[8]中結論相一致。因此將可檢測到硫醇的最低溫度視為熱裂解反應發生的起始溫度。
測定了不同預置起始壓力下,二甲基二硫、二乙基二硫、二叔丁基二硫、二甲基三硫、二乙基三硫開始熱裂解產生硫醇的溫度及其對應的壓力(關聯壓力),結果如表1所示。由表1可知:(1)熱裂解反應發生時的對應壓力都高于 25 ℃ 時的預置起始壓力,說明升溫過程中伴隨著壓力的升高;(2)隨著樣品預置起始壓力的增大,二烷基多硫熱裂解反應發生的起始溫度及其關聯壓力也隨之升高。
升溫過程中壓力的上升可能歸因于3方面:(1)二烷基多硫發生熱裂解,產生小分子硫化物;(2)升溫引起釜內N2壓力的升高;(3)石油醚的氣化及熱裂解。二烷基多硫是微量組分,即使全部汽化或裂解也不至對壓力的增加產生明顯影響;N2作為平衡氣,升溫時壓力會增加,依據氣態方程,當溫度由25 ℃升至120~340 ℃時,計算反應器內N2壓可升至其初壓的1.3~2.1倍;石油醚全部為飽和烴,明顯裂解的溫度一般在400 ℃以上[18],實驗中對裂解產物的GC-FID(烴類色譜峰)分析也顯示烴類組成幾乎不變,說明石油醚分子裂解很少;所用石油醚的實際餾程為92~111 ℃(IBP~98%餾出溫度),表1中二烷基多硫的熱裂解起始溫度都高于石油醚的初餾點溫度,因此石油醚將產生大于 0.10 MPa 的蒸汽壓。以沸點位于石油醚餾程范圍的正庚烷(常壓沸點 98.5 ℃)為模型化合物,采用Antoine方程計算正庚烷的蒸汽壓隨溫度的變化,如表2所示。根據表2可推測升溫過程中作為溶劑的石油醚會產生與正庚烷相近的蒸汽壓,如對于 表1 中預置起始壓力為0.10 MPa的二乙基二硫實驗液,當溫度由25 ℃升至200 ℃時,測定反應器內的壓力由0.10 MPa升至1.10 MPa;計算200 ℃時N2壓力為0.17 MPa,按表2估計石油醚蒸汽壓約為0.95 MPa,二者之和約為1.12 MPa,與實測壓力1.10 MPa相近。可見在升溫過程中反應釜內壓力的增加主要源于石油醚蒸汽壓力及預置N2壓力的升高,因此升溫過程中產生了對應的關聯壓力的升高。
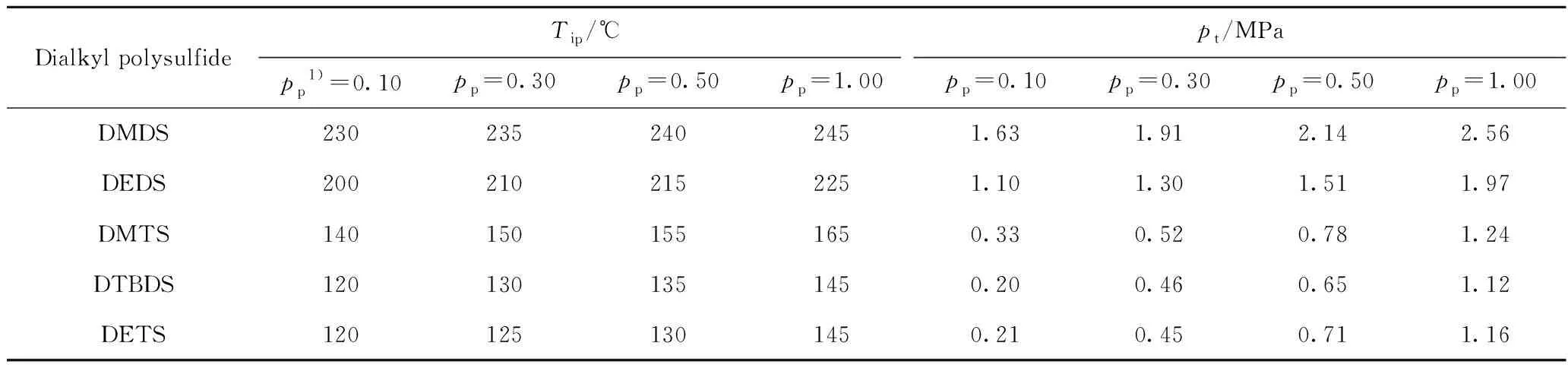
表1 二烷基多硫在不同預置起始壓力(pp)下的熱裂解起始溫度(Tip) 及對應Tip的關聯壓力(pt)Table 1 Initial pyrolysis temperature (Tip) and related pressure (pt) for dialkyl polysulfides at different preset pressures (pp)
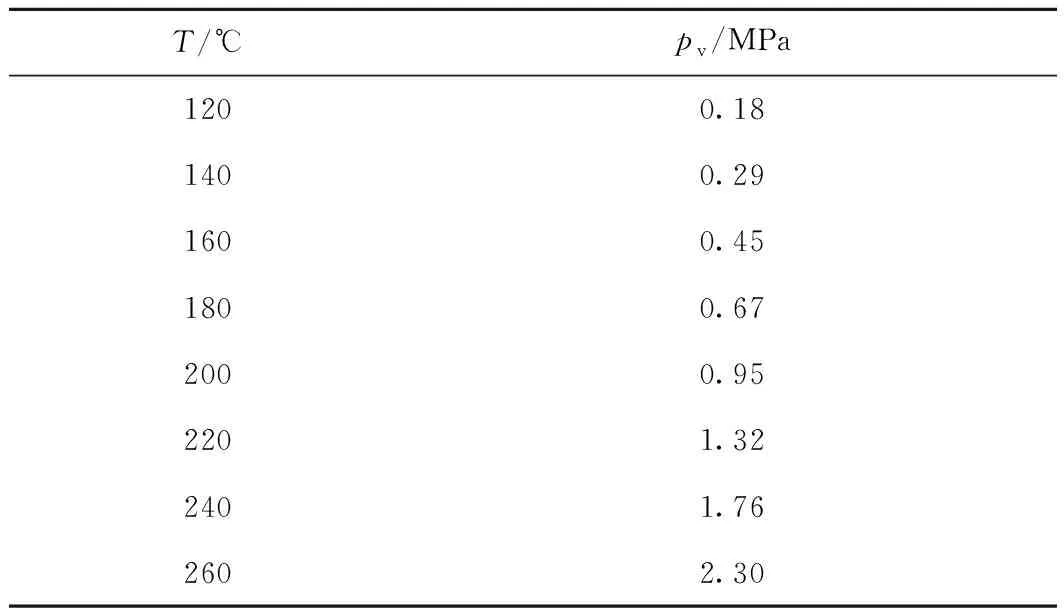
表2 正庚烷蒸汽壓(pv)隨溫度(T)的變化Table 2 Heptane vapor pressure (pv) changewith temperature (T)
表1顯示,對同一烷基多硫醚,增加預置起始壓力可使熱裂解反應的起始溫度提高。表1中不同烷基多硫的熱裂解起始溫度及其關聯壓力都不相同,難以比較不同烷基多硫在相同壓力下的熱裂解起始溫度,為此將表1中不同二烷基多硫的熱裂解起始溫度Tip與其對應的關聯壓力pt采用多項式進行關聯,得到如式(3)~(7)所示的不同二烷基多硫的熱裂解起始溫度Tip與其關聯壓力pt的關系。
DMDS:
Tip=4.6851pt2-6.6042pt+231.50
(3)
DEDS:
Tip=-20.504pt2+91.007pt+125.17
(4)
DMTS:
Tip=-17.056pt2+53.095pt+125.17
(5)
DTBDS:
Tip=-14.416pt2+46.026pt+111.49
(6)
DETS:
Tip=12.255pt2+9.1799pt+117.77
(7)
以式(3)~(7)分別估算二甲基二硫、二乙基二硫、二叔丁基二硫、二甲基三硫、二乙基三硫在一定壓力(pt)下發生熱裂解反應的起始溫度Tip,結果如表3所示。
由表3可見:(1)在相同壓力下, 5種二烷基多硫的熱裂解起始溫度從高到低的順序為:DMDS、DEDS、DMTS、DTBDS、DETS,基本反映出5種二烷基多硫的熱穩定性順序;(2)相同烷基時,硫原子數越多,二烷基多硫的熱裂解起始溫度越低;(3)硫原子數相同時,烷基較大或支鏈較多的二烷基多硫的熱裂解起始溫度較低;(4)壓力越高,二烷基多硫的熱裂解起始溫度越高。
此外,對二甲基二硫、二乙基二硫、二乙基三硫熱裂解的物料平衡測定結果顯示,實驗過程中總硫及物料的質量回收率均在95%以上。
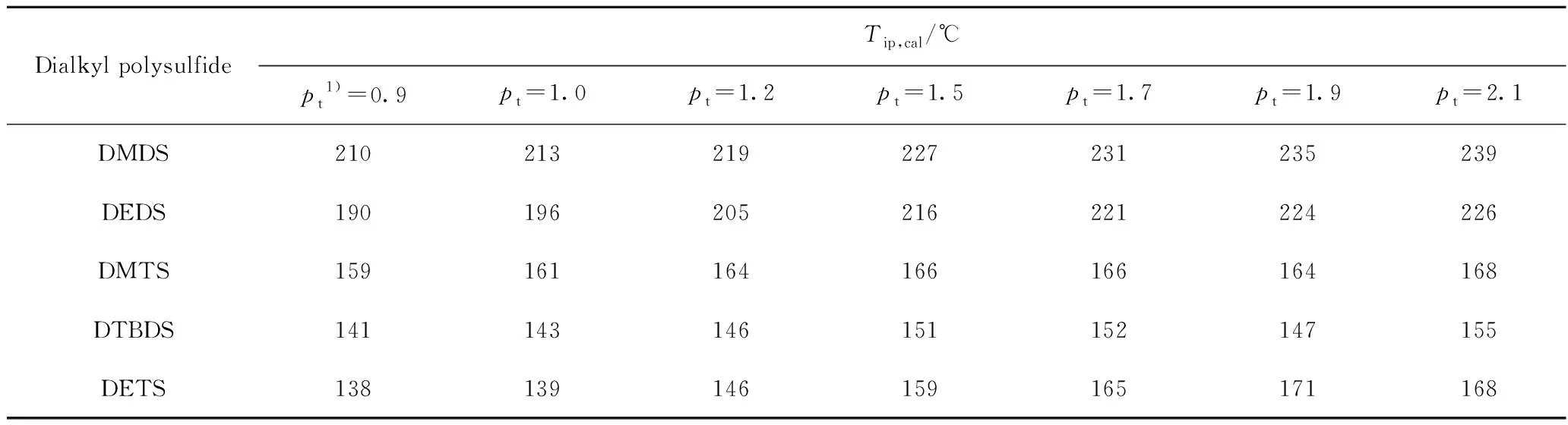
表3 基于表1計算的二烷基多硫在不同關聯壓力(pt)下的熱裂解起始溫度(Tip,cal) Table 3 Calculated initial pyrolysis temperature (Tip,cal) of dialkyl polysulfides underdifferent related pressures (pt) based on Table 1
2.2 反應溫度對二烷基多硫熱裂解產物硫分布的影響
2.2.1 反應溫度對二烷基二硫熱裂解產物硫分布的影響
采用GC-SCD方法分別測定石油醚中的二甲基二硫、二乙基二硫、二叔丁基二硫在不同反應溫度下熱裂解產物的硫化物分布,計算產物中各形態硫在總硫中所占的硫形態比率(ΦS)。所得二烷基二硫在不同反應溫度及其關聯壓力下的熱裂解產物分布如圖1所示。
由圖1可知,二烷基二硫的熱裂解反應具有以下特點:(1)裂解產物均以相應的烷基硫醇為主,H2S為輔,二甲基二硫裂解產物中還含有少量DMS;(2)隨著反應溫度升高,二烷基二硫的ΦS逐漸降低,裂解產物的ΦS逐漸升高;(3)升溫過程中每種烷基二硫的ΦS均存在一“拐點溫度”,低于此溫度時,其ΦS隨溫度升高而緩慢降低,高于此溫度后,其ΦS快速降低。裂解產物中硫醇的ΦS急劇增大,但H2S及二甲基硫醚的ΦS增速較低。二甲基二硫、二乙基二硫、二叔丁基二硫的ΦS變化“拐點溫度”分別為270 ℃、250 ℃和140 ℃,高于此溫度點后二烷基二硫的ΦS隨溫度升高近于直線降低。(4)從圖1(a)和(b)可看出,反應溫度從210 ℃(關聯壓力1.2 MPa)升至310 ℃(關聯壓力5.2 MPa)時,二甲基二硫和二乙基二硫的ΦS分別從100%和98%降至24%和22%,意味著裂解率ξ從0和2%分別升至76%和78%;330 ℃時(關聯壓力6.5 MPa)剩余二甲基二硫的ΦS在5%以下,盡管ξ已大于95%,但完全裂解尚需更高溫度。從圖1(c)可以看出,在反應溫度為200 ℃時,剩余二叔丁基二硫的ΦS約為25%;在反應溫度為230 ℃(關聯壓力1.6 MPa)時二叔丁基二硫可完全裂解。這說明二甲基二硫與二乙基二硫的熱裂解條件相當,但二叔丁基二硫的熱裂解反應要容易得多。
從圖1還可以看出,隨著反應溫度的升高,與溫度關聯的壓力(pt)也在增加。因此,圖1中反映的是反應溫度及其關聯壓力對二烷基二硫熱裂解產物硫形態分布的共同影響。
2.2.2 反應溫度對二烷基三硫(DATS)熱裂解產物硫分布的影響
反應溫度對二甲基三硫、二乙基三硫裂解產物中各硫化物ΦS的影響如圖2所示。由圖2可知,2種二烷基三硫的熱裂解反應具有以下特征:
(1)隨著溫度的升高,烷基三硫的ΦS下降,裂解產物的ΦS增加,當反應溫度從120 ℃(關聯壓力0.2 MPa)升至310 ℃(關聯壓力5.2 MPa)時,二甲基三硫及二乙基三硫裂解產物ΦS總和分別由0及3%升至95%及97%。(2)二烷基三硫在較低溫度下(二甲基三硫160 ℃以下,二乙基三硫120 ℃以下)的分解產物以二烷基二硫及二烷基四硫為主,表明在較低溫度下主要發生二烷基三硫轉化為二烷基二硫及二烷基四硫的歧化反應,進一步的裂解反應不明顯;二甲基三硫在120 ℃時的裂解率小于1%。(3)熱裂解反應發生后的產物以硫醇為主,H2S為輔,并含單硫醚(僅二甲基三硫產生)。(4)二甲基三硫的裂解產物中甲硫醇及H2S的ΦS與二甲基二硫(見圖1(a))裂解反應中相差不大,但二乙基三硫的裂解產物中乙硫醇的ΦS明顯低于二乙基二硫(見圖1(b))的熱解反應,而H2S的ΦS則高于二甲基二硫及二甲基三硫的裂解產物。(5)二烷基三硫加熱后均有相應二烷基二硫及二烷基四硫生成,且隨著溫度的升高,二烷基二硫的ΦS增大到峰值后逐漸降低,二甲基二硫及二乙基二硫的ΦS達到最大值的溫度分別約為235 ℃和215 ℃;而二烷基四硫的ΦS隨溫度升高持續降低,在190 ℃時的反應產物中已檢不出二甲基四硫,在210 ℃時反應的產物中檢測不出二乙基四硫。(6)二烷基三硫加速熱裂解的“溫度拐點”不如二烷基二硫明顯。
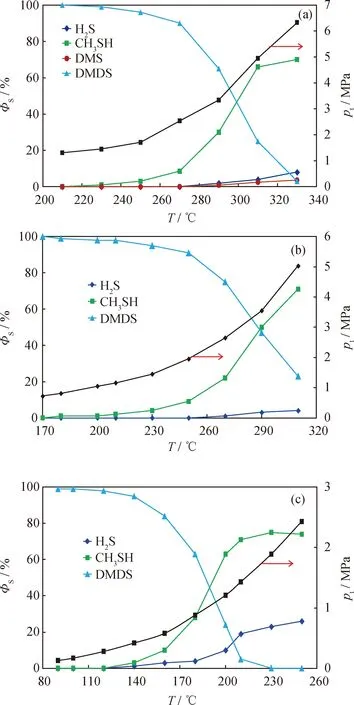
圖1 反應溫度(T)及其關聯壓力(pt)對二烷基二硫熱裂解產物硫分布的影響Fig.1 Effect of reaction temperature (T) and relatedpressure (pt) on ratio of sulfur types fordialkyl disulfide pyrolysis products(a) DMDS, t=120 min; (b) DEDS, t=120 min;(c) DTBDS, t=120 min;ΦS—Ratio of sulfur type in total sulfur;pt—Pressure change due to rising of temperature;DMS—Dimethyl sulfide; DMDS—Dimethyl disulfide;DEDS—Diethyl disulfide; DTBDS—Di-tert-butyl disulfide
壓力為1.9 MPa時,二甲基二硫的熱裂解起始溫度為235 ℃左右(表3),即在壓力為1.9 MPa以上、溫度為235 ℃以下時,二甲基二硫不發生裂解。從圖2(a)可知,由二甲基三硫歧化生成二甲基二硫的ΦS達到最大值的溫度在230 ℃(關聯壓力為1.8 MPa)左右,此時二甲基二硫接近熱裂解起始反應條件,其ΦS約為28%;剩余二甲基三硫的ΦS約為17%;如歧化生成的二甲基四硫不裂解,則計算其ΦS應為此時二甲基二硫的ΦS的2倍(即56%),三者之和應接近100%。但從圖2(a)可見,此時產物中并不存在二甲基四硫,表明其在生成的同時就已裂解,此時的硫醇、H2S等小分子硫化物應是由二甲基三硫經歧化生成的二甲基四硫裂解反應所生成。由此可知,在230 ℃以下時,生成的小分子硫化物主要來自于歧化產物二甲基四硫的裂解反應;而在230 ℃以上時,歧化生成的二烷基二硫與二烷基四硫都會發生裂解反應,生成小分子硫化物。從圖2(a)還可看出,當溫度升至290 ℃時(關聯壓力3.7 MPa),剩余二甲基三硫的ΦS為已接近0,但歧化生成的二甲基二硫尚未完全裂解,其ΦS為10%左右;進一步升溫至310 ℃(關聯壓力5.3 MPa)反應后,其ΦS仍有5%左右,此時二甲基三硫的熱解率ξ為95%左右,其完全裂解還需更高溫度,應與二甲基二硫相當。
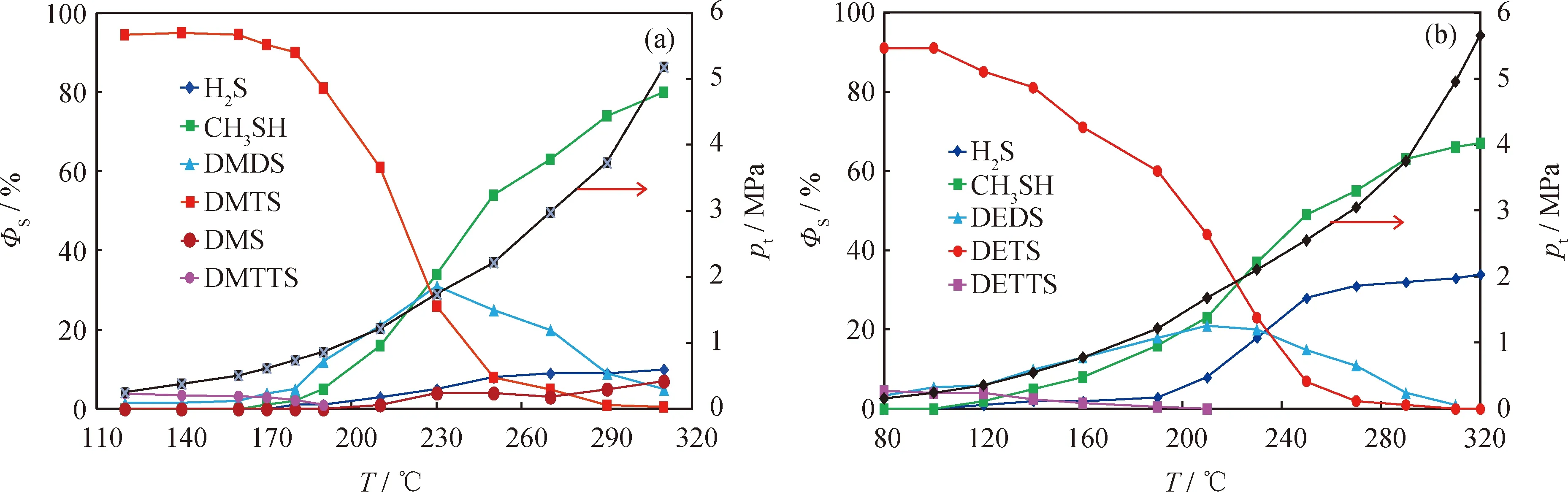
圖2 反應溫度(T)及關聯壓力(pt)對二烷基三硫熱裂解產物硫分布的影響Fig.2 Effect of reaction temperature (T) and related pressure (pt) on ratio of sulfur types for dialkyl trisulfide pyrolysis products(a) DMTS, t=120 min; (b) DETS, t=120 minΦS—Ratio of sulfur type in total sulfur; pt—Pressure change due to rising of temperature; DMS—Dimethyl sulfide;DMDS— Dimethyl disulfide; DMTS—Dimethyl trisulfide; DMTTS—Dimethyl tetrasulfide; DEDS—Diethyl disulfide;DETS—Diethyl trisulfide; DETTS—Diethyl tetrasulfide
從圖2(b)可知,二乙基三硫的熱裂解反應同樣是先歧化為二乙基二硫和二乙基四硫,前者的ΦS先升高后降低,后者則是迅速裂解。
可見二烷基三硫并不直接發生熱裂解,而是經歷先歧化、歧化產物再繼續裂解的過程。歧化反應的溫度低于熱裂解實驗的起始溫度,其中二烷基四硫的熱穩定性較差,裂解速率大于生成速率,以至在一定溫度以上時(二甲基三硫為 190 ℃,二甲基二硫為210 ℃),裂解產物中檢不出二烷基四硫;歧化生成的二烷基二硫會按圖1所示的趨勢繼續裂解。
另外,由于甲基或乙基二硫的裂解溫度卻要比二叔丁基二硫高得多。因此,盡管二甲基三硫(或二乙基三硫)與二叔丁基二硫的熱裂解起始溫度相差不大,但完全裂解的溫度卻要高很多。
2.3 反應壓力對二烷基多硫熱裂解產物硫分布的影響
2.3.1 反應壓力對二烷基二硫熱裂解產物硫分布的影響
圖3為一定溫度下反應壓力對二烷基二硫熱裂解產物分布的影響。由圖3可知,隨著壓力的增加,產物中剩余二甲基二硫或二乙基二硫的ΦS都在升高,表明二烷基二硫的熱裂解程度都隨反應壓力的增大而降低。相應裂解產物中的硫醇、H2S及DMS的ΦS均隨壓力的增大而減小。
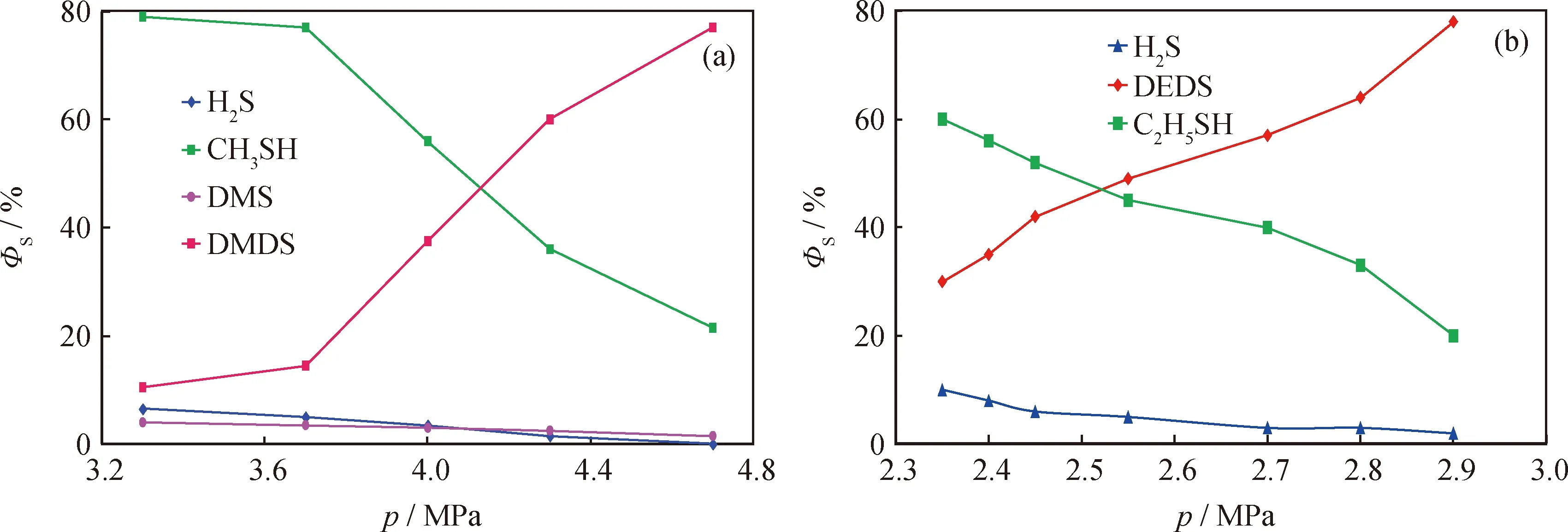
圖3 反應壓力(p)對二烷基二硫熱裂解產物硫分布的影響Fig.3 Effect of reaction pressure (p) on ratio of sulfur types for dialkyl disulfide pyrolysis products(a) DMDS, T=290 ℃, t=120 min; (b) DEDS, T=270 ℃, t=120 minΦS—Ratio of sulfur type in total sulfur; DMS—Dimethyl sulfide; DMDS—Dimethyl disulfide; DEDS—Diethyl disulfide
2.3.2 反應壓力對二烷基三硫熱裂解產物中硫分布的影響
圖4為一定溫度下反應壓力對二烷三硫熱裂解產物中硫形態分布的影響。從圖4(a)可以看出,在210 ℃、1.20 MPa下反應120 min后,硫化物的熱裂解產物中,硫化氫、甲硫醇及甲硫醚的ΦS分別約為8%、3%及25%,合計為36%;未反應二甲基三硫的ΦS約為26%,歧化反應產生的二甲基二硫及二甲基四硫的ΦS分別約為38%及0,三者合計為64%。此時二甲基三硫的熱裂解率ξ為36%。在210 ℃、2.4 MPa下反應120 min后,產物中幾乎沒有硫化氫、甲硫醇及甲硫醚,此時物料中的硫化物幾乎全部是二甲基三硫及歧化生成的二甲基二硫和二甲基四硫。可見,當反應壓力由1.2 MPa增加至2.4 MPa時,二甲基三硫的熱裂解率由36%降至0。從圖4(a)還可知,歧化產物二甲基二硫及二甲基四硫的ΦS變化表現出相反趨勢:二甲基二硫的ΦS隨著壓力的增大而下降,而二甲基四硫的ΦS則隨著壓力的增大而上升。由圖4(b)可見,在反應溫度200 ℃下,反應壓力對二乙基三硫熱裂解產物中硫形態分布的影響也呈現類似的規律。
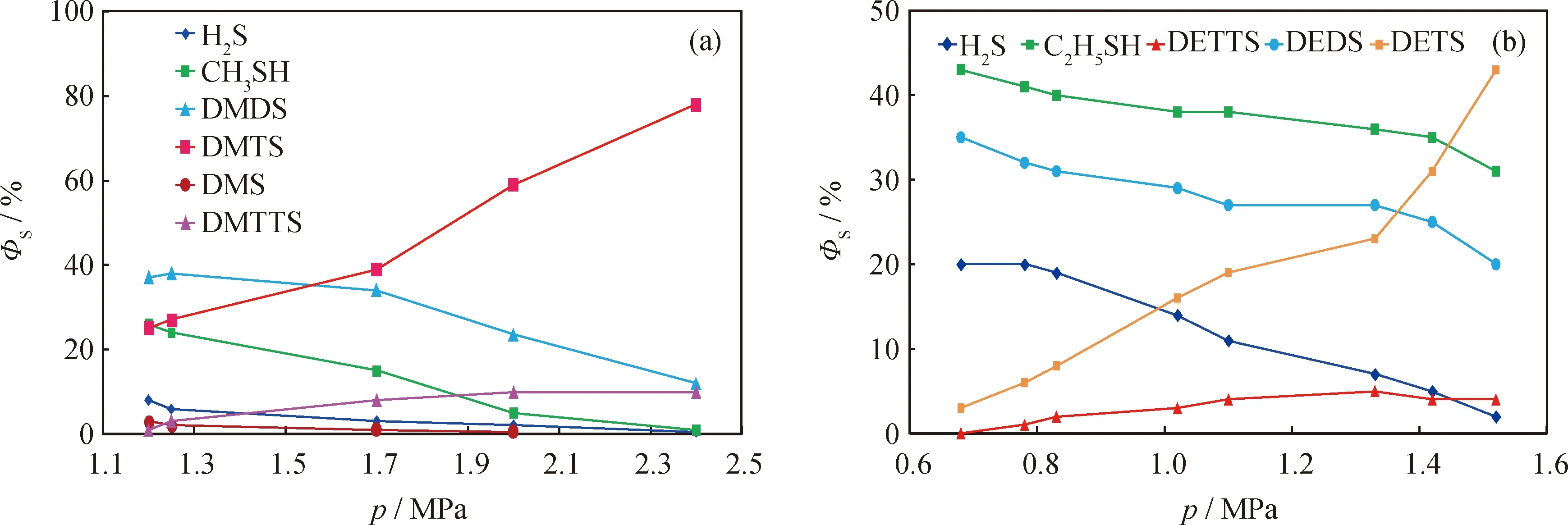
圖4 反應壓力(p)對二烷基三硫熱裂解產物硫形態分布的影響Fig.4 Effect of reaction pressure (p) on ratio of sulfur types for dialkyl trisulfide pyrolysis products(a) DMTS, T=210 ℃, t=120 min; (b) DETS, T=200 ℃, t=120 min;ΦS—Ratio of sulfur type in total sulfur; DMS—Dimethyl sulfide; DMDS—Dimethyl disulfide; DMTS—Dimethyl trisulfide;DMTTS—Dimethyl tetrasulfide; DEDS—Diethyl disulfide; DETS—Diethyl trisulfide; DETTS—Diethyl tetrasulfide
從表3可知,當壓力從0.9 MPa升至2.1 MPa后,二甲基二硫發生熱裂解反應的起始溫度Tip從210 ℃升至239 ℃;如果設定反應溫度為210 ℃,壓力在0.9~1.9 MPa,二甲基二硫應基本不會裂解。從圖3(a)可知,二甲基二硫的ΦS隨壓力升高增加,則歧化反應生成的二甲基二硫的ΦS也應隨著壓力升高而增大,但圖4(a)顯示二甲基二硫的ΦS隨壓力升高而降低,說明壓力增加抑制了二甲基三硫的歧化反應,使二甲基二硫的生成速率低于裂解速率。但另一方面,二甲基四硫的ΦS卻隨壓力升高而增大,說明壓力增加盡管抑制了二甲基三硫的歧化,使其ΦS降低;但同時也抑制了二甲基四硫的熱裂解反應,使二甲基四硫的生成速率大于裂解速率。
可見,升高壓力不僅會提高二烷基多硫的熱裂解起始溫度,還會抑制二烷基多硫的熱裂解反應。因此,反應溫度和壓力都是影響二烷基多硫熱裂解反應程度及其產物硫形態分布的重要因素。不同烷基、不同硫原子數烷基多硫的熱裂解反應產物中都含相應烷基的硫醇及H2S,但不同多硫的熱裂解反應條件很不相同。因此,在熱處理含有機多硫的輕烴時,可根據生產要求,結合原料中硫化物的形態,適當調整溫度和壓力,控制產物中的硫分布。
2.4 其他反應條件對熱裂解產物的影響
以往對二烷基(及芳基等)多硫熱裂解的研究多在常壓[8,12]或負壓下[9-10]進行,研究對象是無溶劑的“純”二烴基多硫,個別研究[11]雖涉及烴類溶劑,但熱裂解反應涉及加氫催化劑及H2的參與。本研究中以輕質烷烴為溶劑,研究溫度及壓力對其中微量二烷基多硫熱裂解產物分布的影響。表4為二烷基多硫熱裂解實驗中所使用的硫化物、主要反應條件及裂解產物對比。
由表4可以看出,不同實驗條件下二烷基多硫熱裂解產物的共同特點是熱裂解產物均以硫醇和H2S為主。不同點在于:(1)無烴類溶劑時,C1烷基多硫的熱裂解產物中含CS2,但C2及C2以上二烷基多硫的熱裂解產物中未發現CS2,二烷基多硫熱裂解產物的種類較多,可檢測到S0、CH2=S,甚至極微量的H2S2及CH3SCH2SSCH3等;(2)以烴類為溶劑時,熱裂解產物中可檢測到的硫化物種類較少,即使二甲基多硫的裂解產物中也未發現CS2。
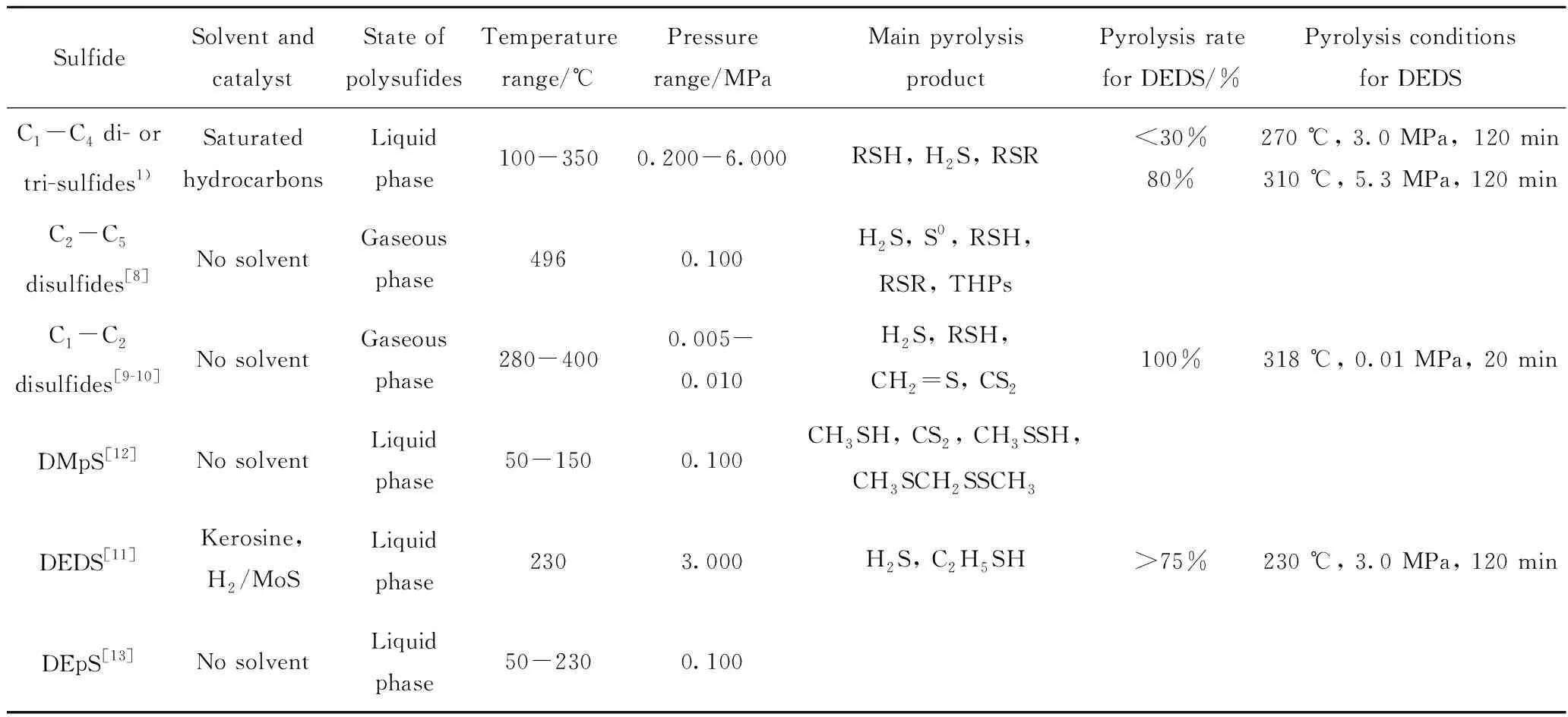
表4 不同反應條件下短鏈二烷基多硫熱裂解產物硫分布Table 4 Sulfur distribution of short-chain dialkyl polysulfides pyrolysis products under various reaction conditions
本研究中,二乙基二硫在溫度270 ℃、壓力3.0 MPa下反應120 min,熱裂解率小于30%;在310 ℃、5.3 MPa下反應120 min,熱裂解率僅80%;裂解產物均以乙硫醇為主,H2S為輔。Moldavskii等[11]在MoS(一種加氫催化劑)及H2存在下,將溶解在煤油中的二乙基二硫(0.8 mol/L)在230 ℃、3.0 MPa下反應120 min,測得其熱裂解率超過75%,且產物以H2S為主、乙硫醇為輔;而Coope[9]對無溶劑的二乙基二硫,在318 ℃、0.01 MPa時反應20 min后,發現二乙基二硫完全裂解。這說明:催化劑可促進二乙基二硫的熱裂解;H2能將生成的部分CH3CH2SH還原為H2S,改變裂解產物中的硫分布;降低壓力可促進有機多硫的熱裂解。
可見,短鏈二烷基多硫的熱裂解率及產物分布不僅與硫化物本身的化學結構有關,還與溫度、壓力、溶劑、催化劑、H2等多種因素相關。
2.5 輕烴中二烷基多硫熱裂解反應機理
如烴類[19-21]及某些含雜原子的有機過氧化物[22]、硫醇[15]的熱裂解等多屬于自由基反應。一般認為,二烷基多硫的熱裂解反應也遵循自由基機理[8]。
熱裂解反應伴隨化學鍵的斷裂及重組,反應時化學鍵斷裂所需的活化能實際上就是離解能,在短鏈烷基多硫中,存在的化學鍵包括C—H、C—C、C—S、S—S及S—H鍵等,離解能不僅取決于毗鄰元素的性質,而且與所處化學環境相關。相關化學鍵的典型離解能如表5所示。
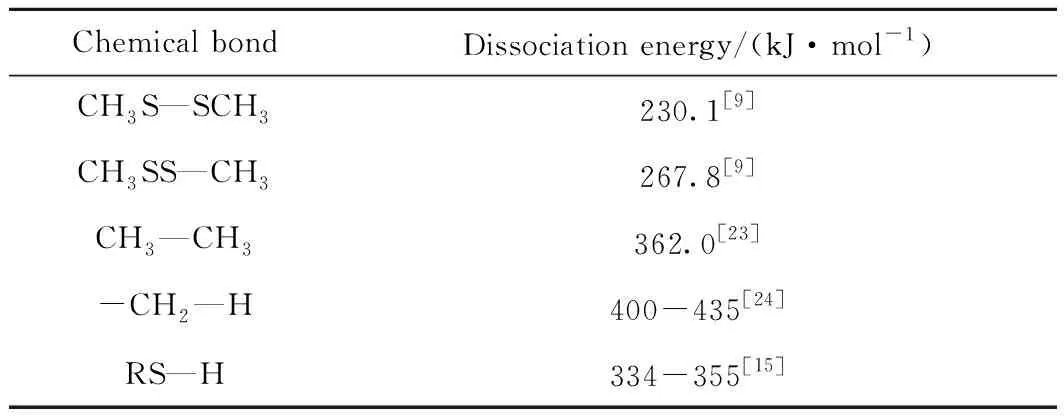
表5 相關化學鍵的離解能Table 5 Dissociation energy of related chemical bonds
升溫過程中離解能低的化學鍵會優先斷裂,形成自由基或進一步熱裂解,然后重組形成新的分子。依據相關化學鍵的離解能數據,S—S鍵優先斷裂,其次是S—C鍵,然后是C—C鍵,最后才是C—H鍵。C—C鍵及C—H鍵的離解能大于S—S鍵及S—C鍵,因此,熱裂解過程中首選斷裂的主要是S—S鍵,斷鍵后形成自由基,自由基進一步與其他分子或自由基結合,形成新分子。有關熱裂解反應的機理可能部分與文獻[9]類似,但Sehon等[15]以甲苯為溶劑研究硫醇的熱裂解反應時,發現裂解產物中含有CH4、H2S及1,2-二苯基乙烷,于是提出甲硫醇可能發生如式(8)~(11)的包括熱裂解在內的系列反應,產生H2S及CH4等。顯然作為溶劑的甲苯參與了反應,但因CH3SH為微量,甲苯的參與量也是微量。故作為本實驗溶劑的烴類可能參與反應。
CH3SH+C6H5CH3→C6H5CH2·+CH3·+H2S
(8)
CH3·+CH3SH→CH3S·+CH4
(9)
CH3S·+C6H5CH3→C6H5CH2·+CH3SH
(10)
2C6H5CH2·→C6H5CH2CH2C6H5
(11)
本研究中以烷烴為主要成分的石油醚作為二烷基多硫的溶劑,當溫度升高后,二烷基多硫分子首先發生S—S鍵斷裂,形成烴基硫自由基,該自由基再從烷烴分子中奪取氫原子生成硫醇,烷烴分子則生成新的自由基,這些自由基相互間結合生成大分子的烷烴,如式(12)~(14)所示。
CH3SSCH3→2CH3S·
(12)
CH3S·+RCH3→CH3SH+RCH2·
(13)
2RCH2·→RCH2CH2R
(14)
生成的硫醇可進一步裂解,生成H2S、硫醚及烴類,如式(15)~(20)所示。實驗中烷基多硫的熱裂解先產生硫醇,再產生H2S或DMS等。
CH3SH→CH3·+SH·
(15)
SH·+CH3·→CH4+S
(16)
S+CH3SH→CH3SSCH3+H2S
(17)
CH3S·+CH3·→CH3SCH3
(18)
CH3CH2SH→CH3CH2·+SH·
(19)
SH·+CH3CH2·→CH=CH2·+H2S
(20)
CH3SH的C—S鍵能為284 kJ/mol,CH3CH2SH的C—S鍵能為263 kJ/mol[15],因而后者熱裂解相對更容易。由圖1和圖2可知,相同溫度下,二乙基二硫比二甲基二硫、二乙基三硫比二甲基三硫產生更多的H2S;二甲基二硫及二甲基三硫在熱裂解過程中都產生了DMS,但二乙基二硫在熱裂解過程中均未產生相應二乙基硫醚(DES),這可能是二乙基二硫按類似于式(12)裂解反應產生的CH3CH2·優先與式(19)產生的SH·按照式(20)反應迅速生成H2S的緣故。其他如二乙基三硫及二叔丁基二硫可能基于相同原因,裂解反應未產生相應硫醚。
本研究中二烷基多硫的熱裂解產物中未發現CS2,可能與反應環境有關。Clark等[12]認為,二甲基多硫產生CS2,需經過生成·SCH2S·雙自由基階段,而該自由基需經由單自由基CH3S·形成,但因實驗中烴類大量存在,使CH3S·依據式(13)反應迅速生成CH3SH,因而得不到CS2。由此可見,大量烴類的存在可能改變了二烷基多硫的熱裂解產物硫形態分布。
二烷基多硫分子中S—S鍵的離解能最小,在熱裂解過程中首先斷裂形成自由基,與其他原子或原子團結合[25],形成新的含硫化合物;二烷基三硫則經歷了歧化為二烷基二硫及二烷基四硫的反應,如式(21)所示。
RSSSR→RSSR+RSSSSR
(21)
生成的RSSSSR及RSSR同時也在發生熱裂解反應,但RSSSSR裂解溫度更低,而RSSR按照式(12)~(20)的裂解方式進行反應。以CH3SSSSCH3為例,熱裂解可描述如式(22)~(26)所示。生成的CH3S·等自由基按照式(12)~(20)繼續進行反應,生成小分子硫化物。
CH3SSSSCH3→CH3S·+CH3S3·
(22)
CH3S·+RCH3→CH3SH+RCH2·
(23)
CH3S3·→CH3S·+S2
(24)
S2+2CH3SH→CH3SSCH3+2H2S
(25)
2RCH2·→RCH2CH2R
(26)
二烷基多硫分子中的硫原子數越多,S—S鍵越弱,越易斷裂形成自由基;烷基越大或異構化程度越高,斷裂形成的自由基越穩定[26]。由此推測,相同烷基多硫的分子中硫原子越多,或相同硫原子數的多硫中的烷基越大,或烷基的異構化程度越高,烷基多硫的熱穩定性越差。實驗中短鏈二烷基多硫熱裂解的難易程度及熱裂解的產物分布基本符合這種規律。
3 結 論
(1)本實驗考察的二甲基多硫熱裂解產物主要為烷基硫醇、H2S,也含有二甲基硫醚。
(2)相同硫原子數的二烷基多硫,烷基越大,熱穩定性越差;相同烷基的多硫,分子中硫原子數越多,越易發生熱裂解。二甲基二硫、二乙基二硫、二甲基三硫、二乙基三硫及二叔丁基二硫在 1.0 MPa 下發生熱裂解反應的起始溫度分別為213、196、161、139及143 ℃。
(3)反應溫度和反應壓力是影響烷基多硫熱裂解反應的主要因素,升高溫度可促進熱裂解反應,增大壓力則抑制熱裂解反應。
(4)二烷基三硫的熱裂解過程中先歧化生成二烷基二硫和二烷基四硫,歧化產物繼續熱裂解。這使得低碳數烷基多硫的熱裂解反應初始溫度低,但完全裂解需較高溫度。烷基多硫的熱裂解反應遵循自由基機理;烴類溶劑會減少烷基多硫的熱裂解產物中硫的類型;H2及加氫催化劑的存在可提高二烷基多硫的熱裂解率。

