3種耐鹽植物對濱海鹽土化學性質及微生物群落結構的影響
劉雅輝,孫建平,馬佳,姚玉濤,呂晶晶,張宏偉
(1.河北省農林科學院濱海農業研究所,河北省鹽地綠化工程技術研究中心,唐山市耐鹽植物研究重點實驗室,河北 曹妃甸 063299;2.河北省農林科學院遺傳生理研究所,石家莊 050051)
土壤微生物是土壤生態系統的重要組成部分[1],不僅反映了土壤的生物性狀,而且也是土壤有機質、養分轉化與循環的動力[2-3],在土壤結構形成、土壤肥力和營養元素轉化、土壤微生態平衡保持、土壤環境凈化及生態修復等方面發揮著重要作用[4],其群落結構組成是衡量土壤肥力和質量的重要指標[5-6]。土壤微生物對所處環境的變化十分敏感[7],其群落結構和多樣性可以較早地反映土壤環境質量的變化,已被認為是重要的生物學指標[8]。磷脂脂肪酸(Phospholipid fatty acid,PLFA)是活體微生物細胞膜的恒定組分[9],也是表示微生物量的指標之一,因此特定菌群PLFA數量變化可反映原位土壤真菌、細菌等活體的生物量與菌群結構[10]。PLFA 技術是一種可定性和定量分析微生物群落多樣性的方法,近年來被廣泛應用并取得了大量成果[11-14]。
土壤微生物作為植物與土壤互作的重要紐帶,其群落結構除了受氣候和地理環境等因素的影響外,植被也是一個主要影響因素[15]。不同植物種類和種植年限均會對土壤微生物種群結構產生一定影響,李欣玫等[16]研究表明5 種荒漠植物根際土壤微生物群落組成差異顯著,并可用于檢測不同荒漠植物根際微環境土壤退化狀況。凃月等[17]研究了廣西會仙濕地不同植物根際細菌群落結構及多樣性,發現它們之間差異很大。王娟英等[18]對不同連作年限的懷牛膝根際土壤理化性質及微生物多樣性進行了研究,結果發現連作使有效磷、堿解氮和速效鉀等含量上升,而且隨著連作年限增加,土壤中總PLFAs、細菌、革蘭氏陰性菌、真菌含量明顯上升,微生物多樣性增加。劉順等[19]研究表明,不同林齡的紅心杉土壤微生物結構發生了明顯改變。另外,土壤的鹽堿度也直接影響土壤微生物的群落結構和組成,李新等[20]研究表明內蒙古河套灌區不同鹽堿程度地區土壤微生物主要以細菌為主,但隨著鹽堿程度增加,細菌含量下降。張寧[21]研究了鹽堿地起壟對土壤微生態的影響,發現起壟對細菌、放線菌影響效果顯著。因此研究鹽堿地不同植物種植下土壤微生物群落結構特征,對了解鹽堿地土壤環境狀況和質量變化具有重要意義。
1 材料與方法
1.1 研究區概況
研究區位于河北省唐山市曹妃甸區天旭生態園(118°33′40.82″E,39°09′39.35″N),屬于北溫帶大陸性季風氣候,四季氣候變化明顯,具有明顯的暖溫帶半濕潤季風氣候特征,年平均氣溫11.6 ℃,年平均降水量553.7 mm。土壤類型屬于濱海鹽土,主要鹽分組成以NaCl 為主。試驗地土壤容重1.63 g·cm-3,0~20 cm 土壤電導率為1.76 mS·cm-1,pH 為7.58,有機質12.06 g·kg-1,有效氮82 mg·kg-1,有效磷57 mg·kg-1,速效鉀220 mg·kg-1。
1.2 試驗設計
植物種子或種苗均由河北省農林科學院濱海農業研究所提供。為保證種植植物樣地與裸地對照土壤背景一致,在植物生長過程中未施加任何形式的肥料和植物生長調節劑,且采用滴灌同時等量給水。
1.3 樣品采集及主要指標測定
1.3.1 樣品采集
于植物生長旺盛期(2018年8月),按“S”形選取5個點,用土鉆取0~20 cm 土層土壤,去除石子、根系及動物殘體,過2 mm篩后混合均勻,一份用無菌封口袋密封置于冰盒中帶回實驗室用于磷脂脂肪酸測定,一份用封口袋密封用于土壤化學性質測定。
1.3.2 土壤微生物PLFAs測定及命名
土壤微生物PLFAs 提取與測定主要參照Bligh等[25]的方法并稍作改進,取新鮮土壤8.0 g,用提取液(氯仿∶甲醇∶檸檬酸緩沖液體積比為1∶2∶0.8)提取,再分別用氯仿、丙酮和甲醇洗提,分離和萃取出磷脂,之后與甲醇進行酯化反應形成脂肪酸甲酯,然后用200 mL正己烷溶解,以C19脂肪酸甲酯作為內標物,利用美國安捷倫科技有限公司的Agilent 7890B 型氣相色譜儀進行分析,色譜柱為Agilent 19091B-102 型,檢測器為氫火焰離子(FID),載氣為氫氣,譜儀工作條件為:進樣口溫度250 ℃,檢測器溫度300 ℃,柱溫箱初始溫度190 ℃,保持0 min,以10 ℃·min-1升溫至285 ℃保持0 min,以60 ℃·min-1升溫至310 ℃保持2 min,進樣量為2 μL。然后采用MIDI 公司的Sherlock MIS6.2 系統進行脂肪酸的鑒定。脂肪酸的命名參考Frostagard 等[26]的命名方法。根據前人報道的磷脂脂肪酸的生物標記[19,27],并結合MIDI軟件系統自動識別參考劃分微生物類群(表1)。
1.3.3 土壤化學性質的測定
2017年,哈電電機研制的世界首臺300兆乏全空冷調相機投入運行,作為電力守護的“安全衛士”,為特高壓電網直流輸電工程提供保障,發揮了“定海神針”的作用,行業專家賦予其“技術水平國際領先”的權威鑒定。哈電電機實現了從單一發電設備向發電設備、輸電設備并舉的華麗轉身,延伸了產業鏈條,也使我國遠距離特高壓直流輸電進入嶄新時代。
參照鮑士旦[28]的方法,土壤電導率測定時水土比為5∶1,土壤有機質含量采用重鉻酸鉀加熱法,土壤有效氮、有效磷和速效鉀分別采用堿解擴散法、碳酸氫鈉法和乙酸銨萃取法測定。
1.4 數據分析與處理
1.4.1 土壤微生物多樣性分析
土壤微生物多樣性采用Shannon-Wiener 多樣性指數(H)、Margalef 豐富度指數(SR)、Pielou 均勻度指數(J)表示,計算公式[20,29]如下:
Shannon-Wiener多樣性指數(H):

其中Pi=Ni/N
Margalef豐富度指數(SR):

Pielou均勻度指數(J):

其中Hmax=lnS
式中:Ni為第i種磷脂脂肪酸含量;N為每個樣品所有磷脂脂肪酸的含量總和;S為每個樣品磷脂脂肪酸種類數。
1.4.2 數據處理
采用Excel 2010 軟件進行數據統計;采用SPSS 20.0 軟件進行單因素方差分析(One-way ANOVA),采用Canoco 4.5軟件進行主成分分析并作圖。
2 結果與分析
2.1 土壤化學性質
由表2 可知,與裸地比較,種植植物樣地土壤電導率和速效鉀含量顯著下降,電導率下降了20.26%~57.21%,有效鉀含量下降了23.42%~37.80%;有效磷和有機質含量顯著提高,有效磷提高了106.48%~259.92%,有機質含量提高了39.16%~53.01%;而有效氮含量變化規律性不明顯。3 種植物樣地中,費菜樣地的土壤電導率顯著低于其余2 種植物,有效氮含量顯著高于其余2種植物;蒲公英樣地土壤有效磷含量最高,3種植物樣地的速效鉀和有機質含量差異不顯著。

表1 土壤微生物種類的磷脂脂肪酸生物標記Table 1 PLFA biomarker for soil microbes
2.2 土壤微生物群落結構及多樣性
對種植耐鹽植物及裸地處理下土壤微生物群落PLFAs 含量進行分析(表3),結果表明:與裸地比較,3個植物樣地土壤中革蘭氏陰性菌、放線菌、AM真菌、真核生物、真菌PFLA含量和總PFLAs含量顯著升高,分別 升 高4.96%~63.37%、82.91%~222.72%、50.00%~160.25%、32.05%~268.59%、19.39%~454.77%、21.53%~103.32%;真菌/細菌(F/B)PFLA 含量也顯著升高1.00~6.50 倍。其中,革蘭氏陰性菌、真菌和AM 真菌表現為蒲公英>費菜>田菁>裸地;放線菌和真核生物表現為費菜>蒲公英>田菁>裸地;總PFLAs 大小依次為費菜>田菁>蒲公英>裸地;AM真菌、真菌和真菌/細菌PFLA 含量在蒲公英樣地中顯著高于其余樣地。而植物樣地土壤的革蘭氏陽性菌PFLA 含量卻大幅下降了48.06%~57.78%,大小順序依次為裸地>費菜>蒲公英>田菁;革蘭氏陽性菌/革蘭氏陰性菌(G+/G-)PFLA 含量也顯著下降了59.77%~68.68%,但3 個植物樣地間差異不顯著。
對表征土壤微生物群落多樣性的Shannon-Wiener多樣性指數(H)、豐富度指數(SR)、均勻度指數(J)進行分析(表4)可以看出,蒲公英樣地多樣性指數顯著高于裸地(P<0.05),增幅為22.26%;3個植物樣地豐富度指數均顯著高于裸地(P<0.05),增幅為20.89%~36.31%。多樣性指數表現為蒲公英>費菜≈田菁>裸地,豐富度指數表現為費菜>田菁>蒲公英>裸地,4個樣地均勻度指數間沒有顯著差異。說明種植耐鹽植物后,土壤微生物種類明顯增加,群落結構復雜化。
2.3 土壤微生物PLFA主成分分析
對4個樣地處理土壤微生物PLFA 進行主成分分析(圖1),結果表明:與土壤微生物PLFA 組成相關的2 個主成分累計貢獻率達96.3%,其中第一主成分(PC1)和第二主成分(PC2)分別解釋變量方差的82.9%和13.4%,對PC1起主要作用的微生物PLFA 有32 個,其中14 個與其正相關,18 個與其負相關;對PC2 起主要作用的微生物PLFA 有17 個,1 個與其正相關,16 個與其負相關,有的磷脂脂肪酸之間相關性很大,幾乎集中于一條射線。裸地與種植植物樣地被明顯區分開,裸地位于PC2 軸的正向,種植植物樣地均位于PC2 軸的負向,費菜樣地和田菁樣地均位于PC1 軸的負向,蒲公英樣地位于PC1 軸的正向,說明裸地與種植植物樣地的土壤微生物PLFA 組成存在較大差異,蒲公英樣地與費菜樣地、田菁樣地的土壤微生物組成有一定差異,但費菜與田菁樣地土壤微生物相似性較高。因此,主成分分析結果也證明了種植3 種耐鹽植物對土壤微生物群落有較大影響,不同植物品種覆蓋的土壤微生物組成也略有不同。

表2 不同處理樣地土壤的化學性質Table 2 Soil chemical properties under different treatments

表3 不同處理土壤微生物PLFA含量(nmol·g-1)Table 3 Soil microbial PLFA content under different treatments(nmol·g-1)

表4 不同處理土壤微生物群落多樣性Table 4 Diversity of soil microbial community under different treatments
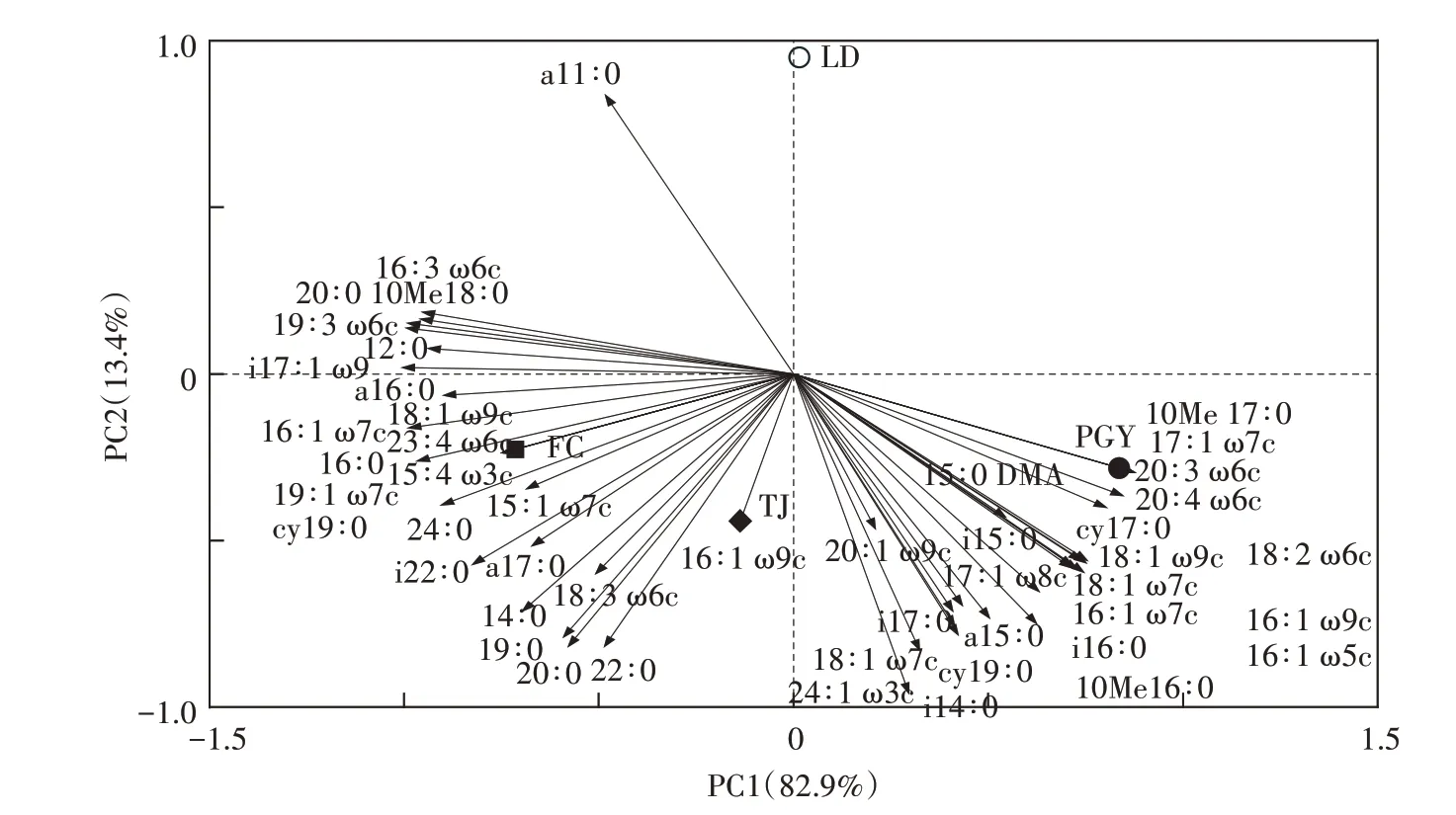
圖1 不同處理土壤微生物PLFA主成分分析Figure 1 PCA of soil microbial PLFA under different treatments
3 討論
植物、土壤和微生物是相互作用的有機整體。土壤微生物與地上植物息息相關,地上植物會直接或間接地影響土壤微生物量、活動和組成,而土壤微生物又會反過來影響地上植物生長。已有研究表明,植被的類型、數量及種植年限顯著影響土壤理化性質和微生物群落結構[30-32]。本研究分析了種植3種耐鹽植物對濱海鹽土化學性質和微生物群落結構的影響,結果表明,種植植物樣地土壤電導率和速效鉀含量顯著下降,有機質和有效磷含量卻顯著升高,微生物群落組成也發生改變。這可能是種植植物后,土壤覆蓋度好,蒸發量小,而且耐鹽植物的生長還可以有選擇地吸收一些鹽離子,尤其是通過吸收較多鉀離子來抵御鹽土環境脅迫,使得土壤電導率和速效鉀含量下降;另外植物凋落物歸還土壤中,可以增加土壤有機質含量,進而使土壤電導率降低,而有機質含量的增加又為土壤微生物生長提供了充足的碳源,更利于多種微生物的繁殖和活動,同時微生物的增加又可以促進土壤有機質的分解和養分釋放,使得土壤有效磷含量也升高。因此種植耐鹽植物能夠對土壤性質改善、養分積累和循環起到調節作用。
土壤微生物作為植物與土壤環境之間溝通的橋梁,其必然受到植物和土壤性質的直接影響。與裸地比較,本研究中種植植物土壤中革蘭氏陰性菌、放線菌、AM 真菌及微生物總量均升高,這可能是植物根系分泌物介導下,植物根際促生菌在土壤中富集的原因。另外種植植物土壤中革蘭氏陽性菌含量及G+/G-顯著降低,即細菌趨于向革蘭氏陰性菌轉變。這與王娟英等[18]、余悅[33]的研究結果一致,可能由于8月份采樣時為植物生長旺盛期,植物光合作用和生理代謝活動加強,根系分泌物使土壤有機質增加,而且土壤覆蓋度好,環境濕潤,更利于革蘭氏陰性菌的生長。有學者認為[34-36]革蘭氏陰性菌類群對環境變化較敏感,但在富營養條件下革蘭氏陰性菌生長比革蘭氏陽性菌迅速。邢肖毅[37]研究表明,土壤中G+/G-比值越小,F/B值越大,土壤肥力越高。而本研究中植物樣地土壤G+/G-降低,F/B 增加,也說明了種植耐鹽植物后土壤養分逐漸增加,給微生物生長提供充足的碳源,更有利于微生物的繁殖,同時微生物的增加又可以促進土壤有機質的分解和養分釋放,對土壤性質改善、養分積累和循環起調節作用。
PLFA 技術已被廣泛應用于土壤、堆肥樣品、湖泊、海洋沉積物等環境微生物群落結構的研究中,但也存在不足之處,如對特異性微生物類群的鑒定不夠準確[38],另外在磷脂脂肪酸鑒定過程中,盡管操作規范嚴格,但實際操作過程中仍會出現一些偏差,這些因素都會影響脂肪酸組成和含量的檢測準確性[39]。為了更全面、更深入地了解耐鹽植物種植對土壤微生物群落結構的影響,應結合高通量測序技術進行分析。
4 結論
(1)在濱海鹽土環境下,種植費菜、田菁和蒲公英3 種耐鹽植物,不僅可以降低濱海鹽土土壤電導率,提高有機質和有效磷含量,還能夠增加土壤中革蘭氏陰性菌、放線菌、AM 真菌、真核生物、真菌的數量,而且能提高土壤微生物多樣性,改善土壤微生態環境。
(2)費菜在降低濱海鹽土土壤電導率方面效果明顯,蒲公英在提高土壤有機質、有效磷含量及微生物群落多樣性方面占優勢。因此通過種植費菜和蒲公英能夠改良濱海鹽土。
本研究結果為植物修復河北濱海鹽土提供了理論依據。

