重組人血管內皮抑制素聯合化療治療晚期肺腺癌患者的療效及安全性
袁 亮,胡 勇
陜西省漢中市中心醫院:1.腫瘤內科;2.放療科,陜西漢中 723000
2019年1月,國家癌癥中心(NCC)發布了最新一期的全國癌癥統計數據,顯示惡性腫瘤發病率隨年齡增加而上升,40歲以后快速升高,發病人數主要集中在60歲以上,其中肺癌位居我國惡性腫瘤首位,約占全球1/3,肺癌病死率在所有惡性腫瘤中最高,高達26%[1]。目前根據肺癌組織病理類型可分為兩大類,分別是小細胞肺癌(SCLC)和非小細胞肺癌(NSCLC),其中NSCLC占比達85%,NSCLC又可分為腺癌、鱗癌、腺鱗癌、大細胞癌、類癌等,其中腺癌和鱗癌約占NSCLC的70%[2]。由于大多數肺癌患者初期癥狀不明顯,檢查不及時,導致絕大部分患者在明確診斷時已屬于晚期,錯失早期手術治療機會,故我國肺癌5年生存率較低,僅為15.6%,其中晚期肺癌的5年生存率僅為 1%~2%[3]。鑒于肺癌具有高發病率和病死率,因此,尋找合適、有效的抗腫瘤方案具有重要的意義。目前指南推薦驅動基因陰性[表皮生長因子受體(EGFR)、間變性淋巴瘤激酶(ALK)及ROS1未突變]的晚期NSCLC患者一線使用化療或者化療+抗血管生成藥物治療[4]。重組人血管內皮抑制素是我國自主研發的治療晚期NSCLC的一線用藥[5-6]。本文通過對76例晚期肺腺癌患者采用重組人血管內皮抑制素聯合化療進行治療,探討其對肺腺癌的治療效果,現報道如下。
1 資料與方法
1.1一般資料 選取本院腫瘤內科2017年1月至2019年1月收治的76例驅動基因陰性的晚期肺腺癌患者作為研究對象,隨機分成兩組。對照組36例,其中男23例,女13例;年齡45~80歲,平均(58.56±7.69)歲。試驗組40例,其中男26例,女14例;年齡45~80歲,平均(59.90±8.04)歲;兩組患者的一般資料差異無統計學意義(P>0.05),具有可比性。納入標準:(1)符合肺腺癌的病理診斷標準;(2)驅動基因陰性,即EGFR、ALK及ROS1基因檢測未突變患者;(3)臨床分期為Ⅳ期的肺腺癌患者;(4)卡式功能狀態評分(KPS評分)≥60分;(5)預計生存期≥3個月。排除標準:(1)合并其他部位腫瘤者;(2)不能耐受化療或有化療禁忌證。
1.2方法 對照組患者單純采用化療(培美曲塞+順鉑)進行治療,用法為靜脈滴注培美曲塞(江蘇豪森藥業集團有限公司,規格:每支0.2 g),500 mg/m2,第1天;靜脈滴注順鉑,75 mg/m2,第1天。21 d為1個治療周期。
試驗組患者采用重組人血管內皮抑制素+化療(培美曲塞+順鉑)進行治療。靜脈滴注重組人血管內皮抑制素(山東先聲麥得津生物制藥有限公司,規格:15 mg×3 mL):取7.5 mg加入500 mL生理鹽水中,1次/天,使用2周暫停1周,即21 d為1個治療周期。所有患者治療2個周期后進行療效評估,如病情進展者不再進行后續臨床觀察。試驗組及對照組均給予4個周期的治療。隨后進行定期復查。
1.3評價標準 對比兩組患者臨床療效和疾病無進展生存期(PFS)以及治療前后血清腫瘤標志物水平。(1)臨床療效在治療2個周期后進行評估,包括完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD)。CR為靶病灶消失,未見新病灶產生,且持續時間大于或等于4周。PR為靶病灶減少大于或等于30%,且持續時間大于或等于4周。SD為靶病灶未見縮小,也未見增大。PD為靶病灶增加大于或等于20%或新病灶產生。觀察客觀緩解率(ORR)及疾病控制率(DCR),ORR=(CR例數+PR例數)/總例數×100%。DCR=(CR例數+PR例數+SD例數)/總例數×100%。(2)PFS:對所有有效患者隨訪12個月,記錄患者PFS。(3)血清腫瘤標志物:檢測兩組患者治療4個周期前后糖類抗原125(CA125)、細胞角蛋白19片段(CYFRA21-1)、癌胚抗原(CEA)水平的變化情況。
1.4不良反應 記錄兩組患者治療過程中不良反應發生情況。按照通用不良事件術語4.0版(CTCAC v4.0)評價不良反應,分為0~Ⅳ級。
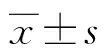
2 結 果
2.1兩組療效對比 試驗組CR共2例(5.0%),PR共18例(45.0%),SD共15例(37.5%),PD共5例(12.5%),ORR為50.0%,DCR為87.5%。對照組無CR患者,PR共10例(27.8%),SD共14例(38.9%),PD共12例(33.3%),ORR為27.8%,DCR為66.7%。試驗組ORR及DCR顯著高于對照組,差異有統計學意義(χ2=3.916、4.736,P<0.05),見表1。

表1 試驗組與對照組療效對比[n(%)]
2.2兩組PFS比較 兩組患者隨訪12個月后,試驗組PFS為(7.537±0.334)個月,對照組PFS為(5.535±0.373)個月,試驗組PFS較對照組PFS明顯延長,差異有統計學意義(t=14.187,P<0.05)。
2.3兩組治療前后腫瘤標物水平變化情況對比 治療4個周期后,試驗組血清中CEA、CYFRA21-1、CA125水平較對照組明顯降低,差異均有統計學意義(P<0.05)。見表2。

表2 治療前后患者血清CEA、CYFRA21-1、CA125水平比較[M(P25,P75)]
2.4兩組不良反應發生情況對比 試驗組與對照組不良反應發生率比較,差異無統計學意義(P>0.05),見表3。

表3 試驗組與對照組不良反應發生情況對比
3 討 論
近年來,靶向治療的快速發展,使得驅動基因陽性的晚期肺腺癌的PFS顯著延長、ORR明顯提高,并且能改善患者的生活質量[7-9]。但對于驅動基因陰性的患者,目前主要以化療為主。國外有研究對非鱗癌NSCLC患者采取培美曲塞+卡鉑治療,在總生存率方面要顯著優于吉西他濱+卡鉑,但對于鱗癌,后者的治療效果要顯著優于前者[10]。因此,對于驅動基因陰性肺腺癌患者,指南推薦首選培美曲塞+鉑類進行化療。近年來有研究者采用化療和抗血管生成藥物聯合應用的治療方案,如貝伐珠單抗聯合培美曲塞+鉑類,在肺腺癌中有很好的效果[11-12],因此,也被指南推薦將其用于肺腺癌的一線治療。
重組人血管內皮抑制素是我國自主研發的抗腫瘤血管生成的分子靶向藥物,作為一種血管生成的抑制劑,其主要是通過抑制血管內皮細胞的遷移,達到抑制腫瘤新生血管的生成,進而達到減少或者阻斷腫瘤細胞的營養供給,以及抑制腫瘤增殖或轉移的目的[13-14]。由于重組人血管內皮抑制素通過抑制新生血管生成而發揮抑制腫瘤生長的作用,故其很難使腫瘤迅速縮小,但與化療具有協同作用[15]。
本研究結果顯示,試驗組ORR及DCR顯著高于對照組,差異有統計學意義(P<0.05)。試驗組PFS為(7.537±0.334)個月,對照組PFS為(5.535±0.373)個月,試驗組顯著延長了PFS,差異有統計學意義(P<0.05),原因主要為重組人血管內皮抑制素作為一種抗血管生成藥物,可對腫瘤新生血管進行抑制,并使腫瘤血管正常化,促進腫瘤微環境改變,與化療具有協同作用,與化療聯用,能夠起到更好的抗腫瘤作用。
CEA、CYFRA21-1、CA125作為肺腺癌的腫瘤標志物,在臨床抗腫瘤治療過程中被作為病情評估的重要參考指標。在試驗組及對照組中,血清學指標水平對比顯示,治療后試驗組患者CEA、CYFRA21-1、CA125水平明顯低于對照組,差異有統計學意義(P<0.05)。對不良反應統計結果顯示,試驗組發生了2例Ⅲ度血液系統損害,對照組中發生了1例Ⅲ度血液系統損害,考慮這與培美曲塞+順鉑化療的骨髓毒性相關。同時,在試驗組中,心律失常、高血壓及出血發生率較對照組略升高,但差異無統計學意義(P>0.05),且無嚴重不良反應發生。總體而言,重組人血管內皮抑制素聯合化療方案的有效性和安全性均較好。
綜上所述,驅動基因陰性的晚期肺腺癌患者在一線化療基礎上增加重組人血管內皮抑制素較單獨化療療效更好,可提高ORR及DCR,明顯延長PFS,降低腫瘤標志物水平,同時安全性良好,未見嚴重不良反應事件發生,值得臨床推廣。