基于TCGA數據庫的腎嫌色細胞癌生物信息學分析
瞿根義,王佳威,徐 勇,陽 光,聶海波,黃文琳,湯 乘
(中南大學湘雅醫學院附屬株洲醫院泌尿外科,湖南株洲 412007)
腎細胞癌(renal cell carcinoma,RCC)是一種異源性疾病,由透明細胞腎細胞癌(clear cell renal cell carcinoma,ccRCC)和非透明細胞腎細胞癌(non-clear cell renal cell carcinoma,nccRCC)組成[1]。嫌色細胞癌(chromophobe renal cell carcinoma,chRCC),則是nccRCC第二常見的亞型,約占腎細胞癌亞型的4%~5%[2],發病年齡多為50~60歲,男女發病率無明顯差異[3]。雖然有研究表明具有局部chRCC和ccRCC的患者在5年生存率方面無顯著性差異(P=0.98)[4],但是大部分chRCC的患者預后比其他類型的RCC患者好,通常采取手術切除治療即可達到滿意的效果。然而對于部分進展期、預后差的患者,往往需要免疫治療和分子靶向治療等輔助治療。目前,治療chRCC的靶向藥物療效不是十分明確,藥物依舊處在臨床試驗階段,需要長時間的觀測[5]。因此進一步研究chRCC發病的相關基因,將有助于了解chRCC的發病機制和疾病進展,并對尋找更加安全有效的治療措施有著舉足輕重的作用。
TCGA數據庫作為當前世界上最大的腫瘤基因表達譜數據庫,具有大樣本和豐富臨床數據的優勢。生物信息學則是將分子生物學和電子計算機相結合的技術,可以為基因的研究提供明確的方向,幫助揭示大量生物信息中所含的奧秘。本研究采用生物信息學技術對腎嫌色細胞癌的發病相關基因芯片數據進行整合和分析,篩選出差異基因,并進行基因富集(gene ontology,GO)分析和KEGG通路富集分析,制作PPI互作網絡,以求尋找腎嫌色細胞癌發病及發展的關鍵基因,最終對挖掘到的關鍵基因進行生存分析,為進一步研究腎嫌色細胞癌的研究機制奠定生物基礎。
1 材料與方法
1.1 材料在TCGA Datasets(http://www.ncbi.nlm.nih.gov/geo)數據庫中以“chromophobe renal cell carcinoma”為關鍵詞進行檢索,并下載公開的關于腎嫌色細胞癌的基因組數據,下載的基因組數據格式為FPKM。通過下載的基因組數據獲取臨床樣本量共89例,其中腎嫌色細胞癌樣本65例,正常組織24例。
1.2 方法
1.2.1獲取差異基因 應用R軟件中的edgeR算法對腎嫌色細胞癌的數據集進行標準化處理和差異表達分析,根據差異倍數(log2)絕對值>2.5和FDR調整后P<0.05作為標準,發現差異表達基因1 850個,其中表達上調基因760個,表達下調基因1 090個。并利用ggplot2軟件包對數據進行圖形可視化。
1.2.2差異表達基因的GO富集分析和KEGG富集分析 通過DAVID數據庫(DAVID;https://david.ncifcrf.gov)對篩選的顯著差異基因進行GO富集分析和KEGG通路富集分析,P<0.05為統計學具有顯著差異,應用R軟件及相應的clusterProfiler包進行注釋及可視化。
1.2.3Hub基因的篩選 STRING數據庫(https://string-db.org/)用于識別己知和預測蛋白與蛋白之間的相互作用[6-7]。使用STRING對差異表達基因進行分析并構建蛋白互作(protein protein interaction,PPI)網絡,采用Cytoscape軟件中的Cytohubba插件從STRING構建的PPI網絡中篩選獲取前10位Hub基因。
1.2.4對關鍵基因進行生存分析 利用R軟件對篩選獲取的關鍵基因進行生存分析,并構建Kaplan-Meier生存曲線,從而判斷關鍵基因與腎嫌色細胞癌預后關系。使用Log-rank檢驗評估關鍵基因的表達水平與腎嫌色細胞癌患者總生存率之間的生存差異,以P<0.05為具有統計學意義。
2 結 果
2.1 腎嫌色細胞癌差異表達基因篩選該研究從TCGA數據庫中下載、整理及分析了89例腎嫌色細胞癌患者的數據,其中包含65個腎嫌色細胞癌樣本和24個正常樣本,利用R語言軟件進行差異表達基因篩選,以P<0.05且差異倍數2.5倍為顯著差異獲取差異表達基因。共篩選出腎嫌色細胞癌差異表達基因1 850個,其中表達上調基因760個,表達下調基因1 090個,并繪制火山圖(圖1)和差異最顯著的前50個基因熱圖(圖2)。
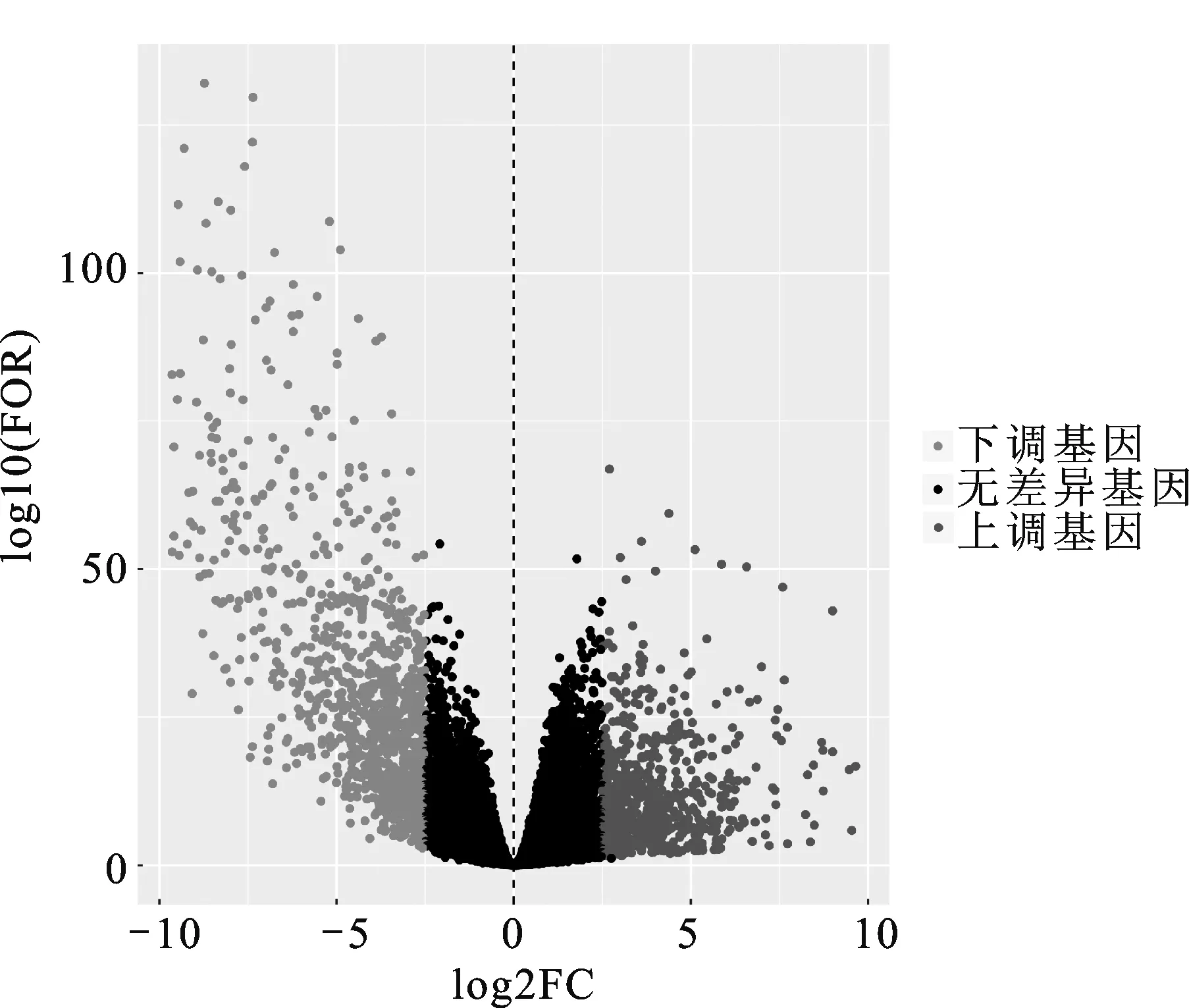
紅點:基于logFC>2.5且P<0.05篩選的下調基因;綠點:基于logFC<-2.5且P<0.05篩選的下調基因;黑點:沒有顯著差異的基因;FOR:差異倍數。
2.2 差異表達基因的GO富集分析和KEGG通路富集分析結果通過GO富集分析和KEGG通路富集分析篩選的差異表達基因的生物學功能,在GO富集分析中包括生物學過程(biological process,BP)、細胞組成(cell composition,CC)和分子功能(molecular function,MF),在BP中差異基因主要富集于跨膜轉運、化學突觸傳遞、膜電位調節和消化排泄,在CC中差異基因主要富集于質膜的組成部分、質膜、頂質膜和細胞外區域,在MF中差異基因主要富集于激素活性、氧化還原酶活性和鈣離子結合,在KEGG通路分析中主要富集于神經活性配體-受體相互作用、視黃醇代謝、類固醇激素的合成。主要富集結果見表1、表2和圖3。

圖2 腎嫌色細胞癌及癌旁正常組織差異表達最顯著的前50個基因熱圖
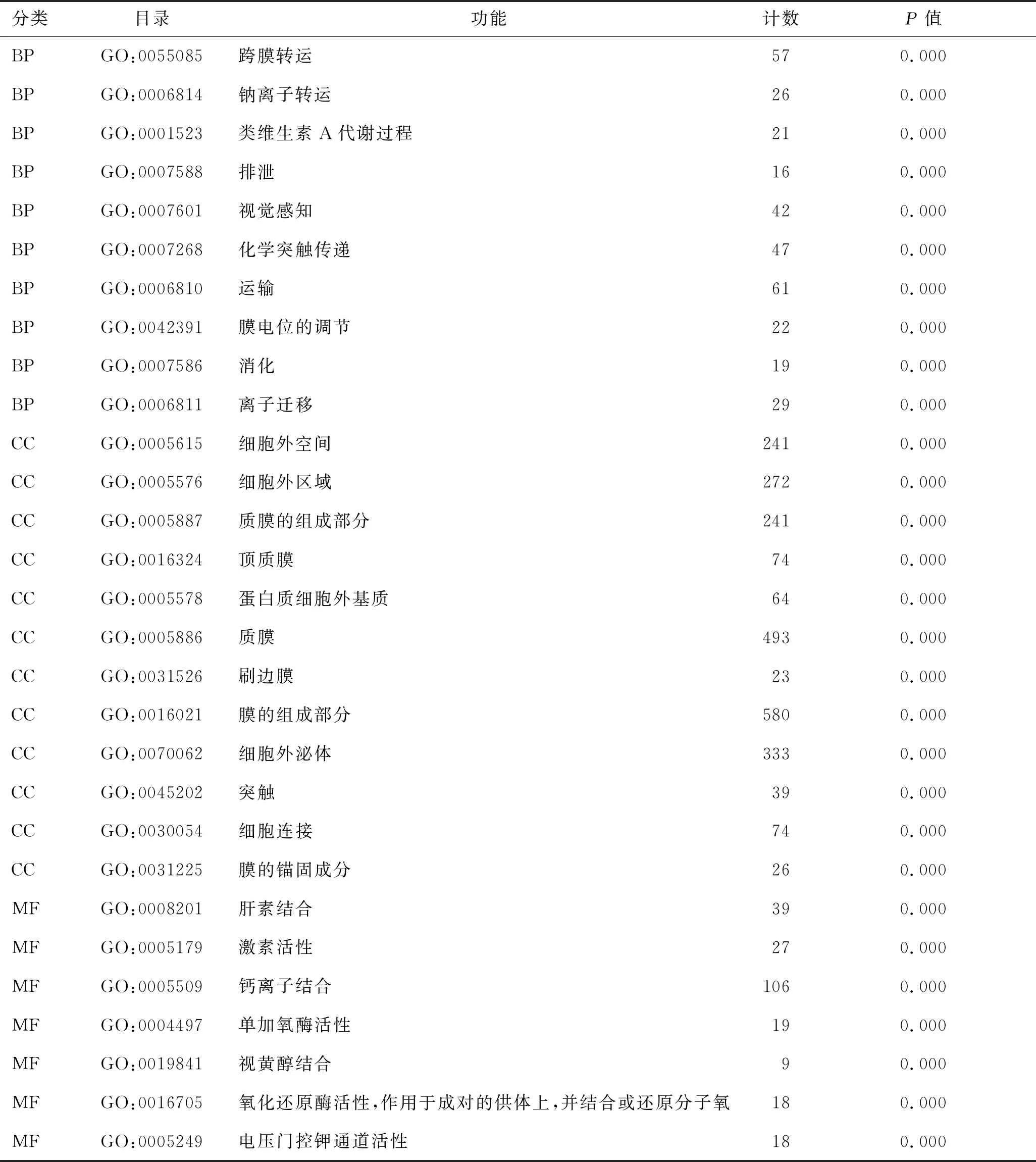
表1 腎嫌色細胞癌差異表達基因GO富集分析結果

表2 腎嫌色細胞癌差異表達基因KEGG通路富集分析結果
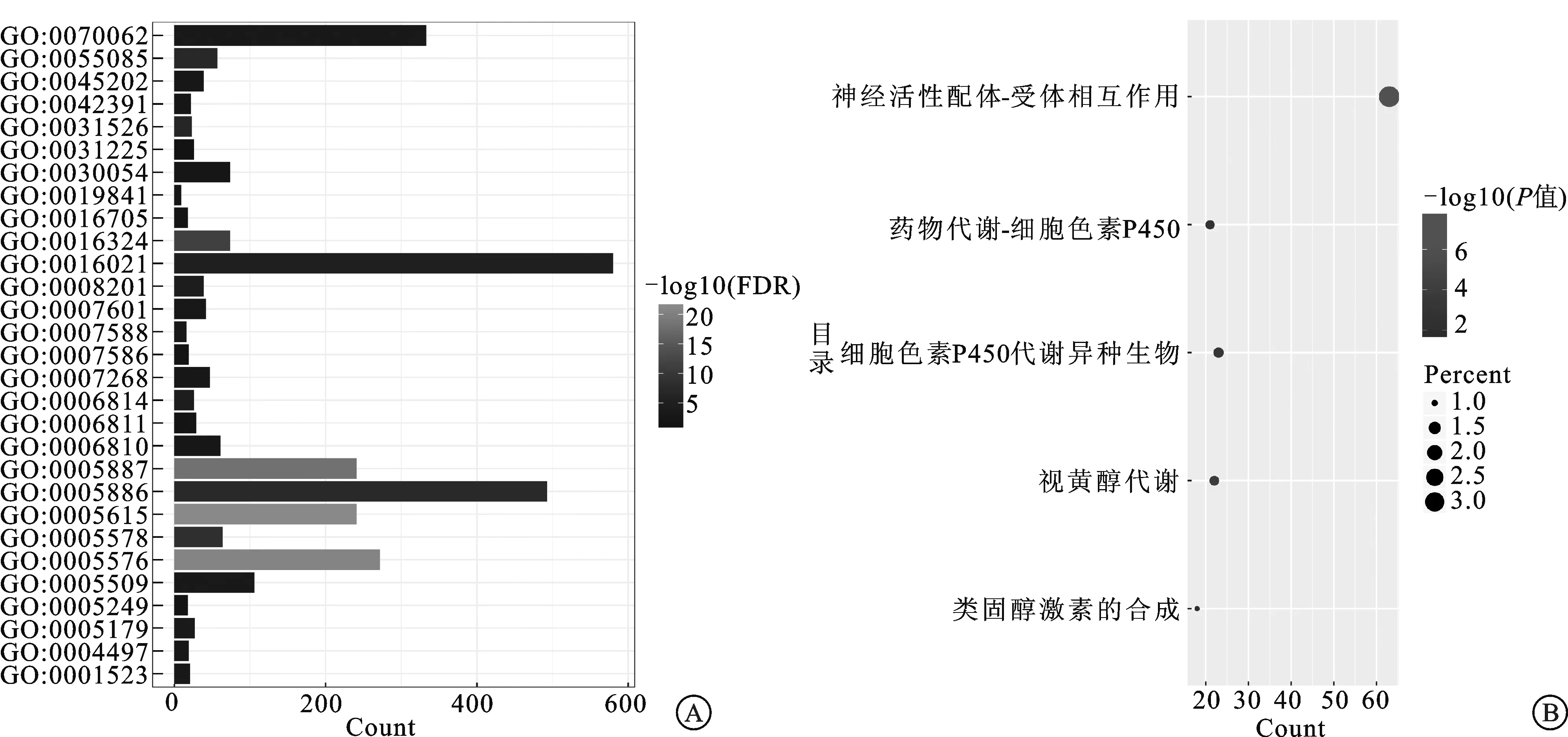
A:差異基因GO富集可視化;B:差異基因KEGG通路富集可視化。
2.3 差異表達基因的PPI網絡分析結果通過STRING數據庫對腎母細胞瘤發病的差異表達基因構建PPI網絡,利用Cytoscape軟件中Cytohubba篩選PPI網絡中的連接程度前10位Hub基因(圖4),分別是:KNG1、AGT、CASR、SST、AGTR2、PMCH、GNG4、DRD2、MCHR2、SSTR3。
2.4 關鍵基因的生存分析對排名前10位的Hub基因進行生存分析,構建出Kaplan-Meier生存曲線,發現只有MCHR2的表達對腎嫌色細胞癌患者的總生存率(overall survival,OS)影響差異有統計學意義(P<0.05),其余基因的表達水平都與腎嫌色細胞癌無顯著相關性。

圖4 PPI網絡篩選的10 Hub基因
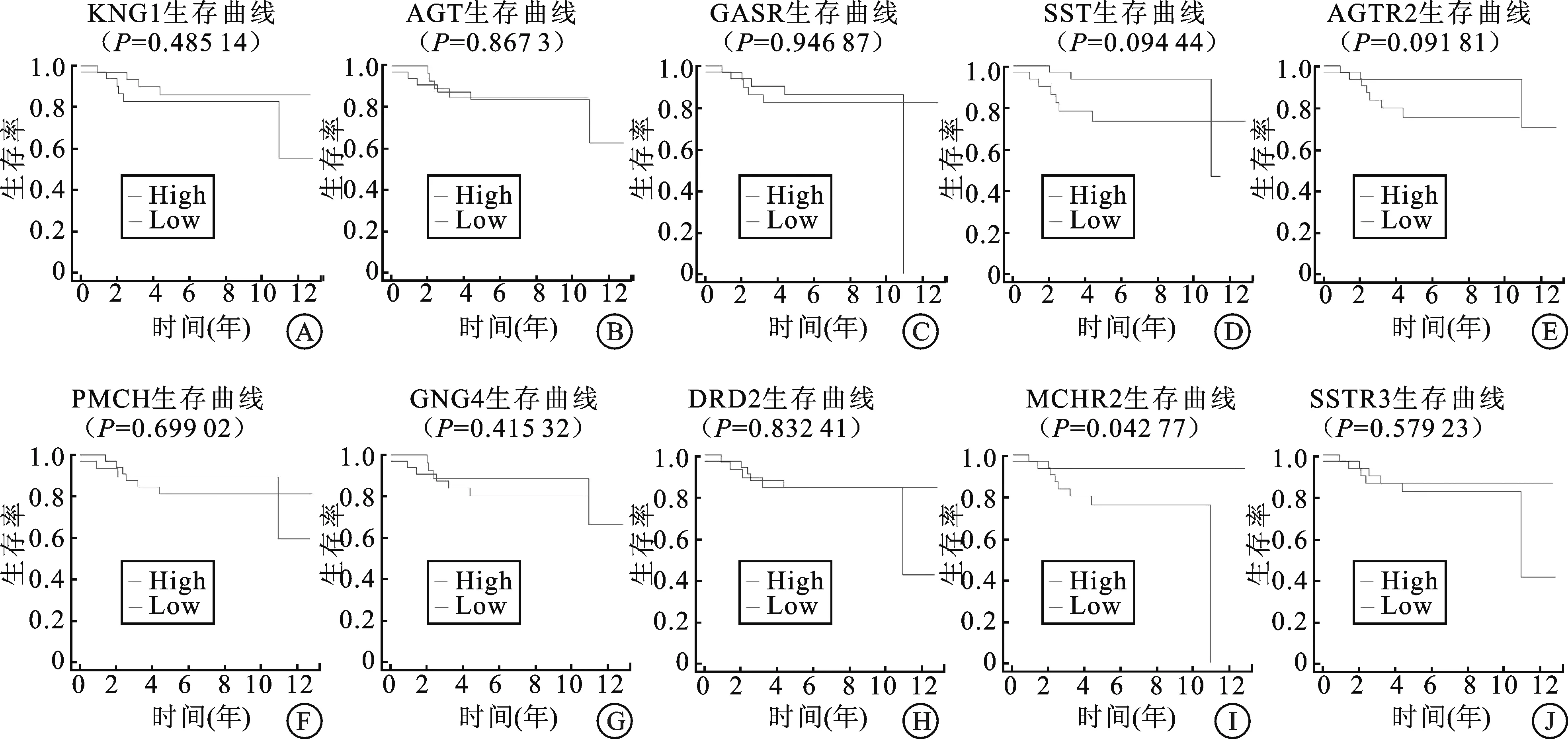
A:KNG1;B:AGT;C:CASR;D:SST;E:AGTR2;F:PMCH;G:GNG4;H:DRD2;I:MCHR2;J:SSTR3。
3 討 論
腎嫌色細胞癌是起源于腎小管集合上皮細胞的惡性腫瘤,雖然臨床上不常見,但是在nccRCC中,其發病率僅次于乳頭狀腺癌[8]。雖然chRCC少見且為低度惡性潛能的腫瘤,但是仍有部分預后差、進展期的患者需要輔助治療。因此將chRCC各個時期與環節中共同表達的相關基因進行深入研究,挖掘出疾病發生與發展中起關鍵調控作用的基因,對了解疾病的機制、改進疾病的治療措施以及相應靶向藥物的研發十分重要。
本研究致力于篩選并分析與腎嫌色細胞癌發病及進展相關的關鍵基因,通過對TCGA數據庫檢索篩選共挖掘出腎嫌色細胞癌差異表達基因1 850個,其中包括了表達上調基因760個和表達下調基因1 090個。通過GO富集分析和KEGG富集分析來篩選與分析差異表達基因,最終得到各個差異表達基因的生物學功能。在BP中差異基因主要富集于細胞跨膜轉運、化學突觸傳遞、膜電位調節等。在CC中差異基因富集于細胞外區域、質膜。在MF中差異基因主要富集于氧化還原酶活性、鈣離子結合、K離子通道等。在KEGG通路分析中主要富集于神經活性配體-受體相互作用、視黃醇代謝、類固醇激素的合成。隨后進一步通過STRING數據庫對腎嫌色細胞癌差異表達基因構建PPI網絡,結果發現這些基因編碼的蛋白調節點主要集中在KNG1、AGT、CASR、SST、AGTR2、PMCH、GNG4、DRD2、MCHR2、SSTR3。
激肽原(Kininogen 1,KNG1)重組蛋白參與機體各種生理活動,例如控制血管的擴張、維持水電解質的平衡以及調控細胞的凋亡等[9]。如今越來越多的證據表明KNG1似乎具有抗血管生成的功能,并能阻斷內皮細胞的增殖,在癌癥的發生起到一定的作用[10]。此外還有研究表明,在癌癥患者的血清中檢測到KNG1基因的低表達,因此KNG1可以作為癌癥和晚期大腸腺瘤的潛在血清預測因子[11]。編碼血管緊張素原的AGT則可以抑制腫瘤的進展和轉移,因為有研究已證實AGT能夠獨立于血管緊張素Ⅱ在機體內產生非常強大的抗血管生成作用[12],實驗中AGT的過度表達能明顯降低腫瘤內新生血管的形成,從而延緩了腫瘤的發展[13],這代表了AGT有望成為抑制腫瘤生長和轉移的新的研究方向。CASR基因在人體腎臟組織中廣泛表達,對維持人體健康組織的鈣穩態起著至關重要的作用[14]。最近一項研究證明,在腎部分切除術后5年內發生骨轉移的細胞標本中,CASR的表達最高[15]。研究也指出CASR的過度表達可能誘導RCC癌細胞的增殖潛能以及癌細胞的鈣依賴性粘附,從而增加骨轉移的概率[16]。此外,DRD2缺失也與多種腫瘤的發生有關[17],大量研究顯示DRD2與結直腸癌、非小細胞癌和胃癌的發病皆有關聯。這是因為DRD2具有遺傳多態性,這種多態性與細胞mRNA的穩定性和蛋白質翻譯的改變有關[18],DRD2密度的降低會減少對細胞生長的抑制及改變細胞內凋亡信號,從而導致細胞的癌變,增加患癌癥的風險。MCHR2是黑色素濃縮激素(Modifier of chinchilla,MCH)的受體之一,該基因位于人類第6號染色體長臂上[19]。本研究發現MCHR2是唯一與腎嫌色細胞癌患者的OS有顯著相關性的關鍵基因。研究發現MCHR2和肥胖癥密切相關,MCHR2受到MCH的激活后調節下丘腦的能量穩態調節器,從而控制機體的飲食行為和能量消耗[20],特別是非典型抑郁癥患者MCHR2基因的變異是其BMI升高的危險因素之一[21]。在腫瘤中尚無MCHR2基因的研究,本研究顯示MCHR2與腎嫌色細胞癌預后顯著相關,因此MCHR2可作為腎嫌色細胞癌研究的新方向。
本研究從TCGA數據庫中篩選出了與chRCC疾病發生與發展相關的基因,并挖掘及討論與腎嫌色細胞癌相關的關鍵基因。MCHR2有可能成為腎嫌色細胞癌潛在的治療靶點及預后標志物。但是,由于與腎嫌色細胞癌相關的基因層面的研究仍缺乏,因此還需要大量的研究來闡明這些基因在腎嫌色細胞癌的發病機制中的生物學功能,并為腎嫌色細胞癌的治療提供新的線索和方向。