冠心病患者血漿miR-10a、miR-342-5p表達與炎性因子的關系及其預測價值
方填源,陳哲林,勞彩光,董德懷,余英滔
冠心病是指冠狀動脈發生粥樣硬化病變使血管腔狹窄、堵塞,繼而引發心肌缺血缺氧甚至壞死所致的心臟病[1],隨著經濟的飛速發展及生活節奏的加快,冠心病發病逐漸年輕化且發病率呈不斷增加趨勢,對人類健康造成嚴重威脅。冠心病發病早期血管堵塞不嚴重,患者無明顯臨床癥狀,在病情尚未進展前及時診治,對改善患者預后具有重要意義。動脈粥樣硬化是冠心病病理基礎,是由慢性炎性反應、免疫紊亂等因素相互作用所致的慢性炎性疾病,多種炎性因子參與其發生發展過程[2]。微小核糖核酸(miRNA)是長度17~25個核苷酸的單鏈小分子RNA,無編碼蛋白質的功能,通過結合互補mRNA序列的3’-UTR以抑制miRNA的翻譯或加速其降解,從而發揮對下游靶基因調控的作用,隨著對分子生物學研究的不斷深入,已經證實miRNA介導了心腦血管疾病、糖尿病、惡性腫瘤等疾病的發生發展過程[3]。研究表明[4-5],微小核糖核酸-10a(miR-10a)、miR-342-5p與多種惡性腫瘤發病密切相關,可作為預測疾病和判斷預后的標志物。現分析miR-10a、miR-342-5p與冠心病發病的關系及其對冠心病的預測價值,報道如下。
1 資料與方法
1.1 臨床資料 選取2016年8月—2019年2月廣東省茂名市中醫院心血管病科診治的冠心病患者153例為觀察組,其中男89例,女64例,年齡47~78(61.29±10.97)歲。根據臨床分型分為急性心肌梗死(AMI)亞組61例,不穩定型心絞痛(UAP)亞組49例,穩定型心絞痛(SAP)亞組43例。根據紐約心臟病學會心功能分級(NYHA)[6],心功能Ⅱ級患者78例:病程1~7 (4.37±2.33)年;冠心病誘因:動脈粥樣硬化47例,肥胖31例;基礎疾病:高血壓14例,糖尿病17例,高脂血癥13例;家族遺傳史29例。心功能Ⅲ級患者41例,病程3~9 (5.67±2.61)年;冠心病誘因:動脈粥樣硬化24例,肥胖17例;基礎疾病:高血壓10例,糖尿病12例,高脂血癥9例;家族遺傳史16例。心功能Ⅳ級患者34例,病程3~10(6.38±2.99)年;冠心病誘因:動脈粥樣硬化20例,肥胖14例;基礎疾病:高血壓11例,糖尿病7例,高脂血癥7例;家族遺傳史11例。隨機選取同期在醫院進行體檢的健康志愿者100例為健康對照組,男63例,女37例,年齡43~75(59.22±11.68)歲。觀察組與對照組性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。本研究獲得醫院倫理委員會批準,研究對象及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準: ①所有患者均有典型臨床癥狀,心電圖、超聲心動圖等檢查符合冠心病表現,經冠狀動脈造影檢查證實3支主要的冠狀動脈或者其重要分支中,至少1支冠狀動脈狹窄超過50%,并符合美國心臟病學會/美國心臟協會中關于冠心病診斷標準[7];②患者年齡≥18歲;③臨床病歷資料完整者。(2)排除標準: ①孕產婦及哺乳期婦女;②肝、腎功能障礙者;③血液系統疾病者;④急、慢性炎性反應性疾病者;⑤自身免疫性疾病者;⑥慢性阻塞性肺疾病患者;⑦惡性腫瘤患者;⑧其他可能影響本研究結果的疾病。
1.3 觀察指標與方法 冠心病患者入院翌日晨、健康志愿者于體檢當天抽取外周靜脈血8 ml備用。
1.3.1 血漿miR-10a、miR-342-5p檢測:上述靜脈血4 ml加入EDTA抗凝劑試管中,在室溫環境下靜置,收集血漿裝入EP管中,保存在-80℃環境,用于檢測miR-10a、miR-342-5p的表達。
1.3.1.1 提取總RNA及反轉錄合成cDNA 使用血清總RNA提取試劑盒(miR-Neasy Serum/Plasma Kit)和RNA轉錄試劑盒(miScript II RT Kit)完成總RNA的提取和反轉錄(均購自德國凱杰公司),具體流程為:將血漿樣本2 ml與Trizol溶液充分混勻后在室溫下靜置5 min,再將氯仿0.2 ml加入其中振蕩,充分混勻、靜置,提取總RNA。提取過程嚴格按照Trizol試劑盒說明書進行,Agilents RNA LabChip Bioanalyzer儀(ARLC&2100B,購自美國Agilent公司)驗純后反轉錄合成cDNA,設計反轉錄體系20 μl:RNA 1 μg ,2×RT mix 10 μl、oligo dNTPs 1 μl、 mix 2 μl、Random hexamers 1 μl,最后加入 RNase Free H2O 5 μl;反應條件:25℃ 5 min,50℃ 15 min,85℃ 5 min。
1.3.1.2 RT-qPCR法 利用PCR引物設計軟件Primer Premier 5.0設計miR-10a、miR-342-5p引物序列,逆轉錄過程參照試劑盒說明書進行。U6為內參基因,上游引物序列為:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列為:5’-AACGCTTCACGAATTTGCGT-3’;miR-10a上游引物序列為:5’-CGCACAAATTCGGATCTACAGGGTA-3’,下游引物序列為:5’-GTGCAGGGTCCGAGGT-3’;miR-342-5p上游引物序列為:5’-CTCAACTGGTGTCGTGG AGTCGGCAATTCAGTTGAGTCAATCAC-3’,下游引物序列為:5’-ACACTCCAGCTGGGA GGGGTGCTATCTGT-3’,miR-10a、miR-342-5p引物序列均由Invitrogen公司合成。于7500型實時熒光定量PCR儀(美國ABI公司)上進行PCR擴增: SYBR Premix Ex Taq II 10 μl, ROX Reference Dye II 0.4 μl, U6 Primer 1.6 μl, cDNA 2 μl, RNase Free H2O 6 μl;擴增條件:95℃持續10 s 變性,95℃持續5 s,60℃持續20 s,95℃持續1 min,55℃持續30 s,95℃持續30 s,60℃持續15 s,共40個循環;每個樣本均設3個復孔后取平均值。miR-10a、miR-342-5p相對表達量采用2-△△Ct表示,△Ct=Ct(miR-10a/miR-342-5p)-Ct(U6),△△Ct=△Ct(miR-9/miR-34c)-△Ct(校準標本)[5]。
1.3.2 血清炎性因子檢測:上述靜脈血4 ml離心留取上清液裝于EP管中,保存在-80℃環境下,用于檢測炎性因子水平。采用酶聯免疫吸附法檢測血清白介素-6(IL-6)、IL-8、IL-10、高敏C-反應蛋白(hs-CRP)、腫瘤壞死因子-α(TNF-α)水平,試劑盒均由上海酶聯生物公司提供,檢測過程嚴格按照試劑盒說明書進行。
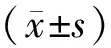
2 結 果
2.1 血漿miR-10a、miR-342-5p表達比較 各組(亞組)血漿miR-10a表達水平比較,AMI亞組
2.2 各組血清炎性因子水平比較 血清IL-6、IL-8、hs-CRP、TNF-α水平比較,AMI亞組>UAP亞組>SAP亞組>健康對照組(P均<0.05),而IL-10水平比較,AMI亞組
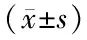
表1 各組血漿miR-10a、miR-342-5p表達水平比較
2.3 冠心病患者血漿miR-10a、miR-342-5p表達水平與血清炎性因子的相關性 經Pearson相關分析,冠心病患者血漿miR-10a表達水平與血清IL-6、IL-8、hs-CRP、TNF-α呈負相關,與IL-10呈正相關(P均<0.01);miR-342-5p與血清IL-6、IL-8、hs-CRP、TNF-α呈正相關,與IL-10呈負相關(P均<0.01),見表3。

表3 冠心病患者血漿miR-10a、miR-342-5p表達水平與血清炎性因子的相關性
2.4 血漿miR-10a、miR-342-5p預測冠心病的價值 采用ROC曲線下面積(AUC)評估血漿miR-10a、miR-342-5p對冠心病的預測價值, miR-10a、miR-342-5p及miR-10a聯合miR-342-5p預測冠心病的AUC分別為0.883(95%CI0.825~0.944)、0.892(95%CI0.836~0.949)、0.952(95%CI0.915~0.989),最佳截斷值miR-10a為1.107,miR-342-5p為0.22,miR-10a、miR-342-5p敏感度、特異度、準確度分別為0.82、0.85、0.76、0.81、0.78、0.82、約登指數分別為0.58、0.66;miR-10a聯合miR-342-5p預測冠心病的價值最大,敏感度、特異度、準確度為0.86、0.85、0.87,約登指數為0.71,見圖1。

圖1 血漿miR-10a、miR-342-5p預測冠心病的ROC曲線
3 討 論
冠心病是嚴重威脅人類健康的重大疾病,據WHO估計,全球每年約2.5億人患心血管疾病,其中冠心病將會成為患者致殘和致死的首位原因[8]。我國是心血管疾病高發國家,截至2012年,我國心血管疾病發病人數高達2.9億人,死亡人數每年約350萬人[9-10]。早期發現和診斷冠心病,并及時評估患者的病情嚴重程度,對臨床制定針對性干預措施、改善患者病情具有積極意義。
隨著科技的不斷進步,從分子生物學角度探索疾病的診斷和治療靶點成為近幾年的研究熱點。miRNA是廣泛存在于血液、尿液中的非編碼小分子RNA,轉錄后能特異性結合靶mRNA 3’端的非翻譯區而抑制靶mRNA翻譯,特異性結合靶mRNA 5’端可激活靶mRNA的表達[11]。miRNA參與了機體各種生理過程,如細胞增殖、分化、凋亡,機體的生長發育、脂肪代謝及器官形成等,病理狀態下,miRNA異常表達通過介導機體炎性反應、氧化應激反應等環節而參與疾病的發生發展[12]。研究顯示[13-14],miRNA作為抑癌基因和促癌基因參與調控惡性腫瘤的發生發展過程,并且與疾病臨床病理特征密切相關,可作為預測惡性腫瘤及評估預后的重要生物標志物。另有研究發現[15],miRNA異常表達在類風濕性關節炎等炎性反應性疾病發病過程中通過調控炎性因子水平參與疾病的進展。并且,較傳統生化標志物而言,外周血中miRNA檢測具有無創性,預測疾病具有較高的敏感度和特異度,可見miRNA用于預測疾病和評估病情嚴重程度具有諸多優勢。
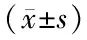
表2 冠心病患者與健康對照組血清炎性因子水平比較
miR-10a是位于17號染色體上的一種重要miRNA,研究顯示,miR-10a表達上調介導了子宮內膜癌、胰腺癌等惡性腫瘤的發病過程[16-17]。楊海等[15]證實,miR-10a在類風濕性關節炎細胞和滑膜組織中表達下調,并通過影響NF-κB通路的活化而與類風濕性關節炎成纖維細胞樣滑膜細胞的侵襲、遷移有關。關于miR-10a在心臟病發病過程中的作用,目前相關研究較少。miR-342屬于一種miRNA,其基因位于Evl基因的第三個內含子區,在生物合成過程中分別形成miR-342-3p和miR-342-5p,其中miR-342-5p已被證實參與了乳腺癌、結腸癌等惡性腫瘤的發病過程[18-19]。Natarelli等[20]發現miR-342-5p具有保護心肌細胞的作用,長期鍛煉的人動脈血管會分泌miR-342-5p并將其運送至心臟,通過保護心肌細胞免受損傷而減少心肌梗死發生風險。基于以上不足,本研究旨在探討miR-342-5p、miR-10a在冠心病發病過程中的作用。
本結果顯示,不同類型和不同心功能分級冠心病患者血漿miR-10a表達水平均低于健康對照者,miR-342-5p表達水平高于健康對照者,隨著病情的加重,miR-342-5p、miR-10a表達異常顯著,提示血漿miR-10a、miR-342-5p參與了冠心病的發病過程,并可作為評估病情嚴重程度的重要指標,與既往報道結果基本一致[20-21],原因主要可能與miR-10a、miR-342-5p及炎性因子在冠心病患者機體中的作用機制有關,miR-10a、miR-342-5p可通過激活機體氧化應激反應,參與 NF-κB 通路的信號傳導,最終引起心肌缺血再灌注導致的神經損傷。冠狀動脈粥樣硬化斑塊不穩定破裂或脫落堵塞血管腔或者使其變狹窄,心肌缺血缺氧導致冠心病,而巨噬細胞吞噬氧化型低密度脂蛋白后所致的炎性反應是粥樣硬化斑塊形成的病理基礎,miR-10a可調控脂質的攝入及抑制炎性因子的分泌,當其水平降低時脂質紊亂、炎性因子分泌過多,炎性反應加重,最終促進了冠心病的發生發展[21-22]。miR-342-5p通過抑制Caspase-9及Jnk2蛋白表達而促進細胞凋亡,加速心肌死亡而致心肌梗死[23]。冠心病發生過程中存在持續性炎性反應,大量炎性因子不斷分泌和釋放。IL-6、IL-8、hs-CRP、TNF-α是促炎因子,可反映炎性強度,其水平越高提示炎性反應越重,IL-10為抑制炎性反應的標志物,其水平升高提示炎性反應減弱,與李志等[24]報道一致,但在該研究中并未發現UAP患者血清IL-8、IL-10水平與AMI患者有差異,這可能與該研究選取的樣本量較小有關。本研究發現,隨著冠心病病情嚴重程度增加,促炎因子水平顯著升高,抑炎因子水平降低,提示冠心病病情嚴重程度與炎性反應密切相關。
相關性分析結果顯示,冠心病患者血漿miR-10a、miR-342-5p表達水平與血清IL-6、IL-8、IL-10、hs-CRP、TNF-α呈不同程度相關性,提示miR-10a、miR-342-5p可能通過介導炎性反應而參與冠心病發生、發展過程。miR-10a可促進血管形成、增生,調節脂質代謝,其表達水平下調可致促炎因子水平升高及抗炎因子表達下降,激活NF-κB信號通路,促進心肌細胞凋亡。miR-342-5p通過介導炎性反應過程可抑制Akt1蛋白磷酸化,損傷心肌細胞。ROC結果顯示,miR-10a、miR-342-5p預測冠心病具有較高的價值,AUC分別為0.883、0.892,敏感度和特異度接近。而兩者聯合預測的AUC為0.952,敏感度、特異度分別為0.86、0.85,提示聯合檢測更可提高臨床輔助預測冠心病的診斷效能。
綜上所述,血漿miR-10a、miR-342-5p異常表達通過介導炎性反應而參與冠心病的發病過程,并與病情嚴重程度密切相關,早期聯合檢測可作為輔助預測冠心病的重要生化指標。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
方填源:設計研究方案,實施研究過程,論文撰寫;陳哲林:提出研究思路,分析試驗數據,論文審核;勞彩光:進行統計學分析;董德懷、余英滔:實施研究過程,資料搜集整理

