牛卵形巴貝斯蟲病二溫式PCR診斷方法的建立
田萬年,王妍慧,薛書江,賈立軍,張守發
(1. 吉林農業科技學院動物科技學院,吉林 吉林 132101 ; 2. 延邊大學農學院,吉林 延吉 133002)
牛的卵形巴貝斯蟲病(Babesiaovata)是由巴貝斯科巴貝斯屬的卵形巴貝斯蟲寄生于牛紅細胞內所引起的寄生蟲病[1]。病牛多表現為高熱、貧血、黃疸和血紅蛋白尿,多引起死亡[2-3]。我國于1986年在河南省盧氏縣牛體內發現本病,隨后1994年,在甘肅張家川回族自治縣牛體內分離到卵形巴貝斯蟲[4]。目前牛卵形巴貝斯蟲的診斷主要通過血液涂片,顯微鏡檢查為主,隱性感染牛的血液染蟲率較低,顯微鏡檢測易出現漏檢和誤診。因此,急需建立一種敏感性高、特異性強,用于該病早期診斷。PCR方法是一種快速、敏感、特異的診斷方法,已廣泛應用寄生蟲病的診斷[5-6]。二溫式PCR方法比常規PCR方法特異性更強,所需時間更少[7]。目前尚未見應用二溫式PCR診斷牛卵形巴貝斯蟲病的文獻報道。本試驗根據卵形巴貝斯蟲18S rRNA基因序列設計1對引物,建立了二溫式PCR方法,為今后牛卵形巴貝斯蟲病的診斷和流行病學調查提供科學理論依據。
1 材料與方法
1.1 病料來源 血液樣本采自吉林省琿春地區散養的延邊黃牛60份,無菌采集抗凝血,用PBS洗3次。存于-20 ℃備用。同時制作了血液涂片,甲醛固定保存,供染色鏡檢。牛巴貝斯和雙芽巴貝斯蟲標準基因組DNA由日本帶廣畜產大學玄學南教授惠贈。瑟氏泰勒蟲基因組DNA由延邊大學預防獸醫實驗室保存。
1.2 主要試劑 全血DNA提取試劑盒、TaqDNA聚合酶、dNTP、Agarose Gel DNA Extraction Kit、DL-2 000 DNA Marker等,均購自寶生物工程(大連)有限公司。
1.3 PCR診斷方法的建立
1.3.1 引物的設計與合成 根據GenBank上登錄的牛卵形巴貝斯蟲18S rRNA基因(LC125457),利用Primer Premier 5.0軟件在保守區設計了1對二溫式PCR引物,引物P1:5′-TAGTTCTTAACCGACTTTC-TCG-3′,P2:5′-TTCTCAAGTAAAAATAGGCCC-3′,擴增預期片段大小為464 bp。引物由寶生物工程(大連)有限公司合成。
1.3.2 牛卵形巴貝斯蟲DNA標準模板的制備 將經姬姆薩染色后顯微鏡檢查確診為牛卵形巴貝斯蟲感染的抗凝血,按照全血基因組DNA提取試劑盒說明書操作提取基因組DNA,抽提的DNA用50 μL TE溶解,-20 ℃保存備用。
1.3.3 PCR擴增及退火-延伸溫度的篩選 以提取的卵形巴貝斯蟲DNA為模板,PCR反應條件如下:94 ℃預變性5 min,94 ℃變性30 s,62 ℃退火-延伸30 s,30個循環,最后72 ℃延伸7 min。退火-延伸溫度梯度為 58~64 ℃。
1.3.4 PCR產物的鑒定 將回收的PCR產物經純化后,送至生工生物工程(上海)股份有限公司序列測定。
1.3.5 特異性試驗 以卵形巴貝斯蟲基因組DNA為試驗樣本,以牛巴貝斯蟲、雙芽巴貝斯蟲和瑟氏泰勒蟲基因組DNA為對照樣本,進行二溫式和普通PCR擴增,經瓊脂糖凝膠電泳分析PCR產物。
1.3.6 敏感性試驗 用紫外分光光度計測定已提取的卵形巴貝斯蟲DNA的OD260 nm值,計算DNA含量。以10倍為梯度進行連續稀釋成7個不同濃度,按照最適退火-延伸溫度進行二溫式和普通PCR擴增,對比其敏感性。
1.4 臨床樣本的檢測試驗 應用所建立的二溫式PCR方法對采自吉林省琿春地區的60份血液樣品進行檢測。同時,與常規PCR和血液涂片鏡檢相對比,比較陽性檢出率。
2 結果
2.1 PCR擴增 對卵形巴貝斯蟲基因組DNA進行PCR擴增后經10 g/L瓊脂糖凝膠電泳檢測,出現464 bp的特異性DNA條帶(見圖1),與預期的片段大小相一致。
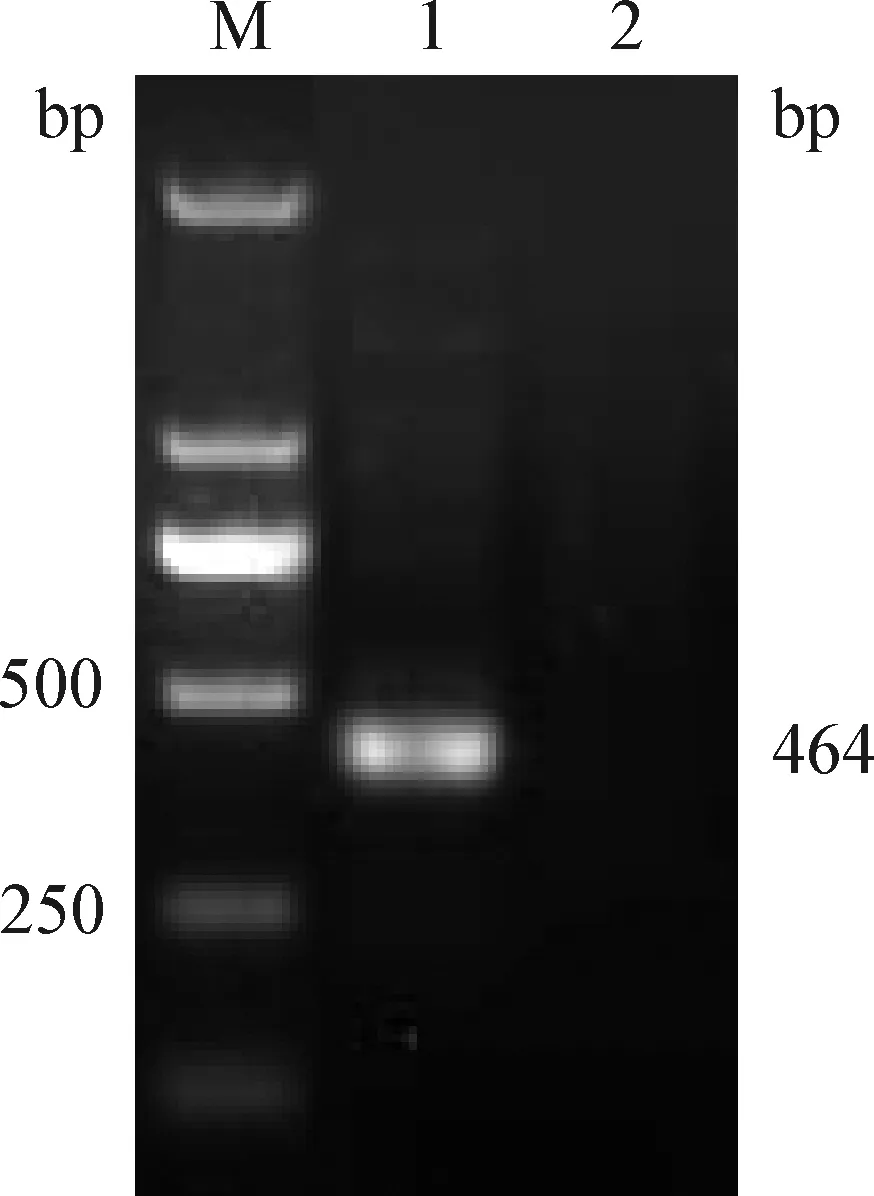
圖1 卵形巴貝斯蟲PCR擴增結果Fig. 1 PCR amplication result of Babesia ovataM:DL-2 000 DNA 標準; 1:卵形巴貝斯蟲DNA樣本; 2:空白對照M:DL-2 000 DNA marker; 1:Babesia ovata DNA; 2:Blank control
2.2 測序與序列比較 將PCR產物純化后送往生工生物工程(上海)股份有限公司測序,結果表明,其核苷酸序列與GenBank上登錄的牛卵形巴貝斯蟲18S rRNA基因序列(LC125457)同源性為 99.9%。
2.3 退火-延伸溫度的篩選 退火-延伸溫度梯度為58~64 ℃。其中,60 ℃時目的條帶最亮,因此,最佳退火-延伸溫度為60 ℃(見圖2)。
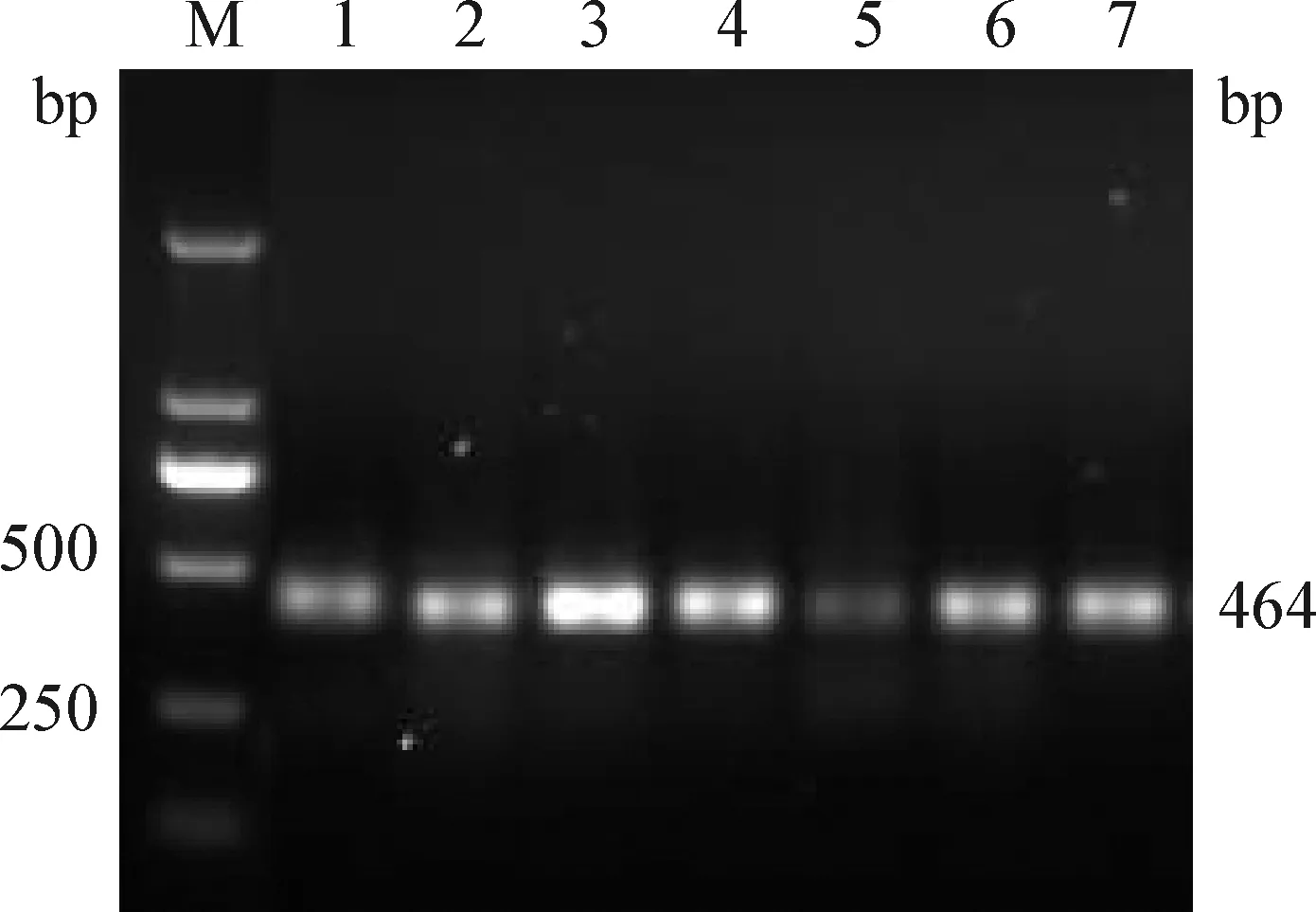
圖2 退火-延伸溫度的篩選試驗Fig. 2 Screening test for annealing-extension temperatureM:DL-2 000 DNA標準; 1:58 ℃; 2:59 ℃; 3:60 ℃; 4:61 ℃; 5:62 ℃; 6:63 ℃; 7:64 ℃M:DL-2 000 DNA marker; 1:58 ℃; 2:59 ℃; 3:60 ℃; 4:61 ℃; 5:62 ℃; 6:63 ℃; 7:64 ℃
2.4 特異性試驗 以牛卵形巴貝斯蟲、牛巴貝斯蟲、雙芽巴貝斯蟲和瑟氏泰勒蟲基因組DNA為模板,分別用二溫式和三步法進行擴增,PCR產物經10 g/L瓊脂糖凝膠電泳分析。電泳結果顯示,僅牛卵形巴貝斯蟲DNA樣本擴增后出現特異性DNA條帶,與預期片段大小相符,而作為對照樣本的牛巴貝斯蟲、雙芽巴貝斯蟲和瑟氏泰勒蟲基因組DNA均無此擴增條帶出現(見圖3)。
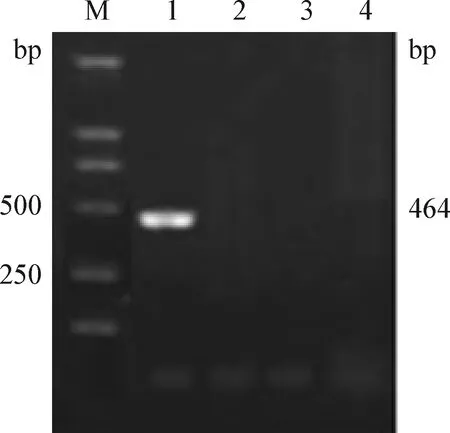
圖3 特異性試驗結果Fig. 3 The results of specific testM:DL-2 000 DNA標準; 1:卵形巴貝斯蟲; 2:雙芽巴貝斯蟲; 3:牛巴貝斯蟲; 4:瑟氏泰勒蟲M:DL-2 000 DNA marker; 1:Babesia ovata; 2:Babesia bigemina; 3:Babesia bovis; 4:Theileria sergenti
2.5 敏感性試驗 根據DNA分光光度法測定陽性模板DNA濃度為1.6×106fg/μL。將所取的DNA依次做10倍梯度稀釋,分別進行PCR擴增,反應結果進行瓊脂糖凝膠電泳檢測(見圖4)。當DNA含量為16 fg/μL時,也能擴增出特異目的條帶。
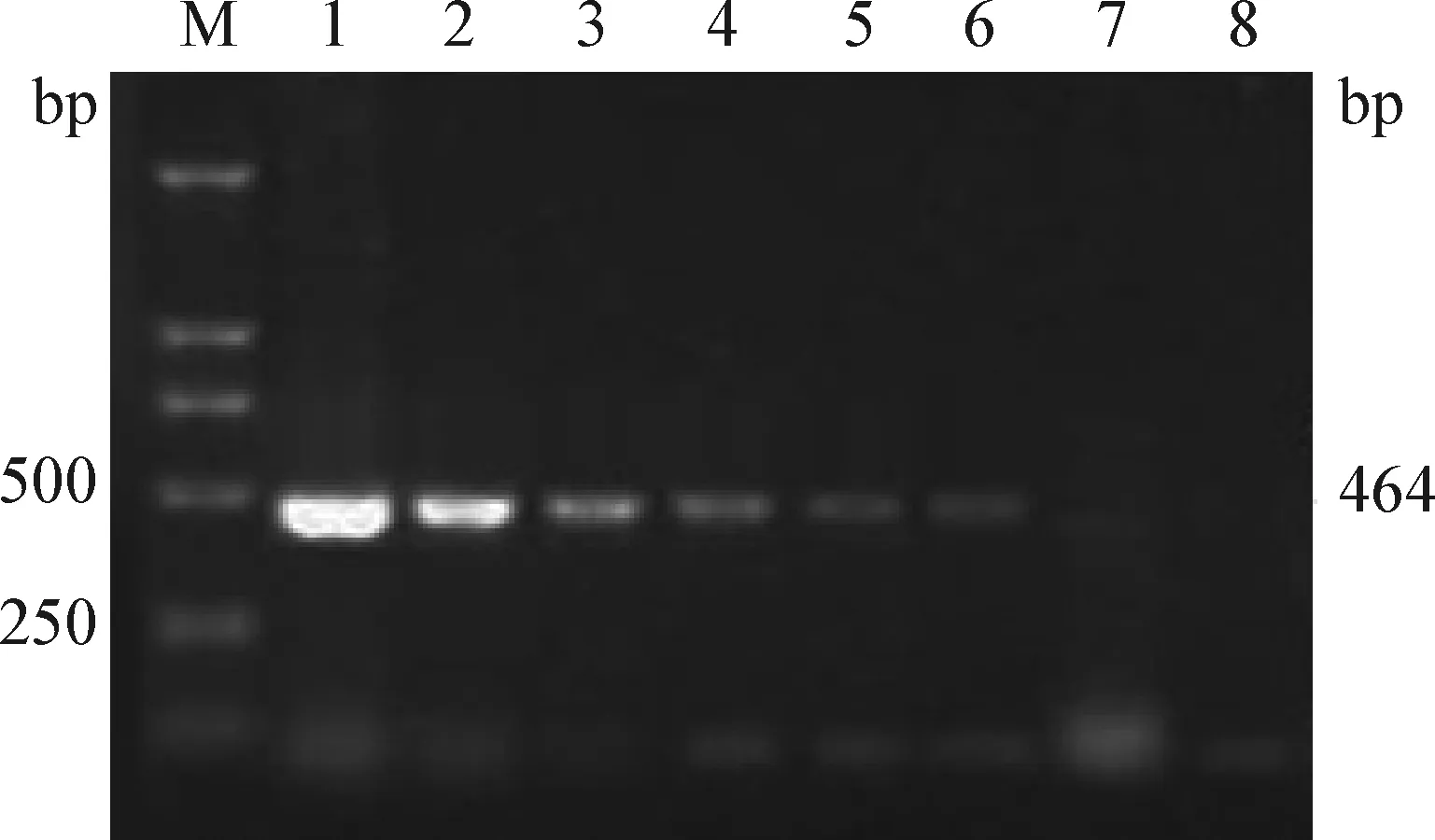
圖4 敏感性試驗結果Fig. 4 The results of sensitivity experimentM:DL-2 000 DNA標準; 1~8:1.6×106~0.16 fg/μL的PCR擴增產物M:DL-2 000 DNA marker; 1~8:PCR amplification products of 1.6×106~0.16 fg/μL
2.6 臨床樣本檢測 對采自吉林省琿春地區60份血液樣本分別進行二溫式PCR方法、普通PCR和血液涂片檢測。二溫式PCR和普通PCR方法的陽性率均為30%(18/60),2個檢測方法檢出結果差異不顯著(P>0.05),而血涂片陽性率為11.67%(7/60),且血液涂片鏡檢診斷為陽性的樣本經二溫式PCR診斷均為陽性,表明二溫式PCR方法更為敏感。
3 討論
卵形巴貝斯蟲是牛梨形蟲病最為重要的蟲種,嚴重制約養牛業的健康發展,急需建立一種快速的檢測方法。目前卵形巴貝斯蟲病PCR診斷方法目的基因為AMA-1和CCTη基因[8-9]。據報道,18S rRNA基因在梨形蟲不同蟲種間變異較大,但在同一蟲種間具有較好的保守區域,是PCR診斷首選目的基因[10-11]。因此本試驗以卵形巴貝斯蟲的18S rRNA為目的基因,設計特異性引物,建立了卵形巴貝斯蟲二溫式PCR診斷方法,特異性試驗表明,該引物只能擴增出卵形巴貝斯蟲18S rRNA基因片段,而不能擴增出瑟氏泰勒蟲、巴貝斯蟲、雙芽巴貝斯蟲基因組DNA,對該地區卵形巴貝斯蟲病的臨床診斷方面具有一定的應用價值。
本試驗對所建立的二溫式PCR各反應體系進行優化,比常規PCR退火溫度要高,提高了檢測特異性,PCR擴增時間明顯縮短,提高了該病的診斷效率。對60份血液樣本進行PCR檢測,陽性率為30%(18/60),而血液涂片染色鏡檢出的陽性率為11.67%(7/60),二者檢測的陽性符合率為100%。本試驗所建立的二溫式PCR方法為基層獸醫部門對卵形巴貝斯蟲病的早期診斷和流行病學調查提供了一種有效的檢測方法。

