氨肽酶基因anp-1在秀麗隱桿線蟲生長發育中的生物學功能
蘇山春,汪 明
(中國農業大學動物醫學院,北京 海淀 100193)
氨肽酶是一類外切蛋白酶,廣泛參與調控生物體的多肽修飾、蛋白質轉運、細胞周期發育、信號轉導等一系列生理過程[1]。根據同源性和催化機制,氨肽酶可以分為12個家族。嘌呤霉素敏感氨肽酶1(Purinomycin-sensitive aminopeptidase 1,Pam-1)是M1氨肽酶家族的成員,Pam-1 突變破壞了減數分裂和有絲分裂染色體的有效分離以及胚胎早期極性決定因素的不對稱定位,最終阻礙胚胎活力和整體孵化率[2]。包括Pam-1在內,秀麗隱桿線蟲(Caenorhabditiselegans,C.elegans)中有17個基因編碼氨肽酶。RNA干擾敲低Y67D8C.9、T16G12.1和T12E12.6等氨肽酶基因的表達水平,導致C.elegans產卵總數降低,而抑制C42C1.11、R03G8.4、ZC416.6和ANP-1等氨肽酶的表達,C.elegans產卵總數無顯著降低[3]。系統進化分析結果顯示,ANP-1、C42C1.11、R03G8.4、ZC416.6與Y67D8C.9、T16G12.1和 T12E12.6位于不同的進化分支,它們在C.elegans生長發育中可能發揮著不同的生物學功能。GFP報告基因結果表明,ANP-1在C.elegans腸道、咽部、尾部神經元和其他分泌細胞均表達[4],推測anp-1基因在C.elegans生長發育中具有其他生物學功能。
RNA干擾(RNA interference,RNAi)是由雙鏈RNA誘導的特異基因沉默現象。C.elegans以細菌為食物,因此,在C.elegans基因功能研究中,通過飼喂表達雙鏈RNA的細菌沉默特定基因是一種有效的策略[5-7]。本試驗通過構建anp-1 RNAi菌株,飼喂C.elegans,觀察分析C.elegans表型變化,初步揭示氨肽酶基因anp-1在C.elegans生長發育中的生物學功能。
1 材料與方法
1.1 主要材料和試劑E.coliHT115(DE3)菌株和DH5α-L4440菌株由河北大學柳峰松教授饋贈,由本實驗室凍存。質粒小量提取試劑盒(DP103,離心柱型)和PCR產物回收試劑盒(DP204),均購自天根生化科技有限公司;TransScript II Green One-Step qRT-PCR Super Mix,購自北京全式金生物技術有限公司(TransGen Biotech);TRIzol,購自Life Technologies Corporation;TaqDNA Polymerase和T4 DNA Ligase,均購自大連寶日醫生物技術有限公司(TaKaRa);限制性內切酶XbaⅠ和Hind Ⅲ,購自NEB公司;DNA Marker和Gold View,均購自中科瑞泰生物科技有限公司;瓊脂粉、蛋白胨、胰蛋白胨、酵母粉、異丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)和氨芐青霉素(Ampicillin,Amp)等試劑為進口分裝產品;5-氟脫氧尿苷(5-fluorodeoxyuridine,5-FUDR),購自SIGMA-ALDRICH公司;其他常規試劑均為國產分析純。
1.2anp-1 RNAi載體構建 根據anp-1(WBGene-00011587)全長序列設計特異性引物,序列如下:anp-F:5′-TGCTCTAGACACTTCGTACTGACATGTCGG-3′;anp-R:5′-CCCAAGCTTTCCATAGCACCAGCTGAGAA-G-3′,預測產物大小為499 bp。斜體為保護堿基,斜體下劃線為酶切位點:上游XbaⅠ;下游:Hind Ⅲ。按照 TRIzol 說明書提取混合生長期C.elegans總 RNA,反轉錄后收集 cDNA作為模板進行PCR。反應程序如下:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 45 s,72 ℃ 35 s,30 個循環;72 ℃延伸 10 min,16 ℃保溫。PCR產物經瓊脂糖凝膠電泳鑒定,并用PCR產物回收試劑盒收集。上述回收的PCR產物經XbaⅠ和Hind Ⅲ雙酶切后,克隆到L4440質粒。菌落PCR鑒定的HT115-L4440-anp-1陽性克隆送至生工生物工程(上海)股份有限公司進行測序。測序正確的單克隆-80 ℃凍存備用。
1.3C.elegans食物準備 從-80 ℃冰箱取出凍存的E.coliOP50、HT115-L4440(空載體)和HT115-L4440-RNAi菌株,快速解凍,分別取50 μL加入到新鮮的LB液體培養基中(有抗性的菌加入氨芐青霉素100 μg/mL),做好標記,37 ℃、200 r/min培養12~16 h進行活化。取活化好的細菌培養物3 mL, 滴加到線蟲生長基質(Nematode growth media,NGM)培養基上(含或不含IPTG 和Amp),用無菌L棒涂布,正置靜置至液體被完全吸收,做好標記,倒置,37 ℃恒溫箱靜置培養12~16 h,菌苔即可作為食物用于飼喂C.elegans。
1.4C.elegans同步 參考Yu等[8]報道的方法進行C.elegans蟲卵同步化處理。將裂解蟲體得到的蟲卵用適量的M9 Buffer重懸,加入到50 mL三角瓶中,加入15 mL M9 Buffer,將三角瓶置于搖床,37 ℃ 200 r/min孵育16~20 h。吸取少量的溶液,顯微鏡下觀察孵育到L1期幼蟲的數量。將三角瓶取出,將培養基轉移至50 mL離心管中,靜置,使L1期幼蟲沉降,盡量吸取上清并棄去,用適量的M9 Buffer重懸L1期幼蟲。根據飼喂菌株的不同將同步的L1期幼蟲分為4個試驗組,分別為E.coliOP50組、HT115-L4440(未經IPTG誘導)組、HT115-L4440(1 mmol/LIPTG 誘導)組和HT115-L4440-anp-1組,在文中分別用OP50、IPTG 0 mmol/L、IPTG 1 mmol/L和RNAi表示。
1.5C.elegans總產卵數計數、體長和壽命分析 將同步的L1期幼蟲分別置于不同菌株的9 cm NGM培養基上(含或不含抗生素和IPTG),做好標記,20 ℃ 恒溫箱靜置培養48 h左右至L4期幼蟲。用酒精燈灼燒的挑蟲針調取1條L4期幼蟲轉移至新的3 cm NGM培養基上(含或不含IPTG和抗生素),每8 小時轉移1次,轉移到新的3 cm NGM培養基上,直到不再產卵,統計每條C.elegans的總產卵數,分析結果。每組10條L4期幼蟲,試驗重復3次。用酒精燈灼燒的挑蟲針調取30條L4期幼蟲轉移至滴加有疊氮鈉(50 μL 20 mmol/L)的載玻片,室溫靜置,使C.elegans蟲體僵直,Ziss Discovery v12拍攝照片,用顯微鏡自帶軟件測量C.elegans蟲體長度,統計分析結果。試驗重復3次。用酒精燈灼燒的挑蟲針調取50條L4期幼蟲轉移至新的涂布不同菌株的9 cm NGM培養基上(含有5-氟脫氧尿苷,含或不含抗生素和IPTG),每12 小時觀察1次,將死亡的C.elegan移除。每24 小時將活著的C.elegans轉移至新的NGM培養基上,直到C.elegans全部死亡。C.elegans死亡判斷標準:挑蟲針輕輕觸碰蟲體無反應。試驗完成后統計并繪制死亡曲線。試驗重復3次。
1.6 熒光定量PCR 選取在C.elegans壽命調節中發揮重要作用的基因 (daf-2、age-1、daf-16、daf-28、glp-1、unc-62、ins-1和ins-7),利用Primer Primer 5設計特異性引物。引物序列見表1。熒光定量PCR反應程序如下:50 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s,60 ℃ 10 s,72 ℃ 10 s,40個循環;95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。以GAPDH為內參,采用2—△△CT法計算不同基因在以不同細菌為食物的C.elegans中的相對表達量。
1.7 數據統計與分析C.elegans體長、總產卵數和生存曲線數據采用GraphPad Prism 5軟件統計分析。試驗數據用平均值±標準差(Mean±SD)表示。體長、總產卵數和不同飼喂組mRNA相對表達量采用單因素方差分析(One-way analysis of variance,ANOVA)進行統計學分析。C.elegans生存曲線采用log-rank 法(Mantel-Cox)進行統計學分析。
2 結果
2.1 RNAi沉默anp-1基因效率驗證 菌落PCR瓊脂糖凝膠電泳結果表明,成功構建HT115-L4440-anp-1 RNAi菌株(圖1A)。為了驗證anp-1沉默效率,提取以不同株細菌為食物的L4期C.elegans的總RNA,逆轉錄后進行熒光定量PCR試驗。結果顯示,RNAi 組anp-1基因mRNA相對表達量比OP50組減少了約85%,差異極顯著(P<0.001)(圖1B),表明構建的RNAi菌株可以用于后續的anp-1基因沉默試驗。
2.2 RNAi 敲低anp-1基因導致C.elegansN2株總產卵數(Brood size)變化 為了觀察沉默anp-1基因對C.elegans總產卵數的影響,分別以E.coliOP50、HT115-L4440(未經IPTG誘導)、HT115-L4440(1 mmol/L IPTG誘導)和HT115-L4440-anp-1(1 mmol/L IPTG誘導)菌株飼喂野生型C.elegans,每天將C.elegans轉移到新的NGM平板上,直到其不再產卵,記錄并統計總產卵數(n=10):OP50組為203±30;IPTG 0 mmol/L組為213±33;IPTG 1 mmol/L組為210±26;RNAi組為169±32。圖2可見,抑制anp-1基因表達,C.elegans總產卵數減少,但與OP50組無統計學差異(P>0.05)。

表1 熒光定量PCR引物Table 1 Primers for real-time PCR
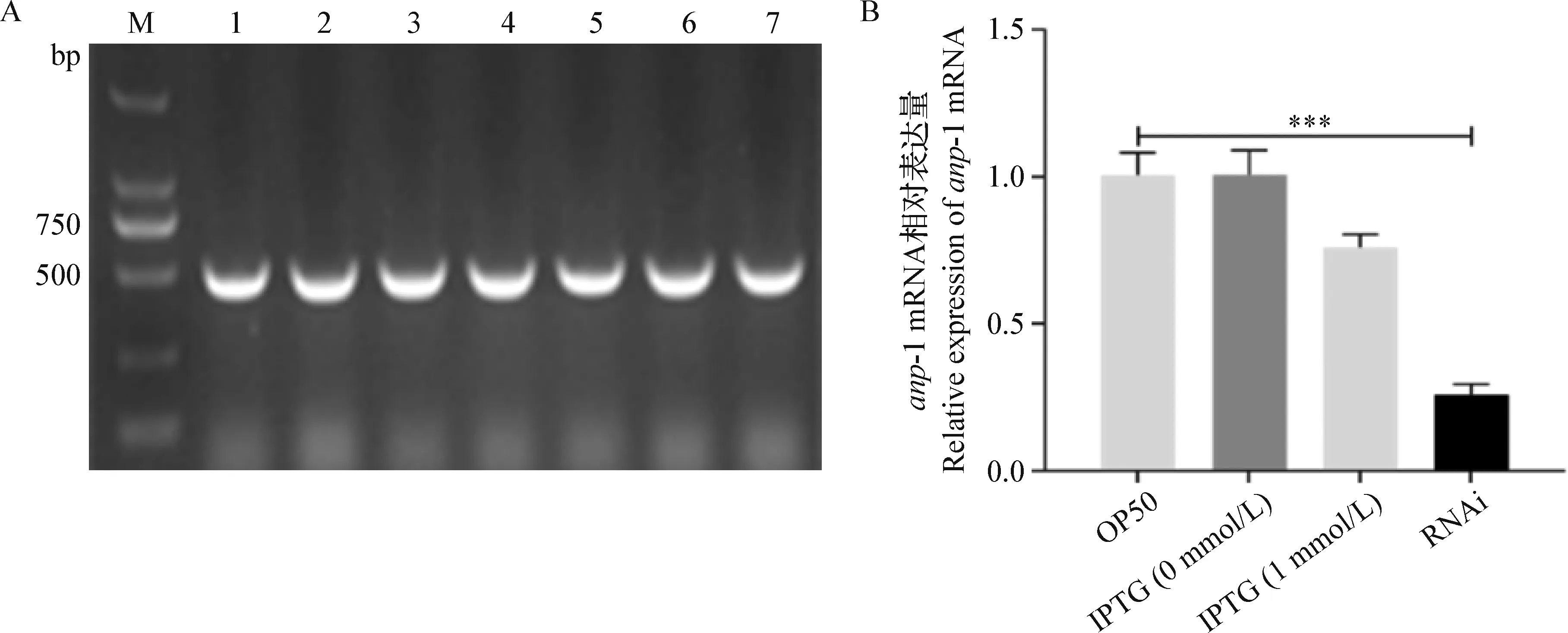
圖1 anp-1 RNAi陽性克隆鑒定及其干擾效率驗證Fig.1 Identification of anp-1 RNAi clone and RNAi efficiencyA:M:DL-2 000 DNA marker; 1~7:anp-1 RNAi 克隆鑒定瓊脂糖凝膠電泳結果; B:qRT-PCR驗證anp-1基因沉默效率***:P<0.001; 下圖同A:M:DL-2 000 DNA marker; 1~7:Agarose gel electrophoresis analysis of anp-1 RNAi clone; B:Identification of RNAi efficiency using qRT-PCR***: P<0.001. The same as below
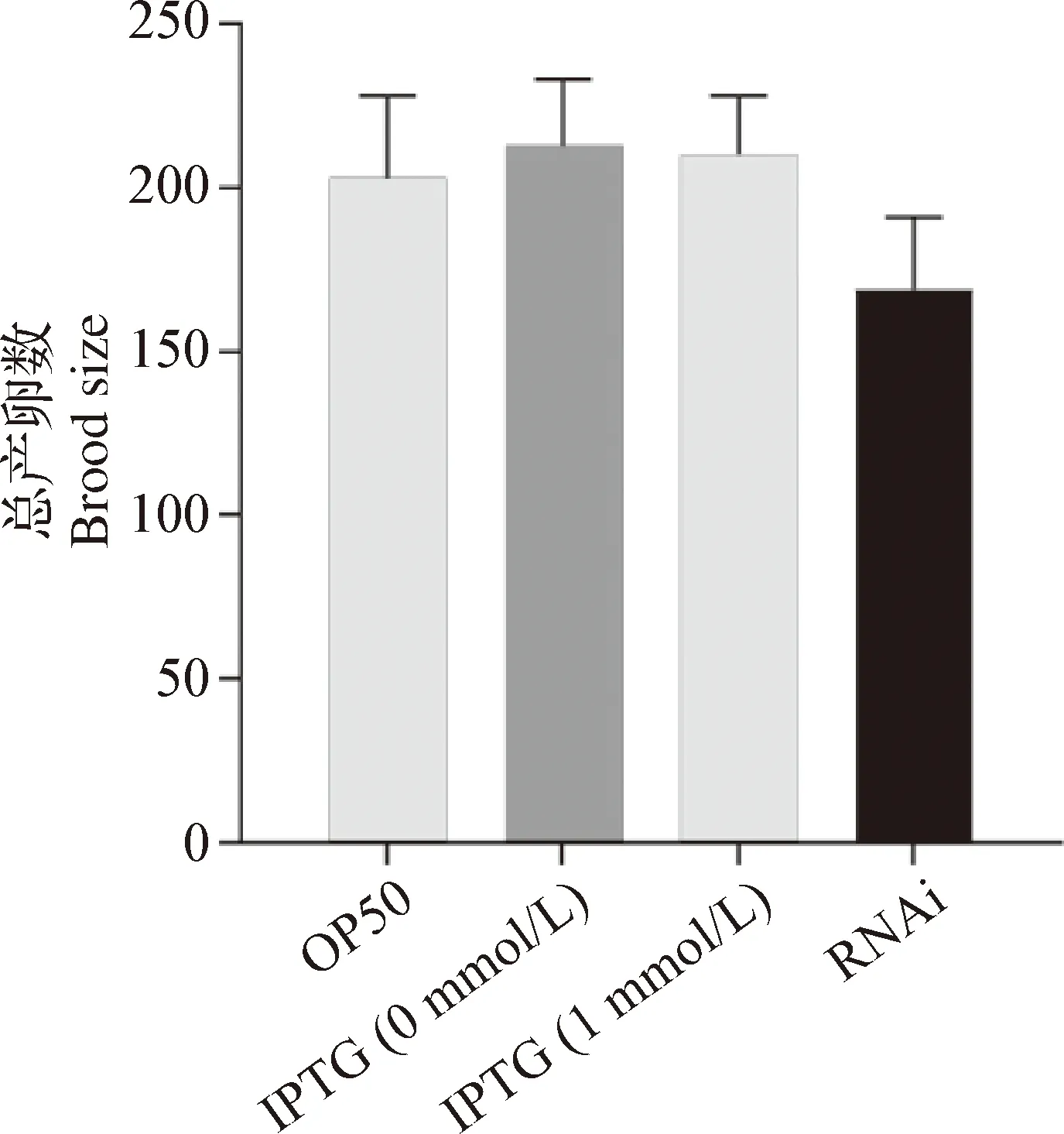
圖2 RNAi沉默anp-1導致C. elegans N2株產卵數變化Fig.2 Knocked down anp-1 gene using RNAi changed the brood size of C. elegans N2 strain
2.3 沉默anp-1基因導致C.elegansN2株體長(Body zise)變化 以不同細菌為食物飼喂同步的C.elegansL1期幼蟲,測定其生長至L4期(或青年成蟲期)的體長(n=50),驗證沉默anp-1基因對C.elegans生長發育的影響。結果顯示:OP50 組體長為(627.2±44.5)μm;IPTG 0 mmol/L組、IPTG 1 mmol/L組和RNAi組體長分別為(653.2±46.8) μm、(667.8±31.6)μm 和(573.7±39.7)μm。ANOVA分析表明,OP50 組L4期幼蟲體長大于RNAi 組,差異極顯著(P<0.001)(圖3)。
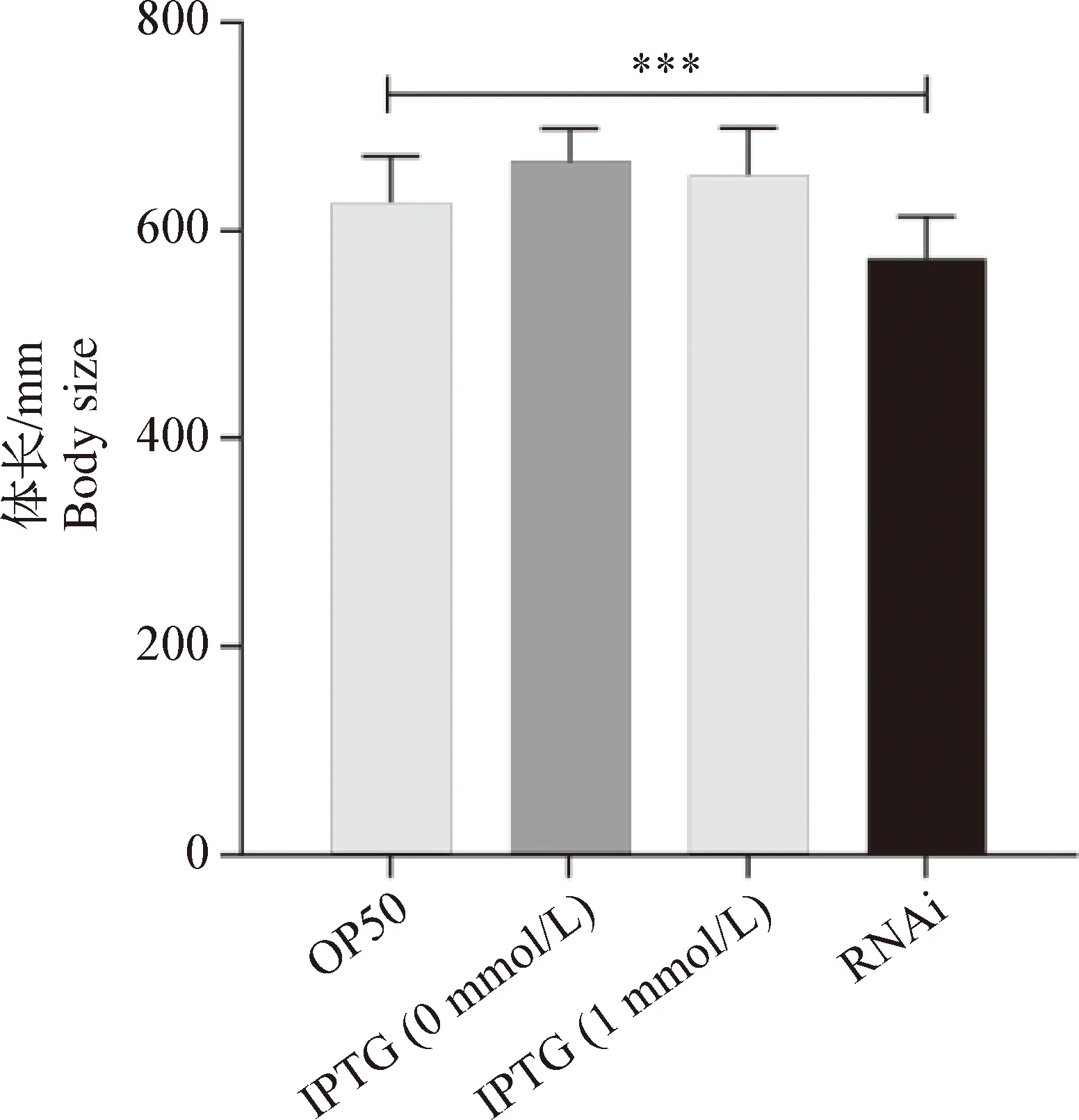
圖3 RNAi沉默anp-1導致C. elegans N2株L4期幼蟲體長變化Fig.3 Knocked down anp-1 gene using RNAi changed the body size of C. elegans N2 strain (L4 larve)
2.4 RNAi沉默anp-1基因導致C.elegansN2株壽命(Lifespan)變化 挑取同步的L1期C.elegans幼蟲50條置于長有不同菌苔的NGM(3 cm,含或不含抗生素和IPTG)平皿上,每天觀察記錄并移走死亡的C.elegans,直到所有C.elegans死亡,統計死亡率并繪制生存曲線。各個組的死亡中位數(Median survival)分別為OP50 組18 d,IPTG 0 mmol/L組20 d,IPTG 1 mmol/L組18 d,RNAi 組 16 d。統計分析結果顯示,與OP50 組相比,RNAi組的死亡中位數時間減少了11%,差異極顯著(P<0.001)(圖4)。
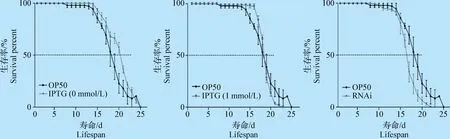
圖4 RNAi沉默anp-1導致C. elegans N2株壽命變化Fig.4 Knocked down anp-1 gene using RNAi changed the lifespan of C. elegans N2 strain
2.5C.elegans壽命調節相關基因表達量變化 沉默anp-1基因導致C.elegans壽命顯著縮短,為探究anp-1基因與壽命調控相關基因之間的調控關系,選取在C.elegans壽命調控中發揮重要作用的相關基因,例如daf-16、daf-2、daf-28、age-1等進行熒光定量PCR試驗。如圖5所示,沉默anp-1基因,daf-2和daf-28基因的相對表達量在RNA干擾組和OP50組無顯著差異(P>0.05);RNAi組age-1基因的相對表達量顯著上調(P<0.05);RNAi組daf-16基因相對表達量顯著下調(P<0.05)。
此外,還選取腸道調控基因以及其他信號通路中可能受到腸道基因調控的基因,驗證沉默anp-1基因后其表達量變化。熒光定量PCR結果表明(見圖5),沉默anp-1基因,ins-1和glp-1基因的相對表達量在RNAi組和OP50組無顯著差異(P>0.05);ins-7基因在RNAi組相對表達量顯著下調(P<0.05);unc-62基因在RNAi組相對表達量顯著上調(P<0.05)。
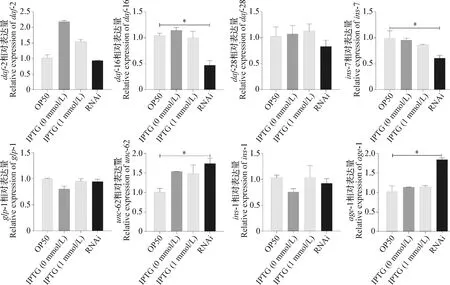
圖5 RNAi 沉默anp-1介導的壽命調節相關基因表達量變化Fig.5 Knocked down anp-1 gene using RNAi changed relative expression of genes regulating longevity*:P<0.05
3 討論
氨肽酶在C.elegans等生物體生長發育中發揮著重要作用[9]。Joshua G W等和 Malagon D等分別報道了氨肽酶在C.elegans和其他線蟲中的生長、食物消化、蛻皮等生理過程中的功能[9-12]。先前的研究多聚焦于C.elegans氨肽酶家族在生殖中的作用。本試驗中,沉默anp-1基因后,C.elegans總產卵數無顯著降低,說明anp-1基因可能不參與C.elegans生殖過程調節,這與前人報道的結果一致[3]。
本試驗體長分析結果表明,沉默anp-1基因導致C.elegansL4期幼蟲體長顯著變短。ANP-1是PAM-1的同源蛋白,PAM-1參與C.elegans腸道細胞對多肽的攝取,有研究表明氨肽酶P(Aminopeptidase P,APP)和 亮氨酸氨肽酶(Leucine aminopeptidase,LAP)也可能與PAM-1有同樣的功能[9,13-15]。因此,推測沉默anp-1基因導致C.elegans消化和吸收障礙,從而造成C.elegans發育緩慢。
C.elegans胰島素/胰島素樣生長因子(Insulin/IGF-1 signaling,IIS)信號通路跟代謝、生長發育、長壽、“dauer”期形成、天然免疫和行為密切相關[16]。IIS信號通路相關基因突變會介導C.elegans壽命變化。age-1是第1個被鑒定出來的IIS信號通路成員,其突變會延長C.elegans壽命[17]。沉默anp-1基因時,age-1基因 mRNA相對表達量明顯上調,表明沉默anp-1基因導致C.elegans壽命縮短有可能是通過激活和上調age-1的表達有關,沉默anp-1基因導致C.elegans壽命縮短的機制需要更深入的研究。
此外,沉默anp-1基因導致C.elegans壽命縮短有可能是通過調控胰島素樣多肽(Insulin-like peptides,ILPs)的表達。ILPs調控C.elegans“dauer”期形成、長壽以及發育。對daf-28、ins-1和ins-7等ILPs的研究已經深入到一定程度,但是其在C.elegans生長發育中的功能仍不明了[16]。unc-62是ILPs其中一員,其主要在C.elegans腸道發揮功能并調節C.elegans壽命,RNAi沉默unc-62導致大量C.elegans腸道基因上調并縮短C.elegans壽命[18]。本試驗中,沉默anp-1基因導致unc-62基因上調,表明anp-1基因有可能受到UNC-62轉錄因子的調控。但目前未見關于氨肽酶與ILPs調控的相關報道,因此,深入研究anp-1與ILPs的相互關系,有助于進一步闡明ILPs參與調節C.elegans壽命的機制,并為揭示氨肽酶基因anp-1在C.elegans生長發育中的生物學功能提供參考。

