吡蟲啉脅迫對意大利蜜蜂哺育蜂免疫解毒相關基因表達及酶活力的影響
候夢賞,程雪芬,邱園妹,朱雅楠,趙必安,李志國,蘇松坤
(福建農林大學動物科學學院蜂學學院,福州,350002)
蜜蜂是重要的授粉性昆蟲,在生態環境、農業生產等方面發揮著重要作用(Pottsetal., 2010)。自2006年末北美爆發蜂群崩潰失調癥(colony collapse disorder, CCD)以來(Cox-Fosteretal., 2007),世界其它地區相繼出現蜂群數量大幅度減少的不正常現象,(Normanetal., 2010)。大量研究顯示,造成這種現象的原因可能包括殺蟲劑濫用、寄生蟲、病毒、細菌等因素(Watsonetal., 2016; Magaletal., 2019)。新煙堿類殺蟲劑是全球使用量最多的品種,除了對靶標昆蟲造成神經性損傷以及死亡外,對全球重要授粉昆蟲——蜜蜂也具有高毒作用,嚴重威脅全球農業環境生物安全(Peggetal., 2014)。
新煙堿類殺蟲劑的作用機制主要是通過與昆蟲神經系統煙堿型乙酰膽堿酯酶競爭受體結合位點,阻斷昆蟲中樞神經系統的正常傳導(Masaru, 2005)。吡蟲啉作為典型的新煙堿類殺蟲劑,具有活性高、廣譜性的特點,能夠導致蜜蜂個體表現出學習能力減弱、壽命縮短、生存活力降低等問題(Armengaudetal., 2004; Carolinaetal., 2015; Zhangetal., 2015; Raymannetal., 2018);在含有100 μg/kg吡蟲啉飼料喂養條件下蜂群群體表現蜂王交替時期過冬能力低下甚至有可能出現盜蜂現象(Ramirez-Romeroetal., 2005);亞致死劑量吡蟲啉能夠降低蜜蜂的嗅覺靈敏性(Tanetal., 2017);影響蜜蜂的定位功能從而弱化歸巢能力(Tosietal., 2017)。
近年來已有關于不同劑量吡蟲啉脅迫對意大利蜜蜂影響的相關研究。在低劑量吡蟲啉脅迫下,激活蜜蜂解毒基因、免疫基因、抗氧化基因表達(Gong and Diao, 2017)。連續5 d飼喂意大利蜜蜂幼蟲含吡蟲啉的蔗糖溶液后,幼蟲體內多酚氧化酶(polyphenol oxidase,PPO)表達量顯著上調(Tesovniketal., 2019);連續飼喂意大利蜜蜂0.02 μg/kg吡蟲啉7 d后,蜂王體內CPY4G11,CYP6AS14表達顯著下調(Chaimaneeetal., 2016)。谷胱甘肽-S-轉移酶(glutathione S-transferase, GSTs)、乙酰膽堿酯酶(acetylchoinesterase, AChE)、細胞色素P450(cytochrome P450)、PPO、羧酸酯酶(carboxylesterase,CE)超氧化物歧化酶(SDS)過氧化氫酶(CAT)是蜜蜂體內重要解毒酶,參與蜜蜂對殺蟲劑解毒過程,在維持蜜蜂健康方面扮演重要角色(Boasetal., 2018)。然而目前關于亞致死劑量吡蟲啉脅迫對意大利蜜蜂哺育蜂影響的研究報道尚少。
本實驗旨在探究在低劑量吡蟲啉脅迫下,意大利蜜蜂哺育蜂免疫解毒相關基因表達情況及免疫解毒酶系活力。探究飼喂含有低劑量吡蟲啉蔗糖溶液,對意大利蜜蜂哺育蜂存活率的影響; 以及飼喂含有低劑量的吡蟲啉蔗糖溶液后,對意大利蜜蜂哺育蜂免疫解毒相關基因PPOA3、ABA、GLD、CYP4506a2、CYB5612-like、UDP-glucuron-osyltransferase的表達量情況;以及飼喂含有低劑量的吡蟲啉蔗糖溶液后,對意大利蜜蜂哺育蜂細胞色素P450酶、多酚氧化酶、超氧化物歧化酶和過氧化氫酶酶活力的影響。為后續進一步探究亞致死劑量吡蟲啉對蜜蜂健康影響的分子機制打下一定基礎。
1 材料與方法
1.1 主要試劑與儀器
吡蟲啉純品(Sigma),丙酮(國藥化學試劑有限公司),PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)試劑盒(TaKaRa),SYBR?Premix Ex TaqTMII (Tli RNaseH Plus)試劑盒(TaKaRa),總蛋白提取試劑盒DE101(北京全式金生物科技有限公司),TaKaRa Bradford Protein Assay Kit(TaKaRa),昆蟲細胞色素P450試劑盒m1036261-J(上海酶聯免疫生物有限公司),昆蟲多酚氧化酶PPO試劑盒m1062744-J(上海酶聯免疫生物有限公司),昆蟲過氧化氫酶CAT試劑盒ml062687(上海酶聯免疫生物有限公司),昆蟲超氧化物岐化酶SOD試劑盒ml036253(上海酶聯免疫生物有限公司),NanoDrop 2000型分光光度計(Thermo Scientific),梯度PCR儀(Applied Biosystems),熒光定量PCR儀(BIORAD公司)。
1.2 蜜蜂
試驗蜜蜂均取自福建農林大學蜂學學院實驗蜂場。從3個蜂群中取3張意蜂子脾,放進限王產卵框中,在恒溫培養箱中培養(溫度34.5℃,相對濕度70%),每天使用熒光標記筆標剛出房意蜂,標記后放入蜂群中進行飼養。
抓取哺育蜂(8日齡),在意蜂飼養盒中飼養,每盒20頭意蜂,抓取6盒意蜂(對照組、處理組各3盒),置于恒溫培養箱中(溫度30℃,相對濕度70%)用于接受低劑量吡蟲啉處理。另抓取8日齡意蜂6盒(每盒20頭),低劑量吡蟲啉處理,記錄意蜂每天死亡數量,用于測定低劑量吡蟲啉對意大利蜜蜂哺育蜂存活率的影響。
1.3 低劑量吡蟲啉處理
吡蟲啉純品0.02 g溶于50 mL丙酮中制成400 ng/μL的吡蟲啉母液,使用50%蔗糖溶液稀釋吡蟲啉母液,處理組意蜂飼喂含有0.1 ng/μL吡蟲啉的50%蔗糖溶液,對照組意蜂飼喂含有等量丙酮的50%蔗糖溶液。每天更換蔗糖溶液并清理死亡意蜂。連續處理3 d和9 d后,液氮凍斃收取樣本,并將樣本放入-80℃冰箱中儲存,用于后續免疫、解毒基因表達及酶活力實驗。
1.4 提取RNA及cDNA的合成
從對照組、處理組每個日齡樣本中各取3頭意蜂,使用TRIZOL法提取意蜂總RNA。使用NanoDrop 2000檢測RNA濃度并稀釋至1 000 ng/μL。配置反轉錄反應體系(20 μL):5×gDNA Eraser Buffer 2 μL;gDNA Eraser 1 μL;總RNA 1 μL;ddH2O 6 μL;42℃反應2 min。然向分別加入:PrimeScript RT Enzyme Mix I 1 μL;RT Primer Mix 1 μL ;5×PrimeScript Buffer 2(for Real Time)4 μL;ddH2O 4 μL;混勻放入PCR儀中37℃,15 min;85℃,5 s;4℃保存。
1.5 熒光定量PCR
在384微孔PCR板上配制如下的反應體系:SYBR Premix Ex Taq II(Tli RNaseH Plus)(2×) 5 μL;PCR上游引物、下游引物(10 μmol/L)各0.4 μL(表1);DNA模板1 μL;滅菌水3.2 μL,共10 μL反應體系。所有操作在冰上進行,每個樣本做3個技術重復。PCR反應條件:95℃ 30 s;95℃ 5 s,60℃ 30 s;40個循環;4℃保存。
1.6 免疫解毒酶系活力的測定
1.6.1總蛋白提取
1 mL冰預冷PBS充分清洗蜜蜂樣本2次,500 g離心5 min,棄上清液;加入1 mL TPEB(Total Protein Extraction Buffer)震蕩勻漿,冰上孵育30 min,每隔10 min震蕩搖勻一次;4℃,14 000 g離心10 min,收集上清液,保存于-80℃冰箱中。
1.6.2蛋白濃度測定
用PBS緩沖液將BSA Standard solution標準品(2 mg/mL)稀釋為1 000、750、500、250、125、25 μg/mL等,取4 μL稀釋后的BSA標準品溶液和檢測樣品溶液加入到96微孔板中;每孔各加入200 μL復溫的Bradford Dye Reagent,混勻后在室溫下反應5 min;把96微孔板放入酶標儀 595 nm波長下檢測,繪制標準曲線,計算樣品蛋白質濃度。
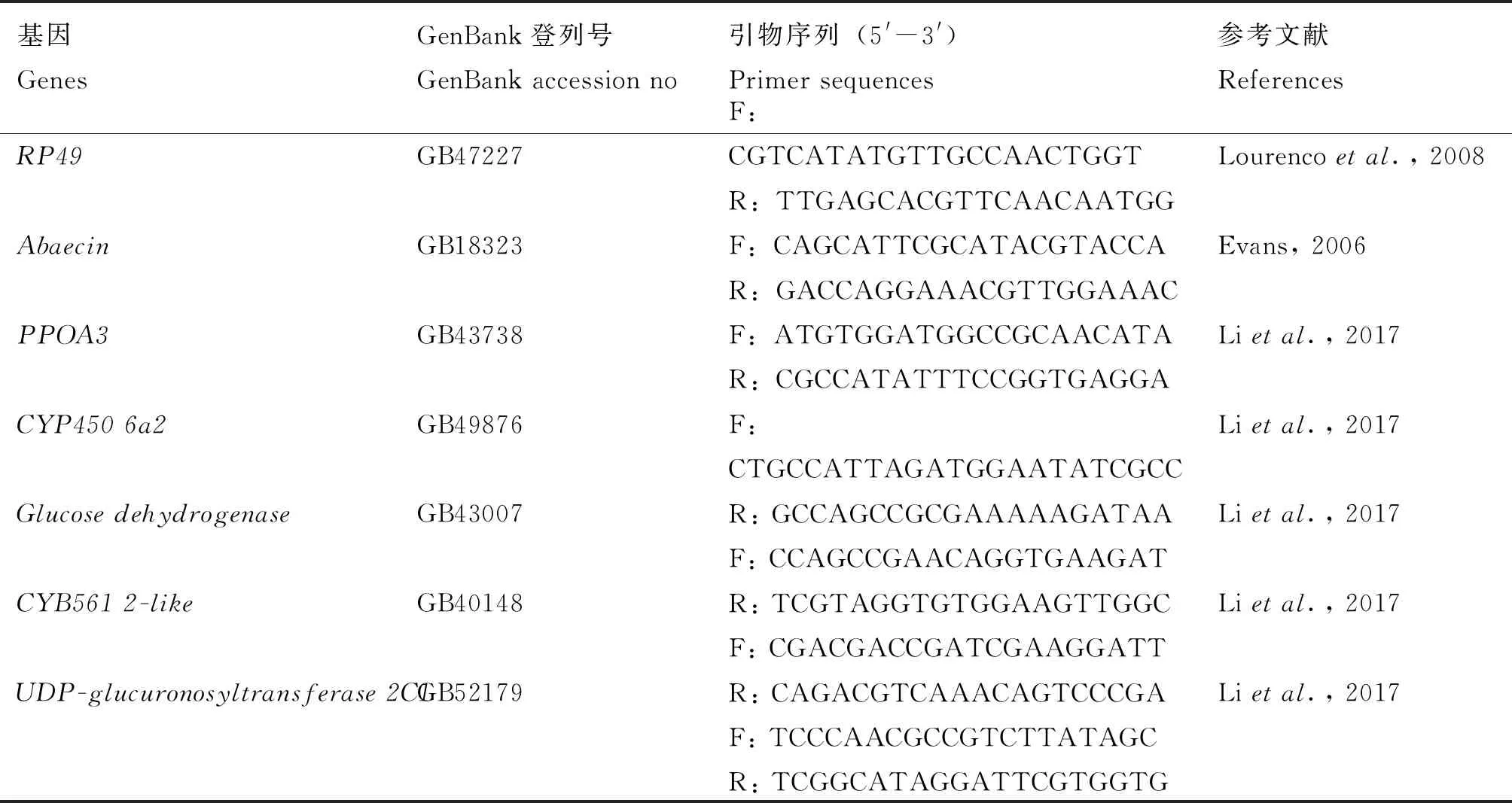
表1 本實驗所用引物對序列信息
1.6.3酶活力測定
采用雙抗體一步夾心法酶聯免疫吸附試驗測定意蜂體內CYP450含量,PPO酶活力,CAT酶活力和SOD酶活力,參考試劑盒方法進行酶活力的測定。
1.7 數據分析
使用Origin 9.0軟件繪制生存函數Kaplan-Meier對實驗結果進行統計分析,構建意蜂的生存曲線圖表。本研究以RP49為內參基因,采用比較CT法計算目的基因的相對定量(目的基因表達量=2-△△Ct),并運用SPSS軟件中獨立樣本T檢驗對各組意蜂的基因相對表達量及酶活力進行差異顯著性分析。
2 結果與分析
2.1 低劑量吡蟲啉對意大利蜜蜂哺育蜂存活的影響
8日齡哺育蜂飼喂含0.1 ng/μL吡蟲啉的蔗糖溶液3 d和9 d后與對照組存活率無顯著差異(P>0.05),表明哺育蜂自由取食3 d和9 d的含0.1 ng/μL吡蟲啉的蔗糖溶液對其沒有造成致死毒性,8日齡工蜂飼喂含0.1 ng/μL吡蟲啉的蔗糖溶液11 d后與對照組存活率有顯著差異(P<0.05),表明長期取食含吡蟲啉的蔗糖溶液會對其造成致死毒性。
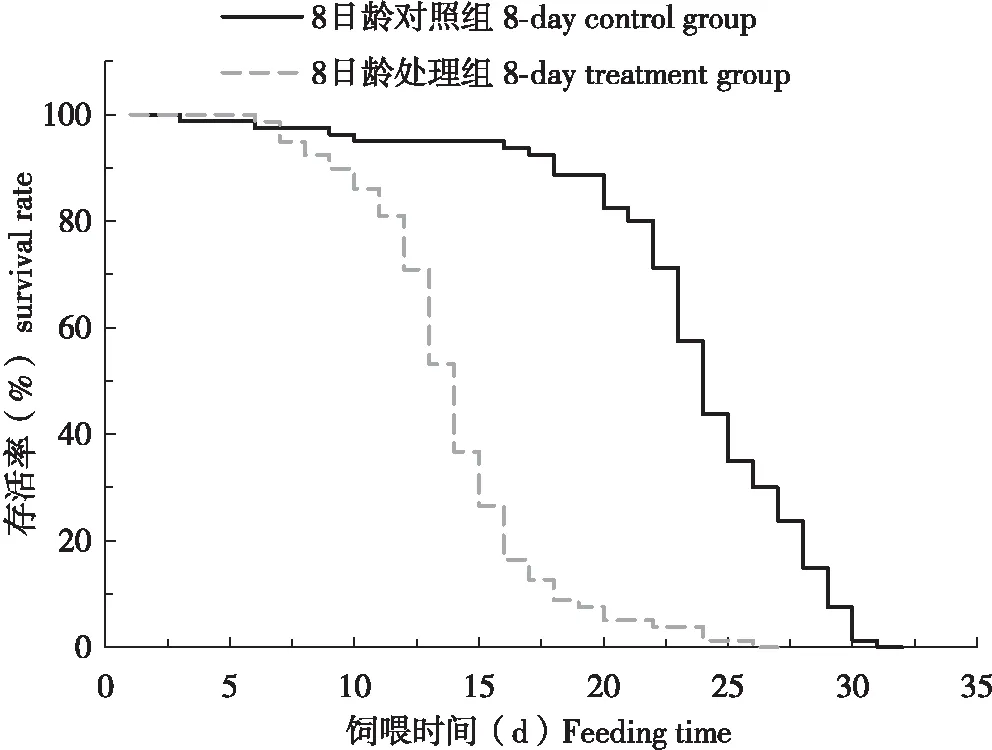
圖1 0.1 ng/μL吡蟲啉處理不同時間后意大利蜜蜂哺育蜂的存活率Fig.1 Survival rate of nurse bees of Apis mellifera ligustica after exposed to 0.1 ng/μL imidacloprid for different time注:8日齡意蜂抓出籠養,處理組飼喂含0.1 ng/μL吡蟲啉的50%蔗糖溶液,對照組飼喂含0.1 ng/μL丙酮的50%蔗糖溶液。圖2和圖3同。Note:The 8 day-old adult bees were caught and raised in cages. In the treatment group, the bees were fed with 50% (w/v) sucrose solution containing 0.1 ng/μL of imidacloprid ad libitum, while in the control group the bees were fed with 50% (w/v) sucrose solution containing 0.1 ng/μL of acetone ad libitum. The same for Fig.2 and Fig.3.
2.2 低劑量吡蟲啉對意大利蜜蜂哺育蜂免疫解毒相關基因表達的影響
8日齡哺育蜂自由取食含0.1 ng/μL吡蟲啉的蔗糖溶液3 d后與對照組相比(圖2),CYB5612-like、UDP-glucuronosyltransferase2C1、CYP4506a2、Abaecin、Glucosedehydrogenase、PPOA3均出現上調趨勢,其中UDP-glucuronosyltransferase2C1、Abaecin與GlucoseDehydrogenase有顯著上調趨勢(P<0.05);8日齡哺育蜂自由取食含0.1 ng/μL吡蟲啉的蔗糖溶液9 d后與對照組相比CYB5612-
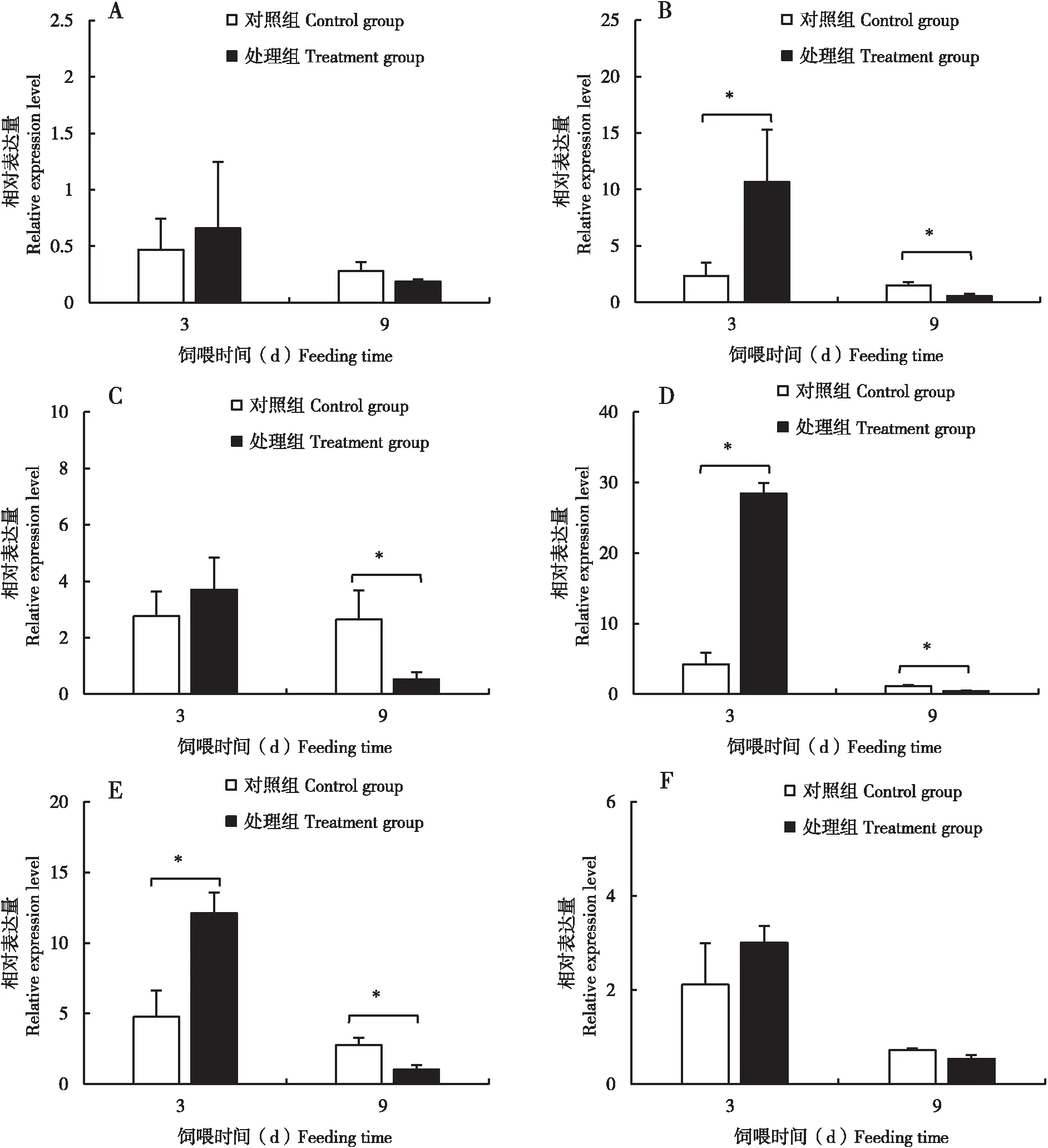
圖2 0.1 ng/μL吡蟲啉處理3 d與9 d后意大利蜜蜂哺育蜂免疫解毒相關基因的表達Fig.2 Relative expression levels ofimmune and detoxification related genes in nurse bees of Apis mellifera ligustica exposed to 0.1 ng/μL imidacloprid for 3 d and 9 d注:A,CYB561 2-like;B,UDP-glucuronosyltransferase 2C1;C,CYP450 6a2;D,Abaecin;E,Glucose dehydrogenase;F,PPOA3. 圖中數據為平均數±標準誤差(n=3),圖形柱上星號表示兩組間差異顯著(P<0.05, T檢驗)。圖3同。Note:Data in the figure are mean±SE(n=3). The single asterisk indicate significant difference (P<0.05) between the two groups by T-test. The same for Fig.3.
like、UDP-glucuronosyltransferase2C1、CYP4506a2、Abaecin、Glucosedehydrogenase、PPOA3均出現下調趨勢,其中UDP-glucuronosyltransferase2C1、CYP4506a2、Abaecin與GlucoseDehydrogenase有顯著上調趨勢(P<0.05)。
2.3 低劑量吡蟲啉對意大利蜜蜂哺育蜂免疫解毒酶系活力的影響
8日齡哺育蜂自由取食含0.1 ng/μL吡蟲啉的蔗糖溶液3 d后與對照組相比(圖3),CYP450含量出現上調趨勢,CAT酶與SOD酶活力均有顯著下調趨勢(P<0.05);8日齡哺育蜂自由取食含0.1 ng/μL吡蟲啉的蔗糖溶液9 d后與對照組相比,CYP450含量,PPO,CAT與SOD酶活力均有顯著下調趨勢(P<0.05)。
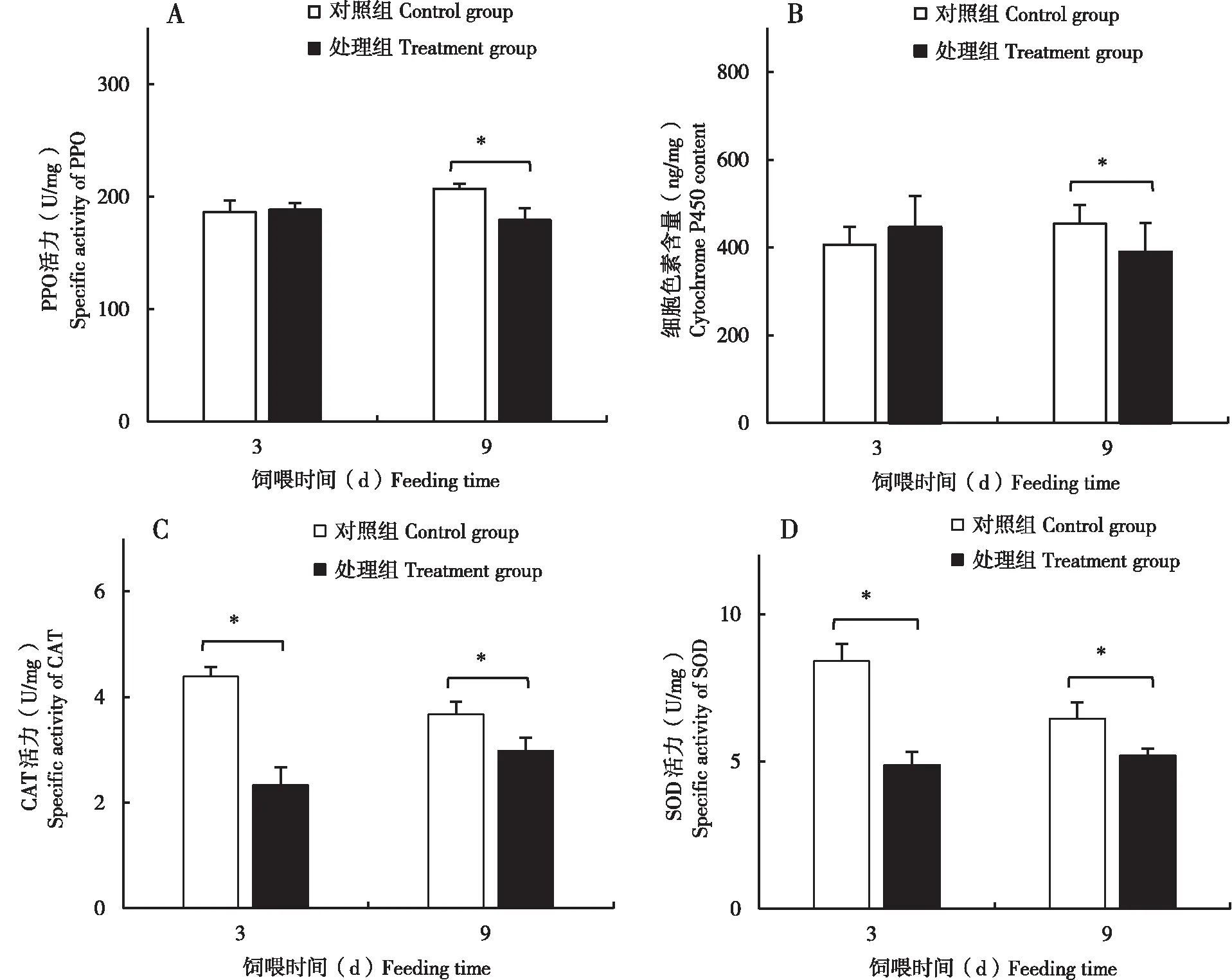
圖3 0.1 ng/μL吡蟲啉處理3 d與9 d后意大利蜜蜂哺育蜂免疫解毒酶系活力Fig.3 Specific activity of immune and detoxification in nurse bees of Apis mellifera ligustica exposed to 0.1 ng/μL imidacloprid for 3 d and 9 d 注:A,PPO;B,CYP450;C,CAT;D,SOD.
3 結論與討論
隨著殺蟲劑的廣泛使用,其對蜜蜂影響的相關研究也逐步增多,殺蟲劑不僅影響采集蜂的健康,蜜蜂采集歸巢后,殺蟲劑還會影響幼蟲、內勤蜂、蜂王的健康(Chaimaneeetal., 2016; Gong and Diao, 2017; Tesovniketal., 2019),哺育蜂在蜂群中扮演重要角色,承擔著哺育幼蟲、飼喂蜂王的重任,哺育蜂的質量關系到蜂群的群勢與健康(Winston, 1991)。本實驗主要探究低劑量吡蟲啉脅迫對意大利蜜蜂哺育蜂的影響,實驗條件下0.1 ng/μL吡蟲啉連續飼喂8日齡意蜂3 d與9 d對意蜂的存活率沒有顯著影響,連續飼喂11 d對意蜂的存活率有顯著影響,與候夢賞(2019)關于吡蟲啉對內勤蜂的研究結果相似。本實驗進一步說明在實驗室條件下,亞致死劑量吡蟲啉短期脅迫對意蜂哺育蜂的存活沒有顯著影響,長期脅迫對意蜂哺育蜂的存活有顯著影響。
與哺乳動物不同,昆蟲只存在先天免疫,包括體液免疫和細胞免疫。二者在昆蟲免疫系統中扮演重要角色,昆蟲主要依賴這兩類免疫體系抵御外源性致病因子(Kleinoetal., 2014)。蜜蜂通過基因表達、蛋白酶反應,共同參與對農藥等外源性物質的代謝(Mohamedetal., 2015;Cizeljetal., 2016)。CYB561 2-like是細胞色素b561家族基因中一員,其主要功能是參與細胞防御機制及應答環境化學物質的刺激(Zamanianetal., 2012)。UDP-glucuronosyltransferase2C1編碼的酶在催化過程中,大大提高受體分子的水溶性,促進葡萄糖醛酸從體內的外排,參與體內免疫機制。(Goonetal., 1992),CYP450基因家族在昆蟲生長、發育及防御過程中發揮重要作用(Dereckaetal., 2013),Abaecin在脅迫狀態下能夠編碼特定抗菌肽,是體液免疫基因家族中重要組成部分。(Evansetal., 2006);Glucosedehydrogenase能夠編碼葡萄糖脫氫酶,該酶能夠殺死病原菌,參與蜜蜂細胞免疫過程(Cox-Foster and Stehr, 1994)。PPOA3通過轉錄翻譯多酚氧化酶,在蜜蜂生長過程中扮演重要角色(Tesovniketal., 2019);本實驗結果顯示0.1 ng/μL吡蟲啉飼喂意蜂9 d后UDP-glucuronosyltransferase2C1,CYP4506a2,Abaecin,Glucosedorydrogenase表達量均具有顯著下調,這與Tesovnik等(2019)人的研究具有類似的結果。從基因水平揭示亞致死劑量吡蟲啉脅迫下,可以引起蜜蜂的解毒代謝機制,長期的接觸則會負面影響意蜂的免疫解毒功能,進而影響意蜂的生存健康。此外,吡蟲啉與其它生物性致病因子協同作用,加劇對蜜蜂的危害。亞致死劑量吡蟲啉脅迫下,意蜂體內微孢子蟲感染量顯著增加,蜜蜂健康水平下降更顯著(Judyetal., 2012)。亞致死劑量吡蟲啉脅迫后,瓦螨對蜜蜂健康造成更大的危害,說明在吡蟲啉脅迫下蜜蜂免疫機制受到損害,進而影響意蜂的抗螨能力(Tesovniketal., 2019)。
細胞色素P450酶系、多酚氧化酶、超氧化物歧化酶(SOD)和過氧化氫酶(CAT)是蜜蜂體內重要的解毒酶系,在抵抗殺蟲劑的脅迫中發揮著重要功能。多酚氧化酶參與調節昆蟲各種生理活動,包括變態發育、免疫機制等。(Andersen, 2010),細胞色素P450酶系參與蜜蜂外源解毒,在昆蟲生長、發育及防御過程中發揮重要作用(Igaand Kataoka, 2012)。超氧化物歧化酶、過氧化氫酶二者功能是清除昆蟲體內過剩的活性氧,保護機體免遭環境脅迫的危害(Mccord and Fridovich, 1969; Bolter and Chefurka, 1990),Li等(2017)使用亞致死劑量吡蟲啉處理意蜂,在48 h內檢測解毒酶系活力的變化,而本實驗將檢測時間延長到9 d,并且與對照組相比以上4種酶活性均顯著下調,進一步說明亞致死劑量吡蟲啉脅迫下抑制意蜂解毒酶系活力,導致蜜蜂對吡蟲啉的代謝能力下降,大量的吡蟲啉蓄積在體內可能會影響蜜蜂的健康和行為表現。蜜蜂在吡蟲啉脅迫下出現嗅覺學習障礙,同時研究發現蜜蜂腦部細胞出現相應程度的細胞凋亡和自噬現象,對蜜蜂食欲行為的不同方面都有不良影響,以及對食物分配、嗅覺信息傳播和巢內任務協調都有影響。(吳艷艷等, 2014; Lietal., 2019; Carolina Mengoni Goalons and Farina, 2019)
綜上,本研究通過存活率、免疫解毒相關基因表達和免疫解毒酶系活力3個層面探索低劑量吡蟲啉對意大利蜜蜂哺育蜂的影響。結果表明低劑量吡蟲啉脅迫影響意蜂哺育蜂免疫解毒相關基因的表達及免疫解毒酶系活力,長期脅迫影響意蜂生存。亞致死劑量吡蟲啉對意大利蜜蜂行為、代謝和生理影響仍需在自然條件下做進一步研究。

