晚期糖基化終產物在老年心房顫動患者血清中的表達及意義
李 瑩,紀玉強,蔡 琴,李晨輝
(西安市第一醫院心內科,陜西 西安 710002)
晚糖基化終產物(Advanced glycation end products, AGEs)是蛋白質、脂質、核酸在非酶糖基化反應下,自發地與葡萄糖及其他還原糖反應產生穩定的具有活性的一類聚合物。AGEs有多種受體,其中晚期糖基化終產物受體(Receptor for advanced glycation endproducts, RAGE)是AGEs最具特征性、且是目前研究最廣泛、最深入的AGEs受體。AGEs與RAGE結合后誘導產生多種損傷因子如白介素-1a(Interleukin- 1a, IL-1a)、核轉錄因子NF-κB、白介素-6(Interleukin-6,IL-6)、腫瘤壞死因子-a(Tumor necrosis factor-α, TNF-α)等,誘導炎性反應和氧化應激,產生致病效應[1]。體內AGEs有多種不同的形式,目前已知的有羧甲基賴氨酸(Carboxymethyllsine,CML)、羧乙基賴氨酸、交聯素等。羧甲基賴氨酸是目前研究最多且易于檢測的一種晚期糖基化終產物。有研究發現,AGEs與RAGE結合后,增加心肌細胞的凋亡進而損傷心肌細胞[2]。心房顫動在老年人群中是非常常見的一種心律失常,且在老年人群中患病率明顯增高。心房顫動可引起腦栓塞、心力衰竭等并發癥嚴重威脅老年人生活質量。AGEs隨著年齡的增長會慢慢增多。有研究發現,心房顫動患者血清AGEs水平升高[3-4]。而有關老年心房顫動與晚期糖基化終產物的研究較少,本研究旨在通過檢測老年心房顫動患者血清CML水平及TNF-α、超氧化物歧化酶(Superoxide dismutase,SOD)水平變化,探討其相關臨床意義。
1 資料與方法
1.1 一般資料 選擇2017年6月至2018年1月在我院心血管內科住院的老年持續性心房顫動患者50例(年齡≥65歲),其中男26例,女24例,年齡69~89歲,平均(79.91±5.55)歲。對照組為同期住院的年齡≥65歲非心房顫動患者30例,其中男12例,女18例。年齡66~89歲,平均(79.80±4.775)歲。持續性心房顫動診斷按照 2016 年《歐洲心房顫動管理及治療指南》中關于持續性房顫的相關診斷標準。排除標準:糖尿病、其他嚴重心律失常、惡性腫瘤、合并感染病史、慢性炎癥疾病、嚴重肝腎功能不全、自身免疫性疾病、甲狀腺功能異常者。兩組患者在性別、吸煙、飲酒、冠心病史、高血壓病史、體重指數(Body mass index,BMI)方面比較,差異無統計學意義(P>0.05),具有可比性。
1.2 研究方法 所有研究對象均需采集詳細病史,行體格檢查及進行血液生化檢驗查血常規、電解質、肝腎功、血脂、血糖、心肌酶、高敏肌鈣蛋白T、甲狀腺功能、血漿超敏C反應蛋白(High-sensitivity C-reactive protein,hs-CRP)、氨基末端腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP)等,并行心臟超聲檢查。研究對象晨時空腹12 h,從肘前靜脈抽取肘靜脈血。分裝放入2 ml的離心管中靜置待血液凝固后,再轉移到離心機中以3500 r/min離心15 min。取上血清液置于-80 ℃冰箱中冷凍保存待用。用 ELISA 法檢測血清 CML、SOD、TNF-αCML、試劑盒為上海酶聯生物科技有限公司產品,SOD試劑盒和TNF-α試劑盒均為武漢伊萊瑞特生物科技股份有限公司產品,具體操作方法參照 ELISA試劑盒說明檢測)。

2 結 果
2.1 兩組患者血清CML、TNF-α、SOD濃度比較 老年心房顫動組血清CML、TNF-α濃度均高于對照組,兩組比較差異有統計學意義(P<0.05),老年心房顫動組血清SOD濃度低于對照組,兩組比較差異有統計學意義(P<0.05)。見表1。
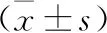
表1 兩組患者血清CML、TNF-α、SOD濃度比較
2.2 兩組患者心功能檢測指標比較 老年心房顫動組左心房內徑、左心室射血分數(LVEF)較對照組明顯升高,差異有統計學意義(P<0.05)。見表2。
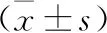
表2 兩組患者心功能檢測指標比較
2.3 老年心房顫動組血清CML水平與左心房內徑及LVEF相關性分析 CML與左心房內徑之間未通過顯著性檢驗,兩者之間無明顯相關性。CML與LVEF之間未通過顯著性檢驗,兩者之間無明顯相關性。見表3。

表3 老年心房顫動組血清CML水平與左心房內徑 及LVEF相關性分析
3 討 論
心房顫動是臨床上較為常見的一種心律失常。心房顫動隨著年齡的增長患病率增加,65歲以上人群其患病率約5%,80歲以上人群,房顫的患病率可達10%[5]我國已經進入深度老齡化社會,老年心房顫動患者逐年增多。眾所周知,心房顫動可引起嚴重的并發癥,如腦栓塞、心力衰竭和其他惡性心律失常等,使住院率、致殘率和病死率增加,使患者的生活質量明顯下降。尤其在老年人群中更為嚴重,嚴重威脅老年人健康及加重社會負擔。所以心房顫動一直為心臟學領域的研究熱點和難點。如何防治老年心房顫動成為我們有待攻克的一項重要課題。
研究表明,房顫發生和持續的核心環節是心房電重構和結構重構,電重構和結構重構相互影響,共同構成房顫的電生理-解剖學基礎。越來越多的證據表明氧化應激可能導致心房重塑和心電重構,這在房顫的發生機制中有重要作用[6]。且近年眾多研究發現炎癥反應及氧化應激對于房顫的產生和維持起著重要的作用[7]。TNF-α、腦鈉肽等炎性因子參與了心房顫動的發病機制。亦有研究發現,高水平的炎性因子可能參與了心臟結構重構,以維持房顫發生[8-9]。AGEs與其受體RAGE結合后,可激活多種細胞信號轉導途徑如激活p21和p38MAPK等轉導徑路,誘導產生多種損傷因子如核轉錄因子NF-κB、IL-1a、IL-6、TNF-α等,誘導炎性反應和氧化應激,產生致病效應[1]。那么,AGEs是否也可導致心房重塑和心電重構誘導房顫的發生呢?以及AGEs是否在心房顫動的發作及維持中扮演重要的作用呢?有關實驗研究顯示,AGEs可與其受體RAGE作用誘導心肌成纖維細胞的老化,能刺激心肌成纖維細胞增殖[10]。AGEs主要是通過與細胞表面的RAGE相結合,激活胞內信號通路進而引發心肌老化[10]。而心肌老化主要表現為心肌纖維化[11]。且有研究發現,心房顫動患者血清AGEs水平升高[3-4]。而且有研究顯示血清AGEs水平與左心房直徑呈正相關[12]。
AGEs隨著年齡的增長會慢慢增多[1]。機體組織中過多的AGEs與受體結合后可改變蛋白質、脂類、核酸的結構,改變其功能,造成細胞、組織的損傷。有實驗證實,伴隨老年個體內AGEs物質增多,氧化應激產物也隨之增多,且應激激素和炎性反應物質亦增多[13]。而內源性的抗氧化應激系統在維持正常心肌細胞的功能中有重要作用[14-15]。有研究顯示,AGEs能降低SOD的活性,促進氧化應激,損傷細胞及組織。氧化應激狀態下AGEs合成增多,而AGEs與受體RAGE結合后又進一步促進炎癥反應和氧化應激過程,這樣形成了一個惡性循環過程,加重了對細胞和組織損傷。
基于以上理論及相關研究結果,均為我們研究AGEs與老年心房顫動提供了重要依據及線索。我們考慮是否老年心房顫動患者體內存在高AGEs水平,且高AGEs通過誘導炎性反應和氧化應激,促使房顫的發生。本實驗通過檢測老年心房顫動患者血清CML水平,發現老年心房顫動患者血清CML水平較對照組明顯升高,且兩組間具有統計學差異。且檢測老年心房顫動組炎性指標TNF-α水平亦均較對照組升高,且兩組間具有統計學差異。SOD是維持體內氧化系統平衡的抗氧化酶,SOD高低可間接反映機體清除氧自由基的能力[17]。為了探明AGEs與心房顫動與細胞內氧化應激有關,本實驗通過檢測SOD 水平,以反應細胞氧化應激水平。結果顯示對照組中SOD水平明顯低于對照組,且兩組間有統計學差異,提示老年心房顫動組氧化應激水平較對照強,可能與AGEs增多,通過AGEs-RAGE-氧化應激導致心肌細胞損傷有關。通過超聲檢查,老年房顫組左心房內徑較對照組增大,且LVEF較對照組減低,兩組結果均有統計學差異。
綜上所述,分析AGEs可能通過炎癥及氧化應激引起心房電重構和結構重構,參與房顫的發生及維持,具體機制與離子通道有待進一步研究及分析。本實驗發現左心房直徑隨著血清CML水平升高而升高,但兩者之間相關性不明顯,分析可能房顫患者左心房直徑增大受多種因素及相關疾病影響有關,有待我們進一步研究及分析。

