長鏈非編碼RNA SNHG15通過miR-141-3p /KLF9機制調控鼻咽癌細胞增殖的實驗研究
易亭伍,梁 睿,宿向東
(1.四川省樂山市人民醫院腫瘤血液科,四川 樂山 614000;2.四川大學華西臨床醫學院,四川 成都 610041)
鼻咽癌是我國最常見的頭頸部惡性腫瘤之一[1]。同步放化療明顯改善了鼻咽癌患者的局部控制率及生存[2]。但晚期或局部晚期鼻咽癌在經過標準治療后仍常出現復發及遠處轉移。所以,研究鼻咽癌增殖轉移的分子機制,為治療鼻咽癌尋找新的藥物靶點尤為重要。長鏈非編碼RNA(Long non-coding RNA,lncRNA)在惡性腫瘤的發生與發展中起到重要的調控作用[3]。lncRNA主要通過調控相關的microRNA(miRNA)來影響下游基因的表達,從而影響腫瘤細胞的增殖及分化。長鏈非編碼核仁小RNA宿主基因15(Small nucleolar RNA host gene 15,SNHG15)在肝細胞肝癌[4]、結腸癌[5]等多種惡性腫瘤中扮演著促癌的作用,但其在鼻咽癌中的表達及生物學功能尚無相關報道。本研究探究SNHG15在鼻咽癌中的表達,并分析其下游miRNA調控通路,希望為研究鼻咽癌分子生物學行為及潛在治療靶點提供參考。
1 材料與方法
1.1 研究材料 本研究共收錄50例鼻咽癌標本及28例正常組織。所有組織均由四川大學華西醫院的病理科診斷。正常鼻咽上皮組織取自非鄰近腫瘤組織。所有受試者已簽署知情同意書。人鼻咽上皮細胞系NP69和4種鼻咽癌細胞系,CNE1、CNE2、SUNE1、HONE1均購自美國模式培養物集存庫(ATCC)。所有細胞均培養在含10%胎牛血清(FBS)和1%青霉素/鏈霉素的RPMI-1640培養基中,細胞置于5% CO2、37 ℃細胞培養箱中培養。
1.2 研究方法
1.2.1 細胞轉染:將CNE1和SUNE1細胞培養在6孔板中達到60%~70%的密度。將si-SNHG15(上海Genepharma公司,C-01-1804121)、陰性對照序列(NC)分別由轉染試劑Lipofectamine 2000轉染入細胞。
1.2.2 RNA提取與實時定量PCR:總RNA由Trizol試劑按照制造商說明書進行分離。實時定量PCR采用SYBR green real-time PCR試劑盒(上海Genepharma公司,QPG-043)進行分析。所有結果均采用2-ΔΔCt計算。GAPDH和U6被用于內參對結果進行標準化。引物序列如下:①SNHG15上游引物正向:5’-GCTGAGGTGACGGTCTCAAA-3’;下游引物反向:5’-GCCTCCCAGTTTCATGGACA-3’。②miR-141-3p上游引物正向:5’-CCTCGTCTTGAGCTGAGAGC-3’;下游引物反向:5’-AGGGCTCCCTGAAGGTTACT-3’。③Krüppel樣因子9(Krüppel-like factor 9,KLF9)上游引物正向:5’-GCCGCCTACATGGACTTCG-3’;下游引物反向:5’-GGATGGGTCGGTACTTGTTCA-3’。④U6上游引物正向:5’-GCTGAGGTGACGGTCTCAAA-3’;下游引物反向:5’-GCCTCCCAGTTTCATGGACA-3’ 。⑤GAPDH上游引物正向:5’-CGGAGTCAACGGATTTGGTCGTAT-3’;下游引物反向:5’- AGCCTTCTCCATGGTGGTGAAGAC-3’。
1.2.3 CCK8實驗:將細胞接種于96孔板中,在指定時間點將10 μl CCK-8試劑添加到每個孔中,通過MRXII微孔板讀數儀測定450 nm處的吸光度。
1.2.4 克隆形成實驗:將SUNE1和CNE1細胞用6孔板培養2周后,用FBS緩沖液沖洗細胞3次。用4%多聚甲醛將細胞固定,0.05%結晶紫在室溫下染色15 min,記錄細胞數大于50個的細胞克隆。
1.2.5 細胞凋亡實驗:收集經SNHG15 siRNA和對應的陰性參照轉染的CNE1或SUNE1細胞,碘化丙啶(PI)染色后在流式細胞儀上進行檢測。
1.2.6 核質分離實驗:將藥物處理后的細胞用PBS(4 ℃)洗滌2 遍,棄去PBS 后加入細胞質裂解液(RLA),冰上孵育20 min,3000 r/min 離心15 min,所得上清液為胞質蛋白。用RLA 洗滌沉淀,反復3 次后加入核裂解液(RIPA),冰上孵育20 min,每隔5 min 渦旋振蕩30 s,12500 r/min 離心15 min,上清液為核蛋白。
1.2.7 雙熒光素酶檢測:利用生物信息學網站預測miR-141-3p和SNHG15或KLF9的結合位點。含有miR-141-3p結合位點的SNHG15或KLF9的熒光素酶質粒均由上海GenePharma合成(E-S-1-190121)。腫瘤細胞分別轉染野生型/突變型SNHG15或KLF9質粒、miR-141-3p模擬物(mimics)/陰性對照(NC)質粒后,通過標準化方法測質粒轉染后相對熒光度值。
1.2.8 Western blot檢測:取上述轉染的細胞,用緩沖液NP-4裂解。用配制好的SDS-PAGE分離蛋白,轉移到PVDF膜上。用5% BSA將濾過膜封閉,然后將膜對應的一抗在4 ℃下孵育1 h,接著將膜與辣根過氧化物酶結合的二抗在室溫下孵育1 h。使用ECL類試劑檢測蛋白。
1.3 統計學方法 數據采用SPSS 16.0和GraphPad Prism 5.0 統計學軟件進行分析。生存分析采用Kaplan-Meier方法,以P<0.05為差異具有統計學意義。lncRNA與miRNA潛在關聯通過Starbase進行分析。
2 結 果
2.1 SNHG15在鼻咽癌組織及鼻咽癌細胞中高表達 見圖1。與正常組織相比,SNHG15在鼻咽癌組織中的表達顯著增高(P<0.001)。Ⅲ-Ⅳ期鼻咽癌患者腫瘤組織中的SNHG15的相對表達量高于低分期組(P<0.01)。此外,Kaplan-Meier分析結果顯示,高表達的SNHG15預示著鼻咽癌患者的不良預后。與人正常鼻咽上皮細胞系NP69相比,SNHG15在4種鼻咽癌細胞系中的表達也顯著增高(P<0.01)。
2.2 低表達SNHG15抑制鼻咽癌細胞增殖 見圖2。我們選擇SUNE1和CNE1細胞進行體外細胞實驗。通過在SUNE1和CNE1細胞中轉染SNHG15 siRNA敲低細胞中SNHG15的表達,并通過qRT-PCR驗證轉染效率,結果顯示,與陰性對照組相比表達水平均明顯下降(P<0.01)。CCK8實驗及克隆形成實驗結果顯示,抑制SNHG15表達能夠顯著抑制SUNE1和CNE1細胞增殖能力及克隆形成能力(P<0.05)。與陰性對照組相比,轉染了SNHG15 siRNA的SUNE1和CNE1細胞凋亡比例明顯增高(P<0.01)。2.3 SNHG15吸附并促進miR-141-3p表達 見圖3。核質分離實驗結果顯示,SNHG15大多數分布于SUNE1和CNE1細胞的胞質中。我們通過starbase分析預測發現,miR-141-3p與SNHG15具有可能的結合位點,并設計構建了SNHG15野生型過表達質粒(SNHG15-WT)及SNHG15突變型過表達質粒(SNHG15-MUT)。通過雙熒光素酶實驗發現,miR-141-3p mimics有效降低了SNHG15 WT組的熒光素酶活性,而SNHG15 MUT組則未見明顯的改變。qRT-PCR檢測結果發現,miR-141-3p在鼻咽癌組織的表達明顯低于鼻咽正常組織,并且鼻咽癌組織中SNHG15的相對表達量與miR-141-3p的表達呈負相關關系。在SUNE1和CNE1轉染si-NC及si-SNHG15后通過qRT-PCR檢測miR-141-3p的表達情況,結果顯示si-SNHG15能夠顯著促進鼻咽癌細胞中miR-141-3p的表達。
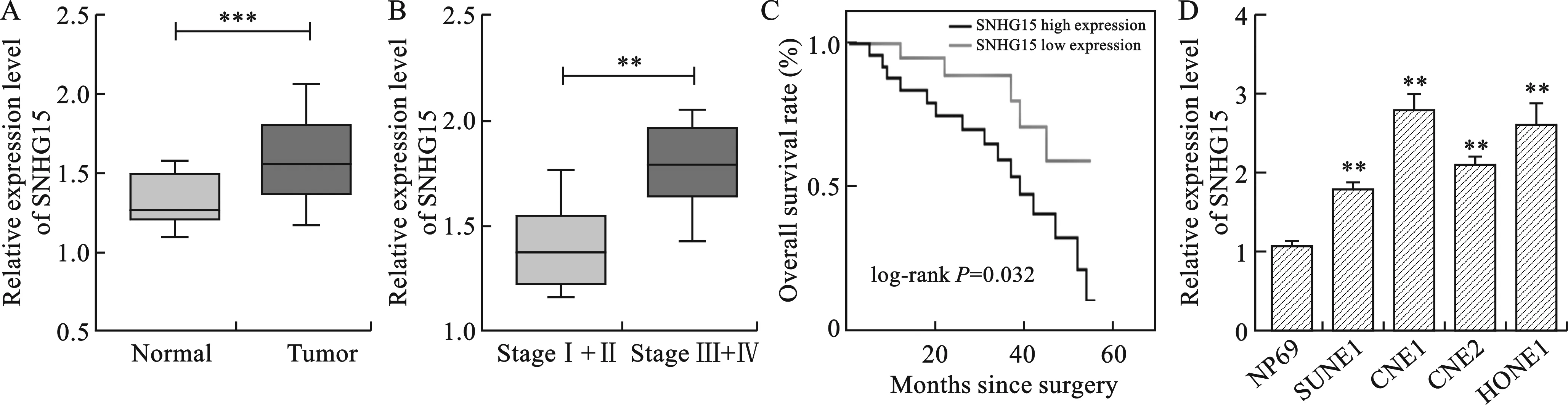
注:A圖中,與正常組織相比,***P<0.001;B圖中,與Ⅰ-Ⅱ期鼻咽癌患者相比,**P<0.01;D圖中,與NP69相比,**P<0.01
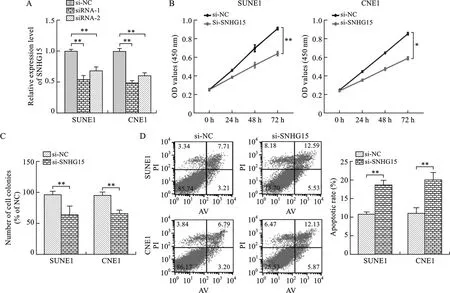
注:A、C、D圖中,與陰性對照組相比,**P<0.01;B圖中,與陰性對照組相比,*P<0.05,**P<0.01
2.4 miR-141-3p靶向抑制KLF9 見圖4。我們通過Target Scan預測了miR-141-3p可能結合的結合分數較高的基因,通過功能分析選擇了KLF9進行后續研究。雙熒光素酶報告基因實驗發現,miR-141-3p能夠靶向結合KLF9。qRT-PCR檢測發現,KLF9在鼻咽癌組織中的表達明顯增高。在SUNE1和CNE1轉染miR-141-3p NC及miR-141-3p mimics后通過qRT-PCR及Western blot實驗檢測KLF9的表達情況,結果顯示與陰性對照組相比,在鼻咽癌細胞中過表達miR-141-3p能夠顯著抑制KLF9 mRNA及蛋白的表達。
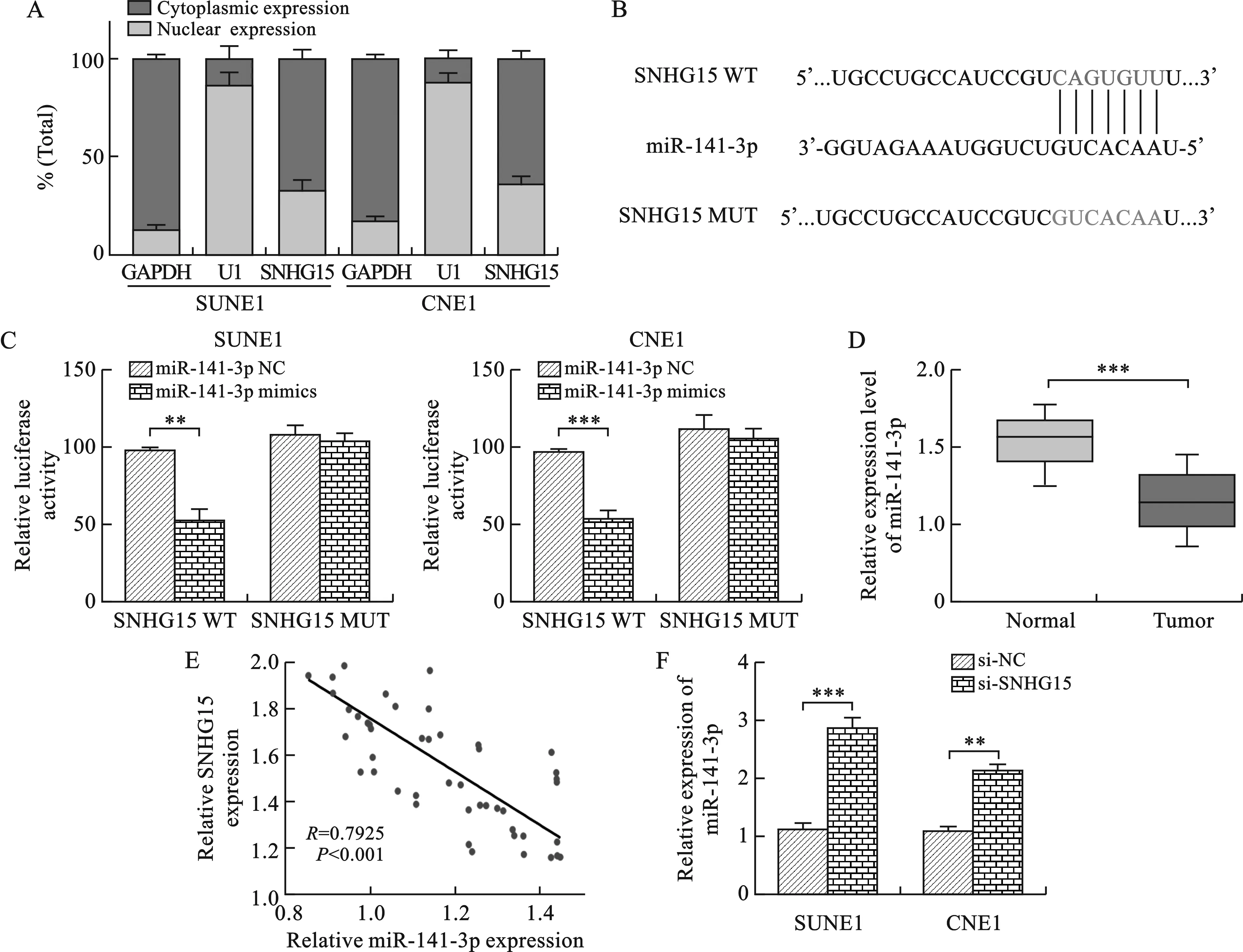
注:C圖中,與陰性對照組相比,**P<0.01,***P<0.001;D圖中,與正常組織相比,***P<0.001;F圖中,與陰性對照組相比,**P<0.01,***P<0.001
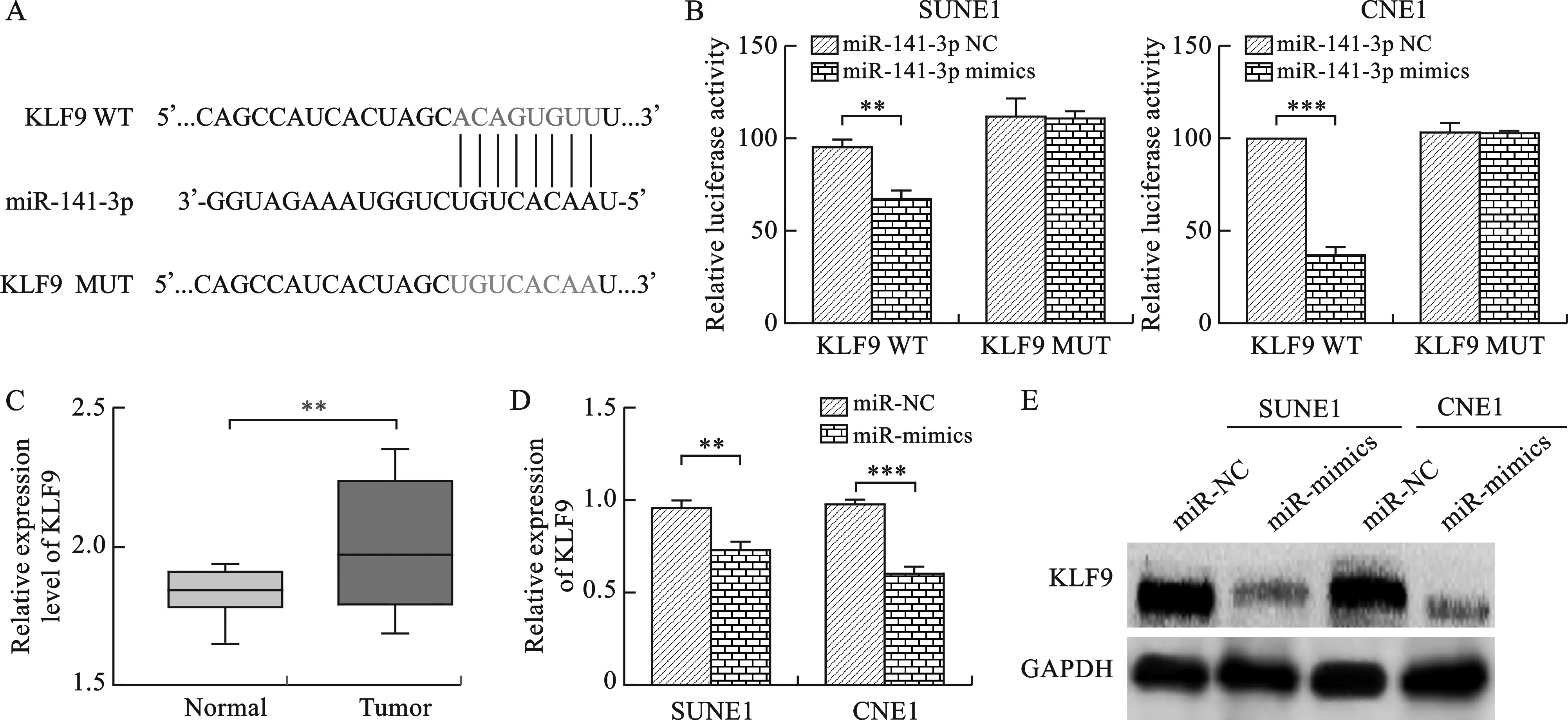
注:B圖中,與陰性對照組相比,**P<0.01,***P<0.001;C圖中,與正常組織相比,**P<0.001;D圖中,與陰性對照組相比,**P<0.01,***P<0.001
3 討 論
鼻咽癌是我國常見的頭頸部惡性腫瘤之一,同步放化療作為標準治療手段取得了令人滿意的療效[6-7]。然而,仍然有近30%的患者在經過放化療后出現局部復發或遠處轉移而導致治療失敗[8]。因此,探究鼻咽癌侵襲轉移機制并尋找鼻咽癌治療新靶點很有必要。研究[9]發現,多種lncRNA通過促進上皮間質轉化、腫瘤新生血管形成等多種機制參與鼻咽癌侵襲與轉移,其中lncRNA SNHG家族被發現與鼻咽癌發生與發展關系密切。lncRNA SNHG15是目前SNHG家族研究的熱點,被發現與多種腫瘤的惡性增殖及分化相關[10]。但較少有研究探究SNHG15在鼻咽癌中的表達情況及調控機制。本研究發現SNHG15在鼻咽癌中的表達顯著增高,同時高表達的SNHG15也預示著鼻咽癌患者的不良預后。在鼻咽癌細胞SUNE1和CNE1中抑制SNHG15后細胞的增殖能力明顯減弱,同時細胞凋亡比例顯著增高,提示SNHG15可能參與了鼻咽癌細胞的惡性增殖及轉移。
lncRNA的亞細胞定位決定著它們可能的生物學效應。我們通過核質分離實驗發現SNHG15大多數分布于SUNE1和CNE1細胞的胞質中,顯示SNHG15可能在轉錄后水平發揮調控作用。研究[11]發現,lncRNA常通過競爭性結合并抑制microRNA而影響microRNA下游基因的表達調控而發揮作用。microRNA表達水平失調與多種惡性腫瘤的發生與發展相關[12]。蘇建淳等[13]發現,microRNA miR-124與鼻咽癌的增殖、侵襲及預后有顯著相關性。本研究中,我們發現鼻咽癌組織中SNHG15的表達與miR-141-3p的表達呈顯著負相關關系,而干擾SNHG15后能夠顯著促進鼻咽癌細胞中miR-141-3p的表達,提示SNHG15能夠結合miR-141-3p并抑制其表達,SNHG15可能是通過抑制miR-141-3p而發揮作用的。
為了進一步探究miR-141-3p下游靶點,我們通過TargetScan選擇了KLF9進行后續研究。KLF9是一種與分化相關的轉錄因子,廣泛參與神經發育、B細胞分化、增殖、凋亡等過程[14]。研究[15]發現,KLF9是細胞發生氧化應激的關鍵因子,可能通過上調細胞內的活性氧(ROS)增強細胞氧化應激,促進腫瘤的發生。本研究中發現,miR-141-3p能夠靶向結合KLF9,在鼻咽癌細胞中過表達miR-141-3p能抑制KLF9 mRNA及蛋白的表達。這些結果表明SNHG15可能結合并抑制miR-141-3p的表達,從而促進miR-141-3p下游靶點KLF9的表達,參與鼻咽癌細胞的發生與發展。
綜上所述,SNHG15在鼻咽癌中異常高表達,可能競爭性結合miR-141-3p并影響其下游靶基因KLF9的表達,從而促進鼻咽癌細胞增殖。

