老年高血壓患者血壓變異性與血管緊張素(1-7)的相關性
張學敏,王錦錦,李穩靜,王書,劉玉,謝軍,余其貴,張穎,吳澤兵,胡世蓮
[1.安徽醫科大學第三附屬醫院(合肥市第一人民醫院)老年病科,合肥 230061;2.安徽合肥市第二人民醫院全科醫學科;3.中國科學技術大學附屬第一醫院(安徽省立醫院);4.安徽省老年醫學研究所;5.腫瘤免疫與營養治療安徽省重點實驗室]
隨著我國已經邁入老齡化社會,高血壓已成為老年人致死、致殘的重要原因。血壓變異性(BPV)是指個體在一定時間內血壓波動的程度,是神經、體液、環境、行為等因素相互作用的結果,其作為心血管事件的重要預測因子,能提供比診室血壓更準確的預后信息[1-2]。血管緊張素(1-7)[Ang(1-7)]被發現是腎素血管緊張素系統(RAS)新成員,在血壓控制、體內平衡、高血壓及其他心血管疾病的發病中起著重要作用,是高血壓發生發展的重要機制[3]。研究發現Ang(1-7)可以舒張血管、降低血壓、保護血管內皮、改善心肌重構、抑制血管平滑肌細胞收縮和增殖,是 RAS中與血管緊張素Ⅱ(AngⅡ)功能效應相反的血管活性物質[4],生理情況下,它們相互拮抗、相互平衡以發揮正常生理作用[5]。目前有關BPV與Ang(1-7)是否有關罕有報道,本研究旨在探討老年高血壓患者BPV與Ang(1-7)的變化及它們之間的相關性,為臨床進一步干預異常血壓變異性提供新的思路。
1 對象與方法
1.1 研究對象 選擇2017年6月至2018年12月在安徽醫科大學第三附屬醫院老年病科門診的老年高血壓患者52例,對照組為同期健康體檢的血壓正常老年人50例,本研究方案取得安徽醫科大學第三附屬醫院倫理委員會的批準同意。
1.2 納入與排除標準 納入標準:年齡在60歲以上的高血壓患者,持續或3次非同日血壓測量,收縮壓≥160 mm Hg(1 mm Hg=0.133 kPa)和(或)舒張壓≥100 mm Hg;患者既往有高血壓病史,且目前正在服用降壓藥物,血壓雖低于140/90 mm Hg,也診斷為高血壓。所有研究對象自愿參加并簽署知情同意書。排除標準:繼發性高血壓、急性心腦血管事件發生者、嚴重心功能不全、不穩定型心絞痛、嚴重感染、肝臟丙氨酸氨基轉移酶或天冬氨酸氨基轉移酶升高者、肌酐升高者、糖尿病、惡性腫瘤、痛風、對本研究藥物禁忌者。
1.3 研究方法
1.3.1 臨床資料采集及相關生化資料檢測 入選時記錄性別、年齡、吸煙、高血壓病程和診室血壓等基本信息。次日清晨空腹抽靜脈血6 mL,分為2管,每管3 mL,采血標本抗凝、離心,一管送檢驗科采用全自動生化分析儀檢測肝腎功能、三酰甘油(TG)、血清膽固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、空腹血糖(FPG)、血尿酸(UA)。另一管靜脈血-80 ℃冰箱凍存用于檢測Ang(1-7)。
1.3.2 實驗室檢測 血漿Ang(1-7)采用ELISA法檢測,試劑盒購自上海源葉生物科技有限公司(批號:E20180301A)。
1.3.3 動態血壓監測 所有入選患者24h動態血壓監測,采用美高儀MGY-ABP1型全自動便攜式動態血壓監護儀。設置白晝時間為6:00—22:00,每30分鐘測血壓1次,夜間時間為22:00—次晨6:00,每60分鐘測血壓1次。計算機自動記錄每次血壓值,并自動統計記錄24 h、白晝、夜間以下參數:(1)平均收縮壓(SBP)及相應標準差(SBPSD),(2)平均舒張壓(DBP)及相應標準差(DBPSD)。根據記錄參數計算收縮壓變異性(SBPV)、舒張壓變異性(DBPV)。
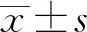
2 結果
2.1 基本情況比較 對照組、研究組患者在性別、年齡、吸煙史、TG、TC、LDL-C、HDL-C、FPG、UA、診室收縮壓、診室舒張壓差異均無統計學意義(P>0.05)。見表1。
2.2 血壓比較 對照組與研究組24小時收縮壓(24hSBP)、24小時舒張壓(24hDBP)、白晝收縮壓(dSBP)、白晝舒張壓(dDBP)、夜間收縮壓(nSBP)、夜間舒張壓(nDBP)差異均無統計學意義(P>0.05)。見表2。
2.3 血壓變異性比較 對照組與研究組24小時收縮壓變異性(24hSBPV)、24小時舒張壓變異性(24hDBPV)、白晝收縮壓變異性(dSBPV)、夜間收縮壓變異性(nSBPV)、夜間舒張壓變異性(nDBPV)差異均有統計學意義(P<0.05),兩組間nDBPV差異無統計學意義(P>0.05)。見表3。
2.4 Ang(1-7)的比較 對照組[(279.0±96.0)ng/L]]與研究組Ang(1-7)[(102.4±37.2)ng/L]差異有統計學意義(t=12.158,P<0.01)。
2.5 BPV與的Ang(1-7)相關性分析 對照組Ang(1-7)與24hSBPV有相關性(r=0.333,P=0.018),與24hDBPV、dSBPV、白晝舒張壓變異性(dDBPV)、nSBPV、nDBPV無相關性(P值均>0.05)。試驗組Ang(1-7)與24hSBPV有相關性(r=0.502,P<0.001),與24hDBPV、dSBPV、dDBPV、nSBPV、nDBPV無相關性(P值均>0.05)。

表1 兩組人群基本情況的比較
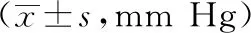
表2 兩組人群血壓的比較
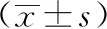
表3 兩組人群血壓變異性的比較
3 討論
隨著老齡化社會的到來及醫療衛生事業的發展,高血壓是最常見的慢性非傳染性疾病,是全球疾病負擔最重的疾病[6-8]。老年高血壓的治療不再是簡單降低血壓,更重要的是減少高血壓對靶器官的損傷,最大程度的降低心腦血管病的致殘率及病死率,與平均血壓相比,短時和長時BPV的增加在心血管疾病及腎臟損害的發生、進展及嚴重程度上具有更高的預測價值,即使是單純性BPV增高也可以導致血管重構等器官損傷[9-11],增加心血管不良事件及死亡風險[9]。本研究也進一步證實老年高血壓患者血壓變異性明顯高于血壓正常的老年人,此結果與國內外各研究結果相似[12-14],年齡、性別、基礎血壓高低及內外界環境等均是血壓變異性的影響因素,這也提示老年高血壓患者的降壓雖然診室血壓控制達標,但由于血壓變異性升高,所以心血管事件的風險明顯升高。
在本研究中顯示,老年高血壓患者體內Ang(1-7)的水平較血壓正常的老年人低,進一步證實老年患者出現血壓升高可能與體內Ang(1-7)降低有關,研究表明Ang(1-7)可協同緩激肽,促進一氧化氮 、前列環素等舒血管物質的生成;可通過刺激cGMP/pKG信號,降低交感神經系統的活性,減少下丘腦中去甲腎上腺素釋放,產生抗高血壓的效果;除此之外,血管緊張素轉換酶2(ACE2)是產生Ang(1-7)的重要蛋白酶,ACE2-Ang(1-7)-Mas 軸可以通過降低 AngⅡ所誘導的氧自由基,降低體內活性氧水平。即Ang(1-7)可通過抑制血管收縮,減少水鈉潴留、抑制細胞增殖及抗活性氧應激等方式發揮降壓作用。
本研究表明,老年高血壓患者Ang(1-7)明顯降低與24hSBPV變異性明顯相關,提示老年高血壓患者體內Ang(1-7)的變化不僅影響血壓,而且與血壓變異有著緊密關系。綜合國內外文獻[15-17]也提示Ang(1-7)可能參與了BPV的調節機制。Lemos等[18]在基因敲除 MasR 的大鼠模型中發現,該模型大鼠不僅收縮壓升高,且BPV也增高,其推測原因是基因敲出 MasR 后 Ang(1-7)未起到拮抗AngⅡ的作用。而Casali等[19]在基因敲除MasR的大鼠中也得出了上述相似結果,而其認為可能是腎臟中Ang(1-7)的缺乏使鈉和水的排泄失衡,及Mas受體缺陷小鼠存在的內皮功能障礙是BPV增高的原因之一。國內有文獻表明高鹽伴高血壓的大鼠可能激活了腎臟局部的 RAS系統,導致RAS相關的蛋白表達量發生變化,使血管緊張素轉換酶(ACE)、AngⅡ、血管緊張素Ⅱ受體1型受體(AT1R) 等蛋白量表達量升高,而ACE2及Ang(1-7)的表達水平降低[20-21],且ACE2的基因失活會導致腎臟中AngⅡ的增加和Ang(1-7)肽水平的降低,ACE/ACE2之間的相對平衡決定著AngⅡ/Ang(1-7)的動態平衡導致ACE/ACE2、AngⅡ/Ang(1-7)軸動態失衡[22],Ang(1-7)不能起到拮抗AngⅡ的作用,從而導致患者血壓變異性的升高,推測ACE2/Ang(1-7)/MasR 軸受損可能參與高鹽伴高BPV的發生機制。

