豬圓環病毒1型和2型核酸定性標準樣品的研制
董浩,原霖,畢一鳴,劉洋,劉穎昳,劉玉良,陳亞娜,顧小雪,王傳彬
(中國動物疫病預防控制中心,北京 102618)
豬圓環病毒(PCV)為無囊膜的單股負鏈DNA病毒,是目前發現的最小的動物病毒,大小約為17 nm。PCV根據抗原性及基因組的不同分為豬圓環病毒1型(PCV1)、2型(PCV2)以及2016年新出現的3型(PCV3)。PCV1分離自豬腎細胞系PK15,它不致病,能夠在PK15中穩定存在而不形成細胞病變;PCV2對豬有致病性,可引起豬斷奶后多系統衰竭綜合征(PMWS)、豬皮炎與腎病綜合征(PDNS)、斷奶豬和育肥豬的呼吸道疾病、豬的繁殖障礙等疾病;PCV3感染可引起母豬厭食、PDNS及繁殖障礙等,對其研究尚處起步階段。
PCV2引起的疾病近年來已成為嚴重危害我國養豬業的主要疾病之一[1]。1991年PCV2首次在加拿大被發現后,迅速在各個養豬國家蔓延,嚴重威脅著全球養豬業的發展。2000年,郎洪武等[2]首次報道了我國豬群感染PCV2的相關情況。2018年,何長生等[3]采用熒光定量PCR方法對來自安徽省3個地區12個豬場健康豬群進行PCV2檢測,PCV2個體陽性率和群體陽性率分別是67.4%和91.7%。孫圣福等[4]對山東省生豬養殖、流通、屠宰加工等環節中PCV2污染狀況的檢測表明,養殖場、屠宰場、運輸車輛、洗消中心的場點陽性率分別為5.88%、5.26%、5.88%和20.00%,樣品陽性率分別為2.01%、1.68%、0.75%和2.90%。吳明臻等[5]對近幾年浙江金華地區PCV2流行情況的研究表明,2012—2018年PCV2個體陽性率分別為10.16%、11.95%、8.50%、9.94%、6.19%、5.94%和8.28%。上述研究表明,我國當前PCV2的流行情況依然不容樂觀,需要引起足夠重視。
國內相關標準和規范中都規定了PCV的核酸檢測方法[6-9],但是目前國內外尚無機構或公司生產PCV相關的標準樣品,無法評價檢測試劑、驗證檢測能力和控制檢測質量。基于此,本研究針對PCV1和PCV2開展了PCV分型鑒定核酸標準樣品研制工作,獲得了該病毒核酸檢測定性標準樣品,有望解決PCV在檢測中存在的實際問題。
1 材料與方法
1.1 主要試劑
E.Z.N.A.? Plasmid Mini Kit試劑盒購自Omega公司;QuantStudioTM3D Digital PCR 20K Chip Kitv2 and Master Mix購自Thermo公司;One-Step RT-ddPCR Kit for Probes購自伯樂公司;豬瘟病毒通用型實時熒光 RT-PCR檢測試劑盒、豬偽狂犬病毒實時熒光 PCR 檢測試劑盒、豬圓環病毒 2 型實時熒光 PCR 檢測試劑盒、豬細小病毒實時熒光 PCR 檢測試劑盒、支原體檢測試劑盒、豬繁殖與呼吸綜合征病毒實時熒光RT-PCR檢測試劑盒、豬繁殖與呼吸綜合征病毒美洲經典株實時熒光PCR檢測試劑盒均購自世紀元亨公司;引物探針由英濰捷基有限公司合成。
1.2 標準樣品原料的制備
對PCV1序列(GenBank 登錄號:JN133303)和PCV2序列(GenBank 登錄號:HQ395021)全基因組序列進行分析,檢查序列內部有無特別復雜二級結構和重復序列后,發送給英濰捷基(上海)貿易有限公司合成。將合成好的序列裝入pMD18-T載體并轉化至大腸桿菌DH5ɑ感受態細胞。
將分別含有PCV1和PCV2全序列的陽性克隆在含有氨芐抗性的LB液體培養基中擴大培養至對數期,使用E.Z.N.A.? Plasmid Mini Kit試劑盒進行質粒提取。采用紫外分光光度法對質粒的純度進行測定。對2個提取好的質粒分別進行無菌檢驗和無其他病毒(豬瘟病毒、豬偽狂犬病毒、豬繁殖與呼吸綜合征病毒和豬細小病毒)檢驗。
對上述2個提取的質粒分別用陰性稀釋液進行適當倍數稀釋后,采用數字PCR方法進行質粒濃度的初步測定。對稀釋好的標準樣品原料按照0.5 mL每管進行分裝,2種質粒溶液各分裝1 000管,置于-20 ℃儲存。
1.3 均勻性評估
從分裝好的標準樣品原料中隨機抽取30管標準樣品,每管樣本使用數字PCR方法進行檢測3次。試驗結果數據使用單因素方差分析方法對標準樣品進行均勻性評估。
1.4 穩定性評估
為了評估制備的標準樣品的穩定性,分別進行了長期穩定性評估和短期穩定性評估。
1.4.1 長期穩定性評估
分別在第1、6、12、18和24個月抽取5管PCV1、PCV2核酸定性標準樣品使用數字PCR方法進行檢測,每個樣品檢測2次,計算平均值。使用回歸方法對PCV1、PCV2核酸定性標準樣品的檢測結果進行長期穩定性評估。
1.4.2 短期穩定性評估
分別將制備的標準樣品在4 ℃、25 ℃和37 ℃環境下存放60、21和6 d。抽取3瓶的PCV1、PCV2核酸定性標準樣品使用數字PCR方法進行檢測,每個樣品檢測1次。使用t檢驗方法對PCV1、PCV2核酸定性標準樣品進行短期穩定性評估。
1.5 標準樣品的定值
1.5.1 特性值的測定
將分別含有PCV1和PCV2全序列的質粒使用M13F和M13R通用引物,分別送至生工生物工程(上海)有限公司、深圳華大基因科技有限公司、中美泰和生物技術有限公司進行測序分析。將3家測序的結果分別進行Blast分析。
1.5.2 參考值的測定
通過多個實驗室合作定值方式對PCV1、PCV2核酸定性標準樣品進行參考值的定值。在本研究中,委托了農業農村部獸醫診斷中心、北京市動物疫病預防控制中心實驗室、上海市動物疫病預防控制中心實驗室、山東省動物疫病預防與控制中心實驗室、河南省動物疫病預防控制中心實驗室、遼寧省動物疫病預防控制中心實驗室、吉林省動物疫病預防控制中心實驗室和浙江省動物疫病預防控制中心實驗室共8家實驗室使用數字PCR技術對標準樣品的參考值進行測定。匯總各家測定的定值數據后,先進行測定數據的處理[10]。對數據進行了組內可疑值檢驗、組間數據等精度檢驗剔除可疑值。在各組數據等精度的情況下,用t檢驗方法檢驗各組數據平均值是否存在顯著性差異。如平均值無顯著性差異,先合并數據,檢驗數據分布的正態性,在符合正態分布的情況下,可將多個平均值再次計算平均值,求出總平均值,即為參考值。
1.6 臨床試用
上海市動物疫病預防控制中心、山東省動物疫病預防與控制中心和遼寧省動物疫病預防控制中心3家試用單位在檢測日常臨床樣本時,將試用的PCV1、PCV2核酸定性標準樣品進行熒光定量PCR檢測,一次檢測2管標準樣品,每管重復檢測3次。
2 結果
2.1 標準樣品的制備
分別含有PCV1和PCV2基因組全長序列質粒的構建由英濰捷基(上海)貿易有限公司完成。對構建完成的質粒采用M13F和M13R通用引物進行雙向測序。將獲得的序列信息分別進行Blast序列分析,結果顯示PCV1基因序列與已發表的PCV1 CCL33-UGent的復制相關蛋白和衣殼蛋白的基因序列(GenBank登錄號:JN133303)相似度100%;PCV2基因序列與已發表的PCV2 08TJ株(GenBank登錄號:HQ395021)相似度100%。
制備的核酸標準樣品的物理性狀呈無色均一液體,無絮狀沉淀物或大塊沉淀。無菌檢驗結果顯示制備的標準樣品原料涂布在無抗性的LB固體培養基上無細菌菌落生長;使用豬瘟病毒通用型實時熒光RT-PCR檢測試劑盒、豬偽狂犬病毒實時熒光 PCR 檢測試劑盒、豬細小病毒實時熒光 PCR 檢測試劑盒、豬繁殖與呼吸綜合征病毒實時熒光RT-PCR檢測試劑盒檢測均為陰性;采用文獻[6]方法和PCV2實時熒光 PCR 檢測試劑盒分別檢測含有PCV1和PCV2全序列的質粒溶液均為陽性。
2.2 均勻性檢測
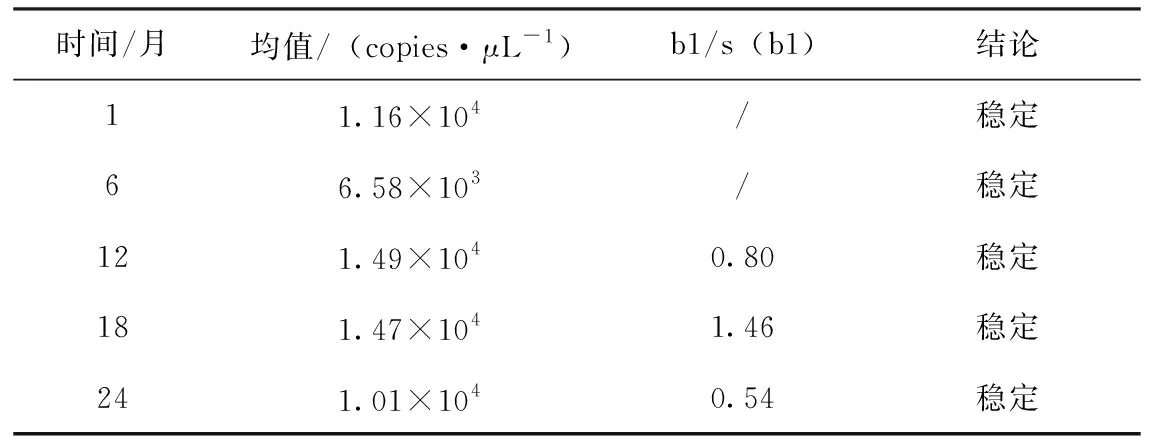
從分裝好的標準樣品原料中隨機抽取30管樣品,共進行了90次檢測。根據自由度(v1,v2)及給定的顯著性水平α,可由表查臨界值的F值,算得F 表1 PCV1均勻性檢測結果 表2 PCV2均勻性檢測結果 2.3.1 長期穩定性評估 長期穩定性評估則是測試標準樣品在長期儲存條件下(-20 ℃)的穩定性。分別在第1、6、12、18和24個月抽取5管標準樣品進行穩定性評估,結果均小于對應的t0.05,n-2因子的分位數,未觀測到不穩定性,能滿足實際測量的需要。上述結果說明本標準樣品在-20 ℃環境下可穩定至少24個月。考慮到實際運輸條件等因素對標準樣品穩定性的影響,因此確定本標準樣品可在-20 ℃下穩定保存24個月(表3和表4)。 表3 PCV1的長期穩定性結果 表4 PCV2的長期穩定性結果 2.3.2 短期穩定性評估 將標準樣品分別在4 ℃、25 ℃、37 ℃環境下存放60、21和6 d與存放在-80 ℃環境中的檢測結果分別進行短期穩定性分析,結果均小于對應的t0.05,n-2因子的分位數,故認為未觀測到不穩定性,說明本標準樣品能滿足實際測量的需要(表5和表6)。因此,標準樣品可在4 ℃環境穩定60 d,25 ℃環境穩定21 d,37 ℃環境可穩定6 d。 表5 PCV1短期穩定性結果 表6 PCV2短期穩定性結果 委托8家實驗室采用數字PCR方法對標準樣品的參考值進行測量,最終測定PCV1、PCV2核酸定性標準樣品的參考值分別為1.33×104copies/μL和1.11×104copies/μL 。 將PCV1、PCV2核酸定性標準樣品分別送3家公司使用M13F和M13R通用引物進行測序。3家公司均獲得了PCV1和PCV2全序列,通過Blast序列相似度比較,PCV1可溯源至GenBank登錄號為JN133303的CCL33株,核苷酸序列相似度為100%;PCV2可溯源至GenBank登錄號為HQ395021的08TJ株,核苷酸序列相似度為100%。 委托的3家實驗室采用現行的豬圓環病毒核酸檢測標準對PCV1、PCV2核酸定性標準樣品進行了試用,試驗結果表明該標準樣品質量穩定,檢測結果均為陽性,能夠與我國現行的PCV檢測標準相匹配。 制備的PCV1、PCV2核酸定性標準樣品滿足了國家標準樣品的要求,通過了國家標準化管理委員會組織的專家評審。 檢測結果的準確可靠對于實驗室檢測至關重要,這不僅要監測實驗室檢測過程中的人、機、料、法、環的正常運轉,還需要采取有效的質量控制方式,從而實現長期有效的質量保證[11]。標準樣品由于具有均勻性和穩定性,并且經過溯源,量值和不確定度是確定的,因此可以作為參照物或質控樣品對檢測數據的準確性和可靠性進行核查,從而幫助排查實驗室人、機、料、法、環等影響因素的偏差,以便實驗室采取有效的糾正和預防措施[12]。 實驗室檢測技術是PCV檢測的重要手段,包括病毒分離、免疫熒光、免疫組化、酶聯免疫吸附試驗和分子生物學試驗等方法。其中,分子生物學檢測方法主要有常規PCR、套式PCR、多重PCR、熒光定量PCR和環介導等溫擴增等方法[13]。雖然目前我國已經有多項現行的PCV檢測國家標準和行業標準,但是缺乏與之配套的豬圓環病毒檢測相關的標準樣品,無法評價檢測試劑、驗證檢測能力和控制檢測質量。在早期的相關研究中,高志強等[14]針對PCV2 QD/2014株ORF2片段構建了重組腺病毒核酸擴增檢測標準樣品,該種標準樣品的優點是可以對DNA的提取過程進行質控,同時還能避免造成氣溶膠污染。和上述研究相比,本研究研制的PCV1、PCV2核酸定性標準樣品,一方面是提供了PCV1和PCV2兩管標準樣品適用于各種標準中的分型方法;另一方面本研究中的標準樣品是基于PCV1和PCV2的全基因序列研制的,適用于所有類型的PCV核酸檢測方法;除此之外,還通過數字PCR技術進行準確定量,將標準樣品中的質粒拷貝數控制在104左右,最大限度地降低了氣溶膠污染的發生。 綜上所述,本研究研制的PCV1、PCV2核酸定性標準樣品均勻性和穩定性均比較理想,經過多家實驗室的臨床試用為合格,通過了國家標準化管理委員會組織的專家評審,能夠促進PCV實驗室核酸檢測的標準化和規范化。

2.3 穩定性檢測



2.4 標準樣品的定值
2.5 試用情況
2.6 評審結論
3 討論

