瘤胃厭氧真菌木聚糖酶基因的表達與酶學特性研究
馬玉萍,薛天涵,成艷芬,朱偉云
(南京農業大學消化道微生物實驗室,江蘇 南京 210095)
半纖維素是自然界中除纖維素外含量最為豐富的可再生植物多糖,木聚糖是半纖維素主要組成成分,增加對植物木聚糖的降解效率能有效提高木質纖維素的利用效率。木聚糖由木糖分子以 β-1, 4-木糖苷鍵連結構成主鏈。異質多糖的木聚糖側鏈含有種類各異的糖基,如阿拉伯呋喃糖苷基、葡糖醛酸基或乙酰基等[1]。木聚糖酶是一類可以將木聚糖降解成低聚木糖或木糖的復合酶系,主要包括內切β-l, 4-D-木聚糖酶、β-D-木糖苷酶、α-L-呋喃阿拉伯糖苷酶、α-D-葡糖苷酸酶、α-D-葡萄糖醛酸苷酶、乙酰木聚糖酯酶和酚酸酯酶[2]。木聚糖酶廣泛應用于釀酒[3]、食品、飼料[4]等行業,高效合理地利用木質纖維素廢棄物,能夠促進環境友好的能源轉化。
木聚糖酶的降解能力與序列來源、結合模塊特異性及其個數、催化區域的特異性有密切聯系[5]。根據木聚糖酶催化結構中序列的同源性,將其分為不同的糖苷水解酶家族,其中GH10、GH11家族被研究的最多。來源于GH10家族的木聚糖酶序列高達上千條,生物多樣性豐富,因此具有很大的探索潛能。瘤胃內厭氧真菌對植物粗纖維具有高效的黏附和降解能力[6],所以厭氧真菌被認為是比細菌和酵母菌更有潛力的木聚糖酶生產者[7],但目前很少有來源于厭氧真菌的木聚糖酶被開發利用。本研究從厭氧真菌基因組中挑選4個GH10家族木聚糖酶基因,在大腸桿菌中進行異源表達后測定其酶學性質,為開發利用厭氧真菌木聚糖酶資源以及研究和改造GH10家族木聚糖酶基因奠定基礎。
1 材料與方法
1.1 菌株與質粒
在厭氧真菌基因組中挑選出4個木聚糖酶基因(A、C、D和F)和氨基酸序列,根據大腸桿菌基因編碼的偏好性,合成酶基因序列(上海生工生物有限公司)。質粒(pET-28a)、大腸桿菌BL21(DE3)與DH5α均購自上海生工生物有限公司,卡那霉素作為抗生素使用濃度為100 μg/mL。
1.2 主要試劑和培養基
DNA聚合酶與T5核酸外切酶購自 TaKaRa 公司;IPTG、卡那霉素(Kan)、DNA膠回收試劑盒、質粒抽提試劑盒和SDS-PAGE試劑盒均購自上海碧云天生物技術有限公司;DNA Marker和蛋白質分子量標準購自MBI公司;苯甲基磺酰氟(PMSF)購自索萊寶公司;燕麥木聚糖購自Sigma公司;低黏度小麥阿拉伯木聚糖、中黏度小麥阿拉伯木聚糖、高黏度小麥阿拉伯木聚糖、不可溶小麥阿拉伯木聚糖、山毛櫸木聚糖、高黏度黑麥阿拉伯木聚糖、羅望子木葡聚糖購自上海甄準生物科技有限公司;鎳珠購自HUACHUN公司;其他常規生化試劑均為國產分析純產品。
LB培養基含:酵母粉0.5 g、蛋白胨1.0 g、NaCl 1.0 g,蒸餾水定容至100 mL,121 ℃高壓滅菌20 min。固體培養基:100 mL LB培養基中加2 g瓊脂粉。
1.3 目的基因的克隆及重組質粒轉化表達菌株
設計帶有同源臂的引物(表1)擴增4個木聚糖酶基因序列及pET-28a載體。目的片段擴增條件為:95 ℃預變性5 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸20 s,25個循環;72 ℃延伸5 min。載體循環擴增延伸時間為1 min,其余條件不變。PCR反應結束后,通過瓊脂糖凝膠電泳檢測目的條帶大小,驗證條帶大小正確之后用膠回收試劑盒回收純化。利用T5核酸外切酶連接載體和片段并轉化大腸桿菌DH5α 感受態,根據卡納抗性篩選單克隆重組子并測序。測序正確的單克隆用質粒小提試劑盒抽取質粒轉化大腸桿菌 BL21(DE3)感受態,將感受態涂布在含有卡那霉素的固體LB培養基上,37 ℃過夜培養。

表1 載體與4種木聚糖酶基因擴增PCR引物
1.4 木聚糖酶的表達和純化
挑取陽性克隆的轉化子在含卡那霉素液體LB培養基中37 ℃、220 r/min培養為種子液。按照1%體積的接種量把種子液轉接進入大體系的液體LB培養基,37 ℃、220 r/min培養菌液OD600=0.6~0.8時,加入終濃度為0.1 mmol/L的IPTG,18 ℃、220 r/min再誘導表達16 h。誘導結束后以8 000 r/min的速度離心10 min棄上清收集菌體,菌體用裂解緩沖液(20 mmol/L Tris-HCl, pH=8.0, 500 mmol/L NaCl)洗1遍。將菌體重懸至OD600=10左右,加入1%體積的重懸液100 mmol/L PMSF,冰上超聲裂解細菌,超聲結束后加入0.1%體積的重懸液100 mmol/L PMSF。裂解后的菌液以10 000 r/min的速度離心30 min,收集上清與鎳珠在4 ℃下結合1~2 h后,用含10~200 mmol/L咪唑的裂解緩沖液梯度洗脫。收集各個梯度的洗脫液用SDS-PAGE檢測目的蛋白,選擇不具有雜蛋白的洗脫液用30 kDa的超濾管濃縮換液至儲存buffer(20 mmol/L Tris-HCl, pH=8.0, 200 mmol/L NaCl, 1 mmol/L DTT, 1 mmol/L EDTA)中。
1.5 酶活性質的測定
木聚糖酶活力測定采用1959年Miller 等建立的DNS法。使用Bradford法蛋白濃度測定試劑盒測定蛋白濃度。在最適反應pH和溫度下,每分鐘降解木聚糖生成1 μmoL木糖所需的酶量定義為一個酶活力單位U,比酶活是單位重量(mg)蛋白質所具有的酶活力單位數。
試驗中所有種類的木聚糖底物濃度均為0.01 g/mL。以燕麥木聚糖為底物,測定木聚糖酶最適pH值、pH穩定性、最適溫度、溫度穩定性及金屬離子穩定性。最適pH值測定條件為:反應溫度37 ℃,pH值梯度從3.0至11.0,反應時間30 min。pH穩定性測定條件為:選擇最適pH值及最適pH值左右兩個pH點,37 ℃孵育,隔一定時間取樣測定剩余酶活。最適溫度測定條件為:pH=7.0(0.1 mol/L Tris-HCl),反應溫度為18 ℃、28 ℃、37 ℃、45 ℃、53 ℃、62 ℃,反應時間30 min。溫度穩定性測定條件為:選擇最適溫度及最適溫度左右兩個點,即木聚糖酶A、C、F在溫度28 ℃、37 ℃、45 ℃下孵育,木聚糖酶D在溫度18 ℃、28 ℃、37 ℃下孵育,隔一定時間測定剩余酶活。金屬離子穩定性檢測條件為:在酶促反應體系中分別加入終濃度為5 mmol/L 的金屬離子(Ca2+、Na+、K+、Zn2+、Mg2+、Mn2+、Cu2+、Fe2+、Fe3+、Co3+),在pH值為7、溫度為37 ℃下反應30 min。對照組(CK)為不含任何金屬離子的酶促反應體系。
底物特異性檢測時,分別選擇低黏度小麥阿拉伯木聚糖(WAL)、中黏度小麥阿拉伯木聚糖(WAM)、高黏度小麥阿拉伯木聚糖(WAH)、不可溶小麥阿拉伯木聚糖(WAI)、燕麥木聚糖(X)、山毛櫸木聚糖(BX)、高黏度黑麥阿拉伯木聚糖(RAX)以及羅望子木葡聚糖(ATX)為底物,在最適pH值和最適溫度下反應30 min測定酶活。
1.6 數據分析
利用ProtParam tool of ExPASY(ProtParamhttps://web.expasy.org/protparam/)軟件分析木聚糖酶的分子量大小、等電點、不穩定系數。采用 SPSS 20.0軟件中的One-way ANOVA 過程進行單因素方差分析,Duncan法進行各組間多重比較,以P<0.05 作為差異顯著性判斷標準。
2 結果與分析
2.1 木聚糖酶序列分析與克隆表達
4種木聚糖酶基因A、C、D和F片段長度分別為1 347、1 428、1 359和1 446 bp,其理論蛋白分子量分別為49.87、54.59、50.37和54.86 kDa;理論等電點分別為8.52、4.67、9.10、4.36;理論不穩定系數分別為26.54、32.02、24.30、38.32,都為穩定類蛋白。
4種厭氧真菌木聚糖酶的表達見圖1,SDS-PAGE顯示,4種木聚糖酶蛋白質分子量分別為75、70、52和73 kDa,其表達產物以胞內可溶性蛋白和不溶性包涵體形式存在。

M. 蛋白分子量標準;1. 木聚糖酶A;2. 木聚糖酶C;3. 木聚糖酶D;4. 木聚糖酶F圖1 厭氧真菌4種木聚糖酶的SDS-PAGE分析
2.2 pH對4種木聚糖酶活性的影響
4種木聚糖酶最適pH值如圖2所示,其反應最適pH值均為8.0。木聚糖酶pH穩定性結果如圖3所示,木聚糖酶A在pH值為7.0、8.0、9.0下酶活都很穩定,具有很高的pH耐受性;木聚糖酶C對pH值為9.0的穩定性要優于pH值為7.0、8.0,在長達20 h的時間內該酶仍保留有90%的活性;木聚糖酶D在孵育初期,酶活迅速下降到60%,其pH穩定性較差;木聚糖酶F在pH值為9.0條件下穩定性較好,pH值為7.0和8.0條件下,孵育20 h后酶活迅速下降。
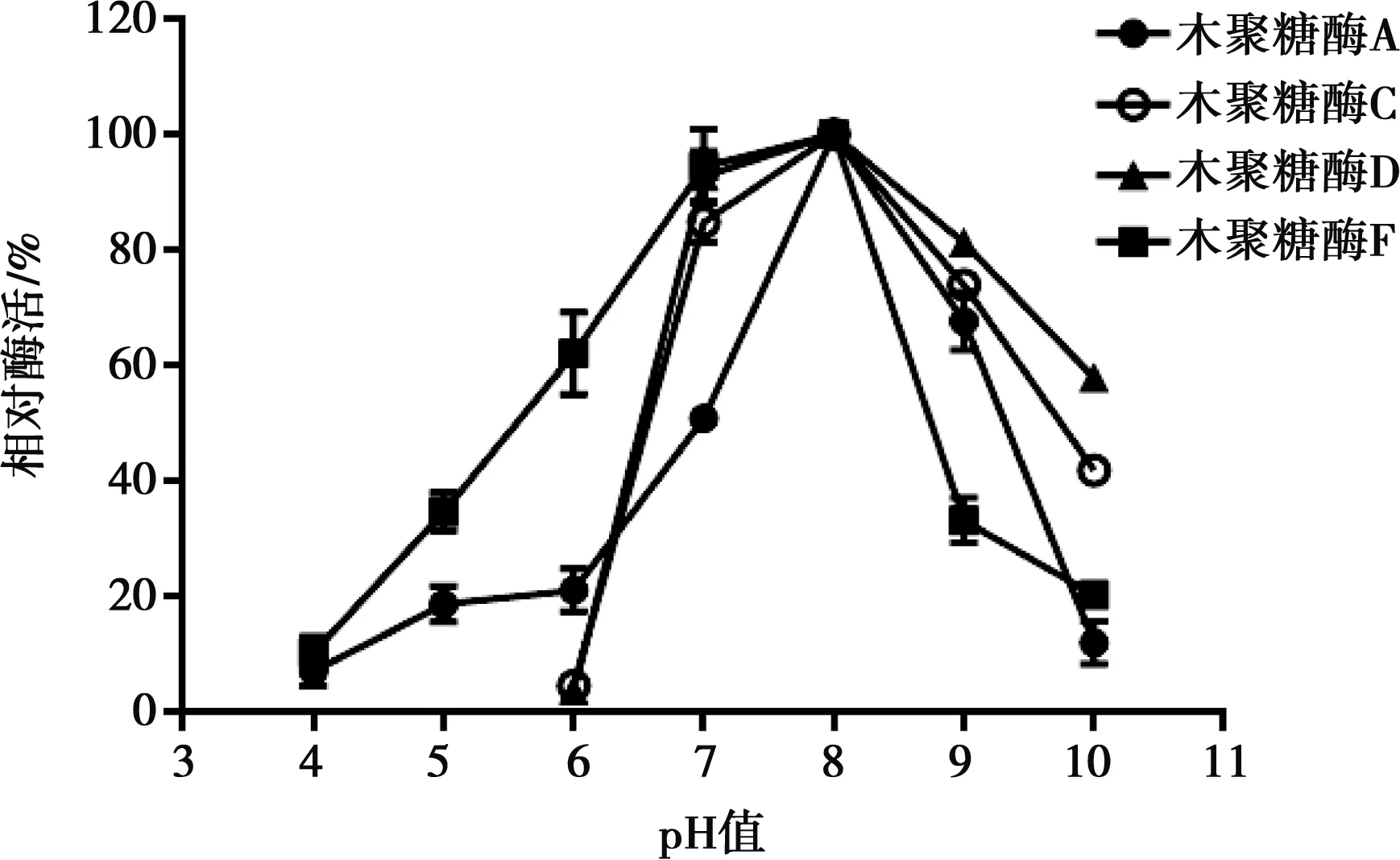
圖2 4種木聚糖酶最適pH值測定

圖3 4種木聚糖酶的pH穩定性
2.3 溫度對4種木聚糖酶活性的影響
木聚糖酶D最適反應溫度為37 ℃,其余3種木聚糖酶最適反應溫度為45 ℃(圖4)。木聚糖酶溫度穩定性結果如圖5所示,木聚糖酶A在孵育溫度為37 ℃時隨著時間延長酶活有所提高;木聚糖酶C在37 ℃時有很好的穩定性,24 h之內酶活基本無變化,而隨著孵育溫度升高酶活的穩定性變差;木聚糖酶D在孵育溫度為28 ℃下酶活衰減較慢,而在37 ℃、45 ℃下孵育1 h后酶活衰減到原有酶活的75%,在酶活下降到75%之后保持基本不變; 木聚糖酶F在最適溫度45 ℃下穩定性最好。
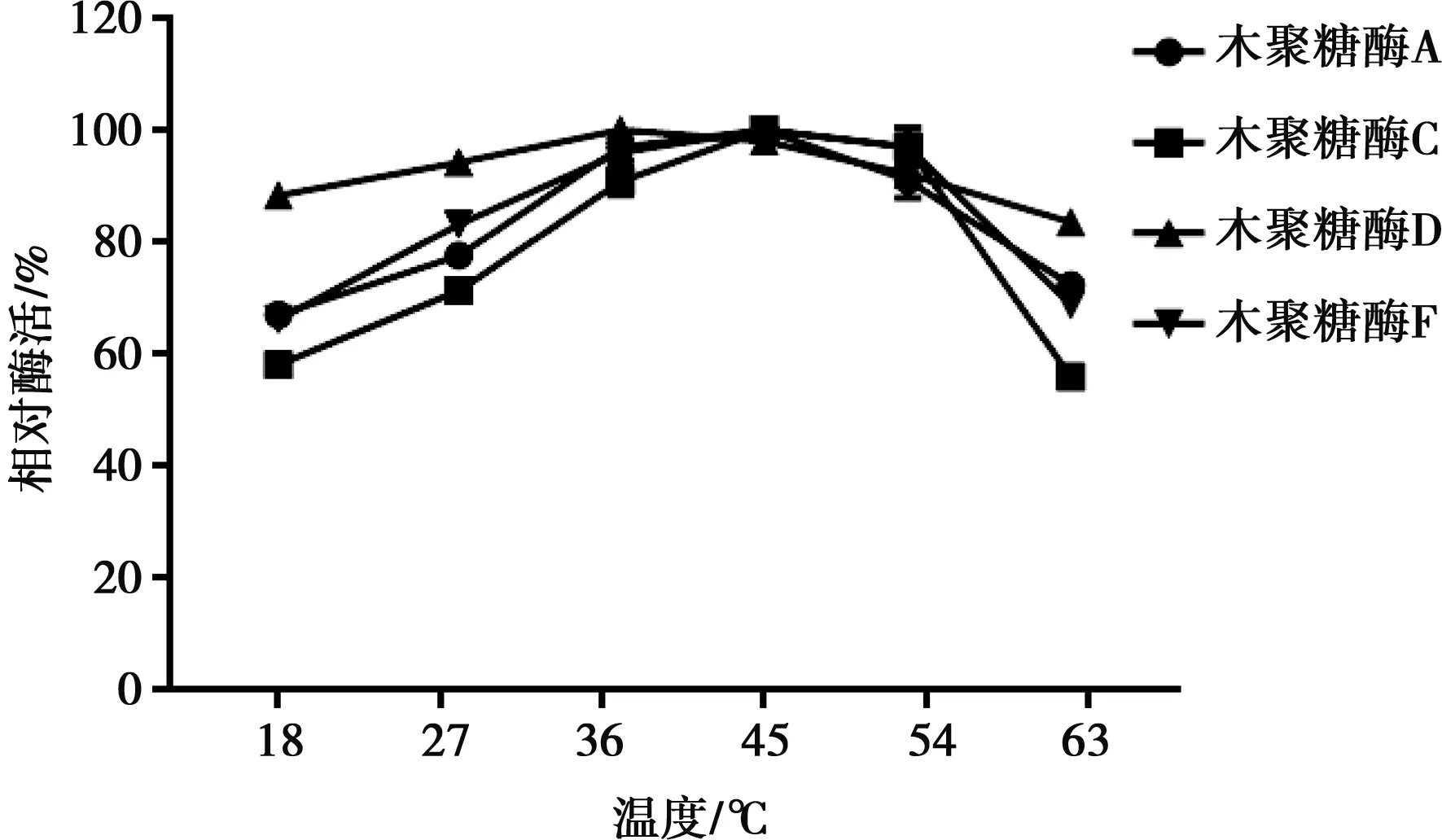
圖4 4種木聚糖酶的最適溫度
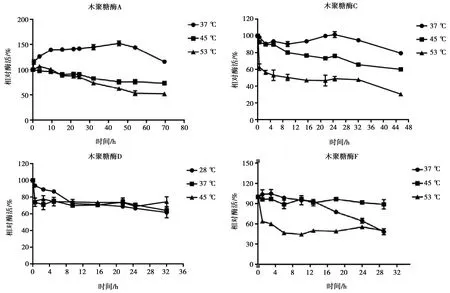
圖5 溫度對4種木聚糖酶活性的影響
2.4 金屬離子對4種木聚糖酶活性的影響
金屬離子對4種木聚糖酶活性的影響見圖6。對木聚糖酶A的酶活具有明顯促進作用的金屬離子有Ca2+、Mn2+、Mg2+(圖6),具有明顯抑制作用的金屬離子有Zn2+、Cu2+、Co3+;對木聚糖酶C的酶活具有明顯促進作用的金屬離子有Ca2+、Mg2+、Fe2+、Mn2+,具有明顯抑制作用的金屬離子有Zn2+、Cu2+;對木聚糖酶D的酶活具有明顯促進作用的金屬離子有Ca2+、Mg2+、Mn2+、Fe3+,具有明顯抑制作用的金屬離子有Zn2+、Cu2+、Co3+;對木聚糖酶F的酶活具有明顯促進作用的金屬離子有Ca2+、Mg2+、Mn2+、Fe2+、Co3+,具有明顯抑制作用的金屬離子有Zn2+。Ca2+對4種木聚糖酶的酶活促進作用最強,最高達到4倍促進作用。

注:字母相同表示差異不顯著(P>0.05),不同表示差異顯著(P<0.05)。下同圖6 金屬離子對4種木聚糖酶活性的影響
2.5 底物對4種木聚糖酶活性的影響
底物對4種木聚糖酶活性的影響見圖7。4種木聚糖酶對山毛櫸木聚糖的親和力顯著高于其他底物(P<0.05)。木聚糖酶A、C對4種不同的小麥阿拉伯木聚糖的降解效率沒有顯著差異(P<0.05),木聚糖酶D、F對羅望子木葡聚糖的降解效率顯著低于其他底物(P<0.05)。

圖7 底物對4種木聚糖酶的影響
3 討論
木聚糖位于木質素和纖維素的中間交界處,在連接兩者的同時,木聚糖對維持植物細胞纖維的凝聚力和細胞壁的完整性起著重要作用[8],是降解木質纖維素的重要阻礙之一,生物酶解是提高廢棄農作物利用率的主要手段之一。目前關于木聚糖酶的研究主要包括篩選高產木聚糖酶菌株、構建多效復合酶、優化培養及工藝條件、定向改造酶學性質等。但如何獲得低成本、高催化效率的木聚糖酶仍然是實際工業生產的主要瓶頸問題。瘤胃中存在許多能夠高效降解木質纖維素的厭氧真菌,相較于其他途徑制得的木聚糖酶活性會更高[9],因而其更具有開發潛能。
本研究發現,木聚糖酶A、C和F都具有良好的pH值和溫度穩定性,這一特性在酶工藝生產中占據很大的優勢,還可以通過分析基因序列對定向改造酶的穩定性提供參考。Ca2+能提高4種木聚糖酶的酶活并且效果顯著,可能是由于Ca2+作為輔因子增加了金屬離子結合位點的親和力使蛋白更加穩定, Pantoliano等[10]以枯草桿菌絲氨酸蛋白酶為模型發現一定濃度的Ca2+能有效提高酶的動力學穩定性。曾霖霖等[11]發現Ca2+對菠蘿蛋白酶的酶活和熱穩定性都具有促進作用。本研究中的4種木聚糖酶對除山毛櫸木聚糖外其他底物降解效率低,可能是由于這4種木聚糖酶作用的糖苷鍵單一或者沒有經過更完整的表觀遺傳修飾導致功能不全[12]。由于4種木聚糖酶都來自于糖苷水解酶第10家族,而該家族的酶主要包含內切木聚糖酶、內轉換糖基化酶、內切β-1, 4葡聚糖酶。山毛櫸來源的木聚糖中木糖成分占比高達82%,而在小麥阿拉伯木聚糖(低、中、高黏度)和黑麥阿拉伯木聚糖中木糖占比60%左右,阿拉伯糖占比38%左右。由于木聚糖酶無法有效作用于阿拉伯糖基進而無法高效降解小麥阿拉伯木聚糖,所以這4種木聚糖酶對小麥阿拉伯木聚糖的降解能力低于山毛櫸木聚糖。底物結構中木糖所占比例、側鏈糖基類型決定了4種木聚糖酶對底物的降解能力。
目前纖維素酶基因、花生條紋外殼病毒蛋白基因都是用大腸桿菌表達,因為大腸桿菌基因背景和表達調控過程清楚,培養周期短。本研究中,大腸桿菌表達的厭氧真菌來源的木聚糖酶比酶活相對較低,可能是因為4種木聚糖酶為真核蛋白,在大腸桿菌的原核表達過程中,沒有經過完整修飾導致酶活下降。Wu等[13]把來源于人纖溶酶原的Kringle - 1結構域與鏈激酶的C-末端融合,分別進行真核表達和原核表達,結果表明原核表達的融合蛋白沒有生物活性,而畢赤酵母表達的融合蛋白由于N-端發生糖基化而具有生物功能。戴建華等[14]發現雞γ-干擾素基因在原核表達產物以包涵體形式存在并無抗病毒活性,而在真核細胞表達產物抗病毒效價卻很高。
4 結論
本研究在大腸桿菌中成功表達了4種來自瘤胃厭氧真菌的木聚糖酶基因,這4種酶具有良好的pH值和溫度穩定性,對山毛櫸木聚糖的親和力最高,Ca2+具有明顯的酶活促進作用。本研究獲得的4種木聚糖酶具有潛在的工業應用價值,為探索瘤胃中粗纖維降解資源提供參考。

