基于TCGA數(shù)據(jù)庫構建肝癌Ten-miRNAs風險評估模型及預后分析
陳俊光
(石河子大學 生命科學學院,新疆石河子 832003)
肝癌(Liver hepatocellular carcinoma,LIHC)是指發(fā)生于肝臟的原發(fā)性或者繼發(fā)性腫瘤。其中,起始于肝臟的癌癥稱為原發(fā)性肝癌,由起始位置不同分為4個類型:肝細胞癌、膽管細胞型肝癌、肝母細胞癌和血管內(nèi)皮瘤;由血液、淋巴系統(tǒng)轉移或者臨近腫瘤浸潤至肝臟產(chǎn)生的癌癥稱為繼發(fā)性肝癌,其患者數(shù)量是前者的三十余倍[1-2]。長期慢性炎癥、肝硬化和酗酒是導致原發(fā)性肝癌的主要因素,此外,代謝癥候群和血色沉著病患者等遺傳性因素也是肝癌的誘因[3-4]。肝癌患者存在明顯的地域分布差異,亞太地區(qū)患者數(shù)量遠高于歐美地區(qū),發(fā)病率和肝炎患者數(shù)量呈正相關[5-6]。肝癌還存在性別分布差異,男性患者數(shù)量高出女性40%,且男性患者死亡率有持續(xù)走高趨勢,而女性患者死亡率趨勢平緩[7]。肝癌是第三大癌癥致死類型,患者占所有癌癥患者的2.37%,多發(fā)現(xiàn)于晚期,死亡率一直居高不下,臨床治療多以侵入式治療為主。
MicroRNAs(miRNAs),又名小分子核糖核酸,是序列長度21~23 nt的非編碼小分子RNA,經(jīng)DNA轉錄后并未進一步翻譯成蛋白質(zhì),而是和mRNA的3'UTR部分或者完全互補配對結合,從而調(diào)控基因表達在細胞凋亡、分化和增殖上發(fā)揮著重要作用[8-9]。miRNAs在體內(nèi)發(fā)揮著類似抑癌基因和原癌基因的功能,但在腫瘤中常處于失調(diào)狀態(tài),因此miRNAs的異常水平表達和癌癥的發(fā)展以及預后密切相關[10-11]。miRNAs不僅可以作為精確預測、診斷和追蹤癌癥預后的生物標志物,而且在腫瘤的靶向藥物開發(fā)和化療方案選取上具有重要的參考價值。
本研究從TCGA(The Cancer Genome Atlas,TCGA)數(shù)據(jù)庫的肝癌樣本篩選出10個miRNA作為一個組合,利用風險評分(Risk score,RS)對患者進行生存分析,證實ten-miRNAs組合具有高靈敏度和高特異性,可以作為肝癌預后分析的生物標記物。
1 材料與方法
1.1 肝癌測序和臨床數(shù)據(jù)下載與整理
在R(V-4.0.0)環(huán)境下,使用RTCGA在TCGA數(shù)據(jù)庫下載LIHC全部亞型的臨床數(shù)據(jù)和miRNAs數(shù)據(jù)集。除LIHC外,TGCA還提供另外32種癌癥的臨床數(shù)據(jù)、RNA測序數(shù)據(jù)、DNA甲基化數(shù)據(jù)、DNA拷貝數(shù)變異數(shù)據(jù)和miRNAs測序數(shù)據(jù)等。所有數(shù)據(jù)來自374例肝癌組織和50例癌旁組織,共有1 046個miRNAs表達數(shù)據(jù)。使用EdgeR和Stringr包,篩選臨床數(shù)據(jù),過濾掉至少在3個樣本中CPM(count-permillion)≤1的miRNAs,使用TMM法對數(shù)據(jù)進行歸一處理,并設定閾值(FDR<0.05,fold change>2)。使用Gplots對篩選差異表達的miRNAs(Different Expression miRNAs,DEMs)進行熱圖繪制。
1.2 Cox單因素和多因素回歸分析
在R環(huán)境下,使用Survival包中Cox比例風險回歸模型(Cox's proportional hazards regression model)進行單因素回歸分析,得到偏回歸系數(shù)β、風險比(Hazard Ratio,HR)、P值等。
使用Survival包的Step函數(shù),將單因素回歸分析結果中影響患者生存的全部變量(P<0.05)作為Cox多因素回歸分析的單線變量進行Cox多因素回歸分析,采用雙向逐步遞歸法和wald卡方檢驗。
β>0,HR>1,說明該變量水平增加時,危險率增加,該變量是危險因素;β<0,HR<1,說明該變量水平增加時,危險率下降,該變量是保護因素;β=0,HR=1,說明該變量水平增加時,危險率不變,該變量是危險無關因素。P<0.05的因素視為預后的獨立影響因素。
1.3 預后相關miRNAs風險評分
在R環(huán)境下,使用Survival包的Predict函數(shù),根據(jù)公式(1)計算每一位患者的風險評分(Survival Risk Score,SRS)。以風險評分的中位數(shù)為臨界值,小于等于中位數(shù)的患者為低風險組,高于中位數(shù)的患者為高風險組。
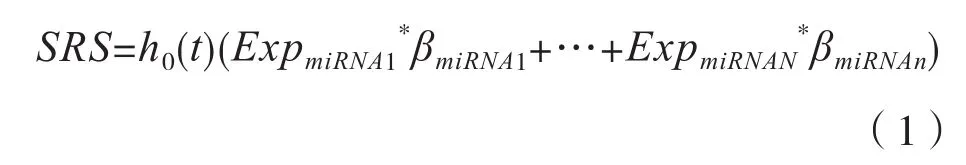
1.4 統(tǒng)計分析
使用R語言對數(shù)據(jù)進行統(tǒng)計學分析,數(shù)據(jù)表示為平均值±標準偏差(SD),統(tǒng)計學比較采用配對樣品t檢驗法,P<0.05被認為具有統(tǒng)計顯著性差異。
2 結果與分析
2.1 肝癌組織和癌旁組織的miRNAs差異表達分析
通過對TCGA數(shù)據(jù)庫的50個癌旁組織(對照組)和374個肝癌組織的miRNAs測序數(shù)據(jù)的分析,篩選肝癌中差異表達的miRNAs共247個,其中228個上調(diào),19個下調(diào)。圖1為424個樣本差異表達基因雙向分層聚類的熱圖,>0表示基因表達上調(diào),<0表示基因表達下調(diào)。
2.2 篩選肝癌患者差異表達和患者總生存相關的miRNAs
單因素Cox回歸分析結果顯示,247個DEMis中有23個miRNAs和患者的總體生存期(Overall survival,OS)顯著相關(P<0.05)(表1)。
2.3 建立與肝癌患者總生存相關的ten-miRNAs標記
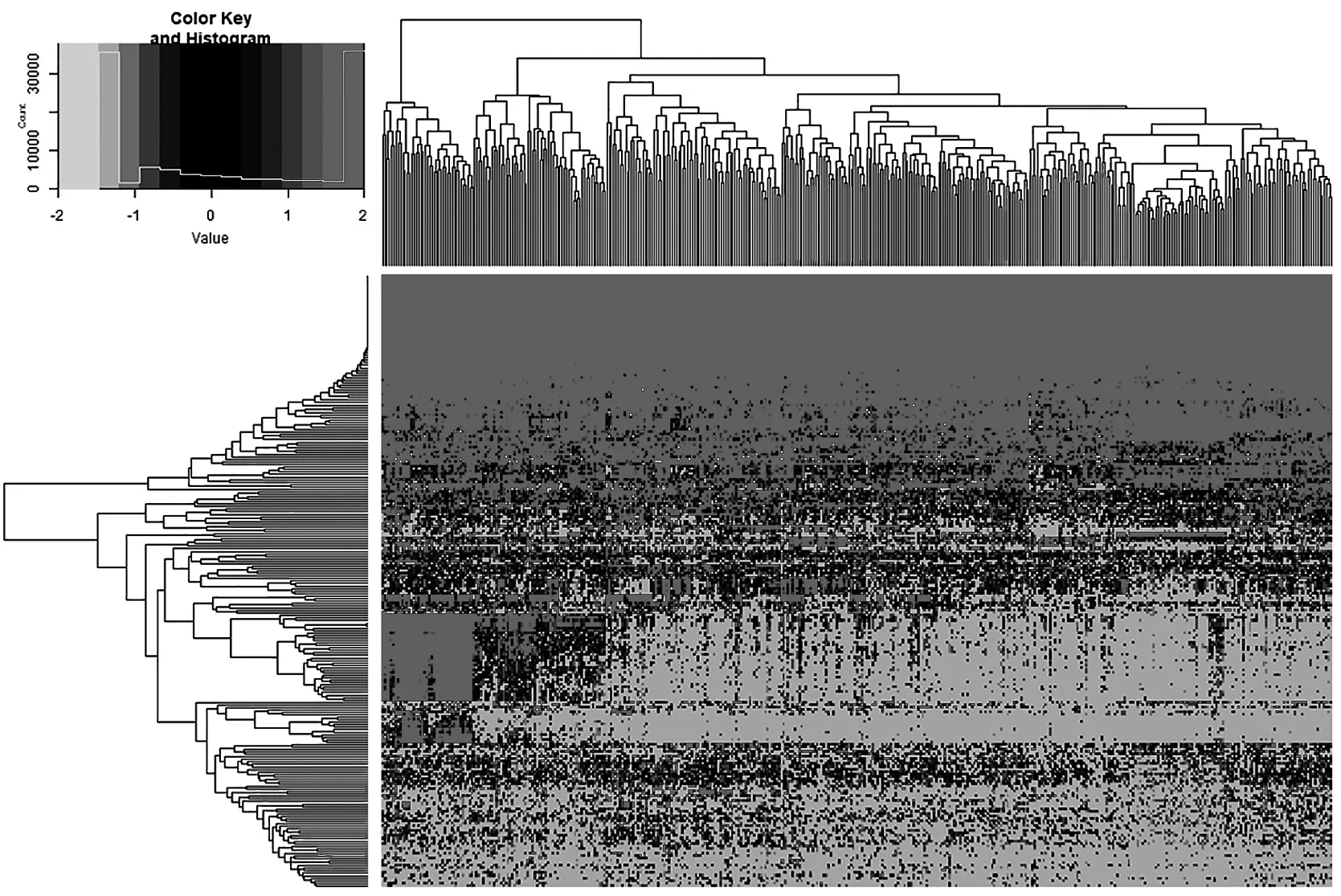
圖1 基因差異表達雙向分層聚類分析

表1 單因素Cox回歸分析結果
選擇逐步多元Cox回歸分析結果中前23個miRNAs中的10個建立預測模型。預測模型被定義為多因素Cox回歸分析中由相對系數(shù)加權的tenmiRNAs表達水平的線性組合,用方程表達如公式(2)所示。

風險分層和ROC曲線表明,ten-miRNAs標志物組合在預測肝癌患者總生存期方面表現(xiàn)出良好的準確性。如圖2所示,將研究中隨訪數(shù)據(jù)完整的340名患者進行生存風險評分,并根據(jù)中位數(shù)進行風險評分把患者分為高風險組(n=170)和低風險組(n=170)。如圖3所示,基于ten-miRNA的兩組Tekaplan-Meier總生存曲線顯著不同(log-rankP=0<0.001),高風險患者生存時間顯著降低,預后較差。如圖4所示,計算接收者操作特征曲線(Receiver operating characteristic curve,ROC)下部面積(Area under the Curve of ROC,AUC for ROC)對ten-miRNA特征的預后能力,評估結果顯示AUC=0.785,表明ten-miRNA特征模型在預測肝癌患者存活風險方面具有良好的準確度。

圖2 Ten-miRNAs組合熱圖

圖3 使用ten-miRNAs標志物用于肝癌患者的總生存期Kaplan-Meier生存曲線
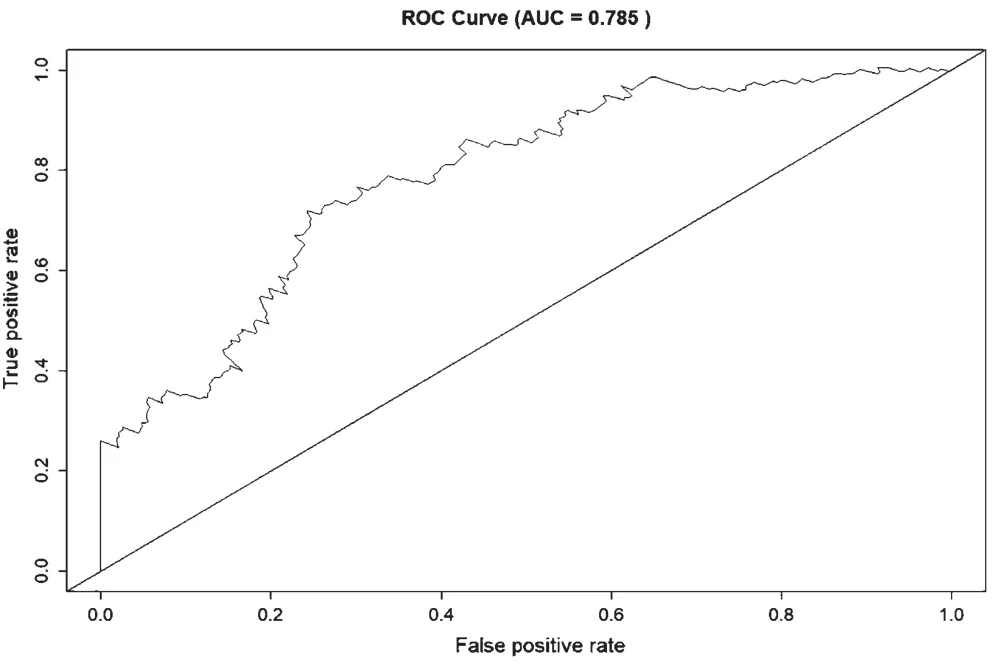
圖4 Ten-miRNAs標志物的ROC曲線分析
通過對TCGA數(shù)據(jù)庫中肝癌的臨床數(shù)據(jù)和miRNAs數(shù)據(jù)集進行數(shù)據(jù)挖掘,確定了一個tenmiRNA 組 合:hsa-mir-9-2、hsa-mir-506、hsamir-139、hsa-mir-3911、hsa-mir-548f-1、hsamir-326、hsa-mir-92a-1、hsa-mir-3171、hsamir-3614、hsa-mir-621。AUC評估顯示ROC曲線有著良好的特異性和敏感度,可以作為評估肝癌患者預后的生物標志物。
miR-9由 Hsa-mir-9-1、Hsa-mir-9-2、Hsamir-9-3編碼,最初被認為是促進神經(jīng)元增生的神經(jīng)發(fā)育調(diào)控因子,后在各種惡性腫瘤中被觀察到異常表達,干擾正常細胞途徑促使癌變,并且顯示出功能多樣性[12-13]。hsa-mir-548f-1所屬的hsa-mir-548家族是轉座子衍生物,是癌癥的全局調(diào)控基因。上調(diào)會對控制細胞正常增殖的基因產(chǎn)生抑制,使細胞周期脫離正常調(diào)控,同時下調(diào)免疫細胞受體基因、轉錄因子和腫瘤壞死因子的編碼基因[14]。hsa-mir-506、hsa-mir-139、hsa-mir-326、hsa-mir-92a-1、hsamir-621分別在乳腺癌、結腸癌、神經(jīng)膠質(zhì)瘤等癌癥患者體內(nèi)發(fā)揮著抑癌基因的作用,下調(diào)FGF1、NOB1等原癌基因,抑制相關腫瘤細胞的黏附、增殖、浸潤和轉移,將細胞周期阻滯在G1期(DNA合成前的時期),促使細胞凋亡,并增加癌變細胞對紫杉醇和卡鉑(PTX/CBP)等化療的敏感性[15-20]。其中,hsamir-139已被認為是多種癌癥的腫瘤抑制因子以及癌癥早期診斷和預后的生物標志物,hsa-mir-92a-1是miR-17~92致癌基因群成員,在轉錄后發(fā)揮調(diào)控作用[21-23]。hsa-mir-3911、hsa-mir-3171、hsa-mir-3614還未有和癌癥基因間相互作用的報道。其中,hsamir-3911僅在心臟損傷早期預測中被鑒定為異常表達,且僅存在于外排體中;hsa-mir-3171被確定為乳腺癌預后標記物,但作用機制尚未闡明;hsamir-3614為病毒的防御基因,抑制病毒的感染性并抑制病毒復制[24-27]。
3 結語
本研究構建的ten-miRNAs組合在作為肝癌預后預測模型上表現(xiàn)出良好的準確性,可以作為預測肝癌患者預后的生物標志物,hsa-mir-3911、hsamir-3171、hsa-mir-3614各自的具體功能和實際臨床價值還需要在細胞水平上進一步驗證。

