甜瓜細菌性果斑病帶菌種子的處理方法研究
李菊芬,林 濤,馬國斌
(上海市農業科學院設施園藝研究所,上海市設施園藝技術重點實驗室,上海201106)
細菌性果斑病(Bacteiral fruit blotch,簡稱BFB)是一種嚴重危害葫蘆科植物的世界性病害[1-3],是影響瓜類生產的主要病害之一,其病原為嗜酸菌屬西瓜種(Acidovoras citrulli)[4-5]。 由于細菌性果斑病菌是典型的種傳細菌性病害[6-7],如不及時進行檢測和滅菌處理,種子生產經營者和瓜農將面臨遭受經濟損失的風險。 建立快速、準確的檢測方法和行之有效的滅菌處理方法是防控此病的重要手段。 目前,PCR 技術[8-13]、血清學檢測技術[14]已廣泛應用于細菌性果斑病菌的檢測,但在種子處理方面尚缺乏有效的防治藥劑[15]。 本試驗以在新疆繁育的攜帶瓜類細菌性果斑病菌的甜瓜種子為材料,分別進行70 ℃、75 ℃、80 ℃干熱滅菌、包衣和70 ℃干熱滅菌+包衣5 種不同的滅菌處理,采用本實驗室前期建立的PCR 體系和實時定量PCR 方法分別對處理后的甜瓜種子帶菌情況進行檢測,并在此基礎上進行活菌分離鑒定,旨在探索一種既不影響種子發芽率,又能有效殺滅種帶細菌性果斑病菌的最佳處理方式,為甜瓜種子的生產和流通提供技術參考。
1 材料與方法
1.1 材料
供試甜瓜(Cucumis meloL.)種子:在新疆繁育的攜帶瓜類細菌性果斑病菌的‘東方蜜1 號’甜瓜種子。 供試菌株:由中國農業科學院鄭州果樹所提供的細菌性果斑病標準菌株(Acidovoras avenaesubsp.citrulli)。
1.2 方法
1.2.1 帶菌種子的不同處理方法
將帶菌的供試甜瓜種子隨機分成6 組,每組2 kg,以其中1 組種子為對照(CK),其他5 組分別進行如下5 種不同處理。 處理1:40 ℃處理2 d,50 ℃處理1 d,70 ℃處理3 d,50 ℃處理1 d,40 ℃處理1 d。 處理2:40 ℃處理2 d,50 ℃處理1 d,75 ℃處理3 d,50 ℃處理1 d,40 ℃處理1 d。 處理3:40 ℃處理2 d,50 ℃處理1 d,80 ℃處理3 d,50 ℃處理1 d,40 ℃處理1 d。 處理4:包衣處理(包衣劑為衛福,有效成分為萎銹靈200 g∕L、福美雙200 g∕L)。 處理5:處理1 +處理4。
1.2.2 PCR 檢測
5 種處理和對照各取300 粒種子放入滅菌三角瓶中,加入30 mL 無菌雙蒸水,置于28 ℃下200 r∕min振蕩培養3 h,取1 μL 懸浮液作為PCR 模板。 選用特異引物BX-L1∕BX-S-R2(BX-L1:5’-CAGCTGGGAGCGATCTTCAT-3’;BX-S-R2:5’-GCGTCAGGAGGGTGAGTAGCA-3’)[9]進行PCR 擴增,引物由上海生工生物工程股份有限公司合成。 每種處理3 個重復。 普通PCR 所需試劑均購于天根生化技術有限公司。PCR 反應體系(25 μL):10 ×buffer 2.5 μL,MgCl22 mmol∕L,dNTPs 0.2 mmol∕L,Taq DNA 聚合酶1 U,正反向引物各0.2 μmol∕L,模板為1 μL 浸提液,無菌三蒸水補齊。 擴增條件:95 ℃3 min;94 ℃35 s,60 ℃35 s,72 ℃45 s,35 個循環; 72 ℃7 min。 PCR 儀為BIO-Rad T100TMThermal Cycler。 擴增產物經1%瓊脂糖凝膠電泳,Goldview 染液染色后,于紫外凝膠成像系統(Tanon 3500)下觀察并拍照。
1.2.3 實時定量PCR 檢測
熒光染料為Takara 公司的SYBR green 定量PCR 染料,儀器為Bio-Rad CFX96TMReal-Time PCR System,反應體系按照Takara SYBR?Premix Ex TaqTM說明書進行,擴增程序采用Bio-Rad CFX 熒光定量PCR 儀默認程序,即:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 個循環,每個循環結束時收集熒光信號。 每個反應設置3 個重復,以對照作為參比,采用相對定量(ΔCT 法)的方法計算出各處理與CK 的CT 值之差(ΔCT),以2-ΔCT計算所得的值即為各處理的相對帶菌量。
1.2.4 活菌分離檢測
取CK 和各處理種子的懸浮液100 μL,于KB 固體培養基上均勻涂板,置于28 ℃恒溫培養箱中倒置培養48 h,觀察菌落生長情況。 每處理設3 皿重復。
1.2.4.1 選擇性KB 平板的制備及涂板
選擇性KB 培養基:蛋白胨20 g∕L,丙三醇10 mL∕L,MgSO4·7H2O 1.5 g∕L,K2HPO41.5 g∕L,瓊脂15 g∕L,pH 調至7.0,121 ℃滅菌20 min,冷卻至50 ℃時加入氨芐青霉素20 mg∕L、新生霉素5 mg∕L、放線菌酮25 mg∕L。 取CK 和5 種處理種子的懸浮液100 μL,于選擇性KB 培養基上均勻涂板,置于28 ℃溫箱中恒溫倒置培養48 h,觀察菌落生長情況。
1.2.4.2 總菌落DNA 提取及PCR 檢測用無菌水沖洗選擇性KB 培養基表面上分離培養的所有細菌菌落,離心濃縮,提取細菌的基因組DNA[16],并以此為模板,進行PCR 擴增驗證。 反應體系及擴增程序同1.2.2。
1.2.4.3 不同濃度細菌性果斑病菌懸浮液的制備及涂板
挑取細菌性果斑病標準菌株于液體KB 培養基中,28 ℃振蕩培養過夜,離心收集菌體,1 mL 無菌水吹打至懸浮狀態,根據OD600值分別配成2 ×104cfu∕mL、2 ×103cfu∕mL、2 ×102cfu∕mL 3 個濃度梯度,分別在選擇性KB 培養基和KB 培養基上進行涂板,每個濃度重復3 皿。 觀察選擇性KB 培養基對細菌性果斑病菌生長的影響。
1.2.5 不同處理對種子發芽的影響
取CK 和不同處理種子各100 粒,浸泡12 h,置于28 ℃恒溫培養箱中催芽24 h,統計發芽率、根長,以此判定各處理對種子發芽的影響,3 次重復。
2 結果與分析
2.1 PCR 與實時定量PCR 檢測
PCR 檢測結果顯示(圖1):CK 和處理1—4 均可擴增出特異性目的條帶(279 bp),但條帶亮度有所差異,其中CK 最亮,處理4(包衣處理)的條帶亮度最淡。 處理5(70 ℃高溫處理+包衣處理)未擴增出目的條帶。
實時定量PCR 檢測結果顯示(圖2):與CK 相比,處理1—4 的種子相對帶菌量均有不同程度的降低,且呈遞減趨勢,處理4 的種子相對帶菌量降幅最為明顯;處理5 基本檢測不到帶菌。
上述結果表明:帶菌甜瓜種子經5 種處理后,種子帶菌量均有所下降,其中以70 ℃高溫+包衣處理的殺菌效果最佳。
2.2 活菌分離檢測
2.2.1 KB 和選擇性KB 培養基的涂板及總菌落DNA 的PCR 檢測
不同處理的種子懸浮液在KB 培養基上涂板,經28 ℃恒溫培養48 h 后,各處理和CK 均有菌落長出,其中以CK 長出的菌落最為密集,處理1 次之;處理2—5 的菌落總數雖相對較少,但雜菌生長旺盛(圖3A)。 由于雜菌量過多,且生長速度較細菌性果斑病菌快,嚴重影響了總菌落DNA 的PCR 檢測結果,因此,選用優化的選擇性KB 培養基進行后續試驗。
選擇性KB 培養基的涂板結果表明(圖3B):只有CK 和處理1 有菌落長出,處理2—5 均無菌落長出。 提取CK 和處理1 的總菌落DNA 進行PCR 檢測表明(圖4):二者均能擴增出目的條帶(279 bp)。
2.2.2 選擇性KB 培養基對果斑病菌生長的影響
將細菌性果斑病菌標準菌株懸浮液稀釋成2 ×104cfu∕mL 至2 ×102cfu∕mL 3 個10 倍濃度梯度,分別在KB 和選擇性KB 培養基上涂板,結果表明:細菌性果斑病病菌在KB 和選擇性KB 培養基上長出的菌落生長速度一致,數量相當,且菌落數目呈梯度變化,說明選擇性KB 培養基對細菌性果斑病標準菌株的生長無影響(圖5)。
2.3 不同處理對種子萌發的影響
由表1 可知:處理3 對種子發芽率的影響較為明顯,發芽率僅為87%,CK 和其他4 種處理的發芽率均在90%以上。 處理1 和處理4 的種子平均根長較CK 增長顯著,處理5 與CK 無顯著差異,而處理2 和處理3 的種子根長生長卻受到明顯抑制。
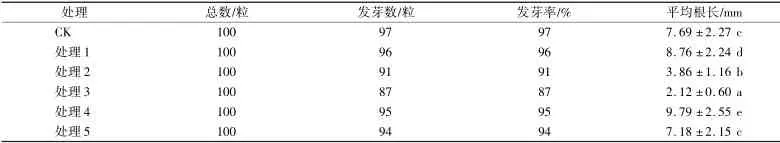
表1 不同處理對種子發芽的影響Table 1 Effects of different treatments on seed germination
3 結論與討論
PCR 和實時定量PCR 檢測結果表明:除處理5 外,CK 和處理1—4 均能檢測到細菌性果斑病菌,但帶菌程度不同,帶菌量呈遞減趨勢。 用選擇性KB 培養基進行涂板,可在很大程度上抑制雜菌的生長,但對細菌性果斑病菌的生長無明顯影響。 活菌分離試驗表明,只有CK 和處理1 的種子上能分離到細菌性果斑病菌。 發芽試驗表明,只有處理2 和處理3 對種子的萌發和生長有抑制作用。 綜合試驗結果,處理5(70 ℃高溫+包衣)既不影響種子發芽,又可有效殺滅細菌性果斑病菌,效果最佳。
另外,雖然處理2—4 的種子PCR 和熒光定量PCR 檢測結果均顯示陽性,但均未分離到活的細菌性果斑病菌。 究其原因,可能是帶菌種子經過這3 種方式處理后,其攜帶的細菌性果斑病菌已被殺滅,但仍存在不同程度的DNA 殘留,PCR 和熒光定量PCR 以殘留的DNA 為模板進行擴增,所以呈現陽性結果。因此,在種子細菌性果斑病菌的檢驗檢疫過程中,除了常規的PCR 檢測或者血清學檢測方法外,還應進行活菌分離或生長法來檢測種子的帶菌情況,這樣檢測的結果才更加準確可靠。

