MassARRAY質譜分析腦膠質瘤6個基因11個突變位點的方法建立與應用
趙煥英 隋雷鳴 王俐勇 付文卓 趙君朋
(首都醫科大學中心實驗室基因組學研究平臺,北京 100069)
腦膠質瘤是中樞神經系統最常見的惡性腫瘤,每年新發病例超越14000例。近幾年,腦瘤分子標記物檢測逐漸得到重視和開展,并為疾病診斷、預后的估判、及治療方法選取提供有力信息支持,極大推進了原有的單純組織病理學分類方法。其中膠質瘤相關基因中異檸檬酸脫氫酶1(Isocitrate dehydrogenase 1,IDH1)、異檸檬酸脫氫酶2(Isocitrate dehydrogenase 2,IDH2)基因突變易發生在年輕膠質瘤患者、少突膠質細胞瘤及混合性膠質瘤,IDH1/2突變的患者預后相對較好[1-3]。組蛋白h3.3和h3.1基因(H3F3A和HIST1H3B)的點突變在小兒彌漫性中線膠質瘤中發生率高達80%,其中在小兒彌漫性高級星形細胞瘤中,組蛋白H3.3基因H3F3A K27M 突變率高于 G34R/V,H3K27M 突變治療反應差,生存率低,因此K27M分子可作為鑒別診斷的標準分子之一[4-6]。BRAFV600E和TERT啟動子區域突變常分別在低分級和高分級別神經膠質瘤中發生[7],BRAFV600E突變在上皮樣膠質母細胞瘤中占比達50%,而在其他類型神經母細胞中極少有BRAF的突變,BRAF突變腫瘤侵襲性強,同時也可望成為治療的靶點[8]。TERT啟動子突變是最常見的單基因成人彌漫性膠質瘤的突變類型,TERT啟動子區-124和-146位點常發生C228T和C250T突變類型,對膠質瘤亞型分類有高度特異性,是彌漫性膠質瘤的診斷指標[9]。通過文獻查閱,針對以上突變位點的檢測,通常采用免疫組化、一代測序及焦磷酸測序的方法,時間長,成本貴。本實驗旨在建立MassARRAY 質譜分析方法同時檢測這些位點,為疾病的診斷和治療提供可行性信息。
1 實驗材料與方法
(1)實驗材料:
40例人腦膠質瘤石蠟組織包埋標本,正常人外周血液樣本為陰性對照,生理鹽水空白對照。
(2)主要試劑與儀器:
蛋白酶K(Merk),核酸提取試劑盒、Lab-Aid 824核酸提取自動提取儀(廈門至善生物科技有限公司);紫外分光光度計(IMPLEN);QIAxcel Advanced 毛細管電泳儀(Qiagen);一代測序儀3730(ThermoFisher);聚合酶鏈式反應試劑盒、MassARRAY清潔樹脂、iPLEX Pro Reagent Kit、MassARRAY Analyzer 4 System 384cpm質譜分析儀(Agena);振蕩混懸儀(Eppendorf);Allegra 25R臺式冷凍離心機(Beckman);LightCycler480熒光定量PCR儀(Roche)。
2 實驗方法
2.1 石蠟樣本DNA提取
石蠟樣本經二甲苯脫蠟處理后行蛋白酶K 消化至液體狀,于Lab-Aid 824儀器上進行核酸自動提取,方法參見文獻[10]。
2.2 6個基因11位點的檢測引物準備
通過檢索Pubmed 數據庫,結合國內外研究進展,統計膠質瘤相關基因突變位點,確定6個候選基因11個位點如下:IDH1-132(rs121913500)、IDH2-172(rs121913503)、IDH2-140(rs121913502)、TERT(-245,rs2853669)、TERT(-124)、TERT(-146)、H3.1-27、H3.3-27(rs1057519902)、H3.3-34(rs1057519903)、H3.3-33、BRAF-600。gene數據庫中下載6個基因組序列,標注目的突變位點,選取突變位點前后約200bp堿基序列,編輯引物設計文檔。利用Agena BioScience軟件設計擴增引物8對,位點延伸引物11條,延伸引物設計位于突變位點前一個堿基,與擴增產物互補進行單堿基延伸反應,見表1。根據延伸引物及后續單堿基分子量不同,把11個檢測位點分成2組見表2,每組分別配置每條引物濃度為0.5 μmol·L-1多重PCR反應的混合引物。
2.3 MassARRY反應體系
a)多重PCR反應:每個樣品配置反應體系5 μL,其中濃度為10×PCR緩沖液0.5μL、MgCl2(25 mmol·L-1)0.4 μL、dNTPs(25 mmol·L-1)0.1 μL、PCR 熱啟動酶(5 U·μL-1)0.2 μL、擴增引物混合液1μL、基因組DNA(10 ng·μL-1)1μL,超純水補足至5μL。在兼容384孔板的PCR儀上,進行擴增反應。PCR反應條件:95℃預變性2 min;95℃20 s,56℃30 s,72℃ 60 s,共45個循環:72℃再延伸3 min。
b)PCR產物堿性磷酸酶(SAP)處理:PCR反應結束,向384 孔反應孔中加入2μl SAP 反應混合液,密封反應孔,于PCR儀上運行程序:37℃ 40 min,85℃ 10min。
c)單堿基延伸反應:在384 孔中加入2μL 單堿基延伸混合液及引物,進行單堿基延伸反應,反應條件為:94℃ 10min;94℃30 s,56℃30s,72℃1 min,72℃3 min;4℃保存。
2.4 質譜檢測及分析
在384 孔中加入16μL 去離子水與6mg樹脂,按操作說明書進行脫鹽處理;后利用MassARRAY Nanodispenser RS 1000點樣儀轉移至384孔芯片上,自然干燥后上機,運行MALDI-TOF質譜程序,采用MassARRAY TYPER4.1軟件(Agena)進行基因型判讀。
3 結果與討論
3.1 多重PCR引物的篩選
MassARRAY原理為基質輔助激光解吸電離飛行時間質譜(MALDI-TOF MS)技術。主要特點是:PCR擴增后的產物,加入SNP序列特異延伸引物,在 SNP 位點上,延伸 1個堿基。然后將制備的樣品分析物與芯片基質共結晶,后置入質譜儀的真空管,于瞬時納秒(10-9s)強激光激發,基質分子經輻射吸收能量,使基質晶體升華,核酸分子就會解吸附并轉變為亞穩態電荷離子,離子在加速電場中獲動能,按照其質荷比率加以分離,離子飛行時間與離子質量成反比。通過檢測離子在真空管飛行到檢測器的時間精確物質分子量,從而檢測出SNP位點信息,基于飛行管長度限制,MassARRAY SNP 檢測的分子量范圍為5000~8500 Dalton。檢測基于多重PCR方法,一管反應體系中引物數量多,這要求引物間避免互補,尤其需絕對避免延伸引物3’端與其他引物有超過3個堿基的互補。否則易造成非特異延伸,出現錯誤檢測結果。為了保證PCR擴增效率,PCR擴增產物長度一般不超200bp,還需遵循其他PCR引物設計原則(避免形成二聚體/錯配等)[11]。利用Agena BioScience軟件篩選出的8對擴增引物,擴增片段長度在71bp~121bp之間,如表1。引物前端添加與人類基因無關的標簽序列ACGTTGGATG,目的增加引物分子量使其大于8500Da,超過質譜檢測限,避免對延伸引物及產物產生干擾。

表1 6個基因的11個待檢位點的擴增引物序列信息
3.2 延伸引物及分子量范圍
根據延伸引物及延伸一個堿基后分子量不同,基質輔助激光解吸后電離飛行到檢測器的時間不同,分子質量小的先到達,質譜峰先出現。11個位點的延伸引物信息如表2,第1組5個位點組合,分子量范圍為4844.2Da~7923Da;第2組6個位點組合,分子量范圍為4833.1Da~8367.3Da。
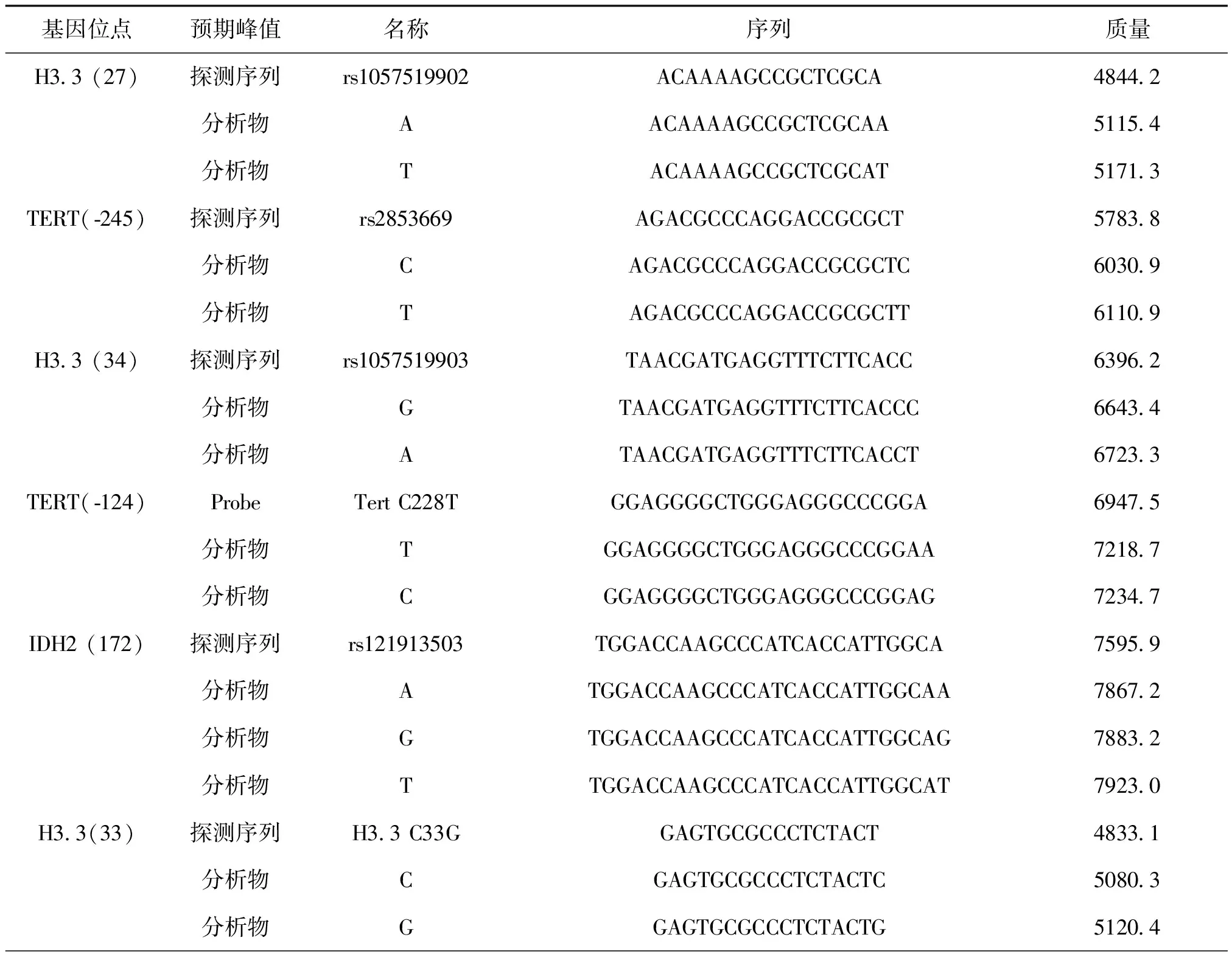
表2 11個待檢位點的延伸引物及產物序列信息
3.3 兩組突變位點的質譜檢測
每個樣品經過兩組多重PCR擴增及延伸反應后,分別在芯片上進行點樣,激光解吸后電離。圖1是第1組前5個位點的質譜分離圖,可以看出延伸后的分子量從5115.4Da~7923Da 之間;圖2是第2組后6個位點質譜分離圖,分子量在5080.3Da~8367.3Da區域。在質譜圖上,每種顏色區域是一個基因位點的檢測區域,根據出現的野生型和突變型的峰面積數據,能夠定量判讀突變比率。
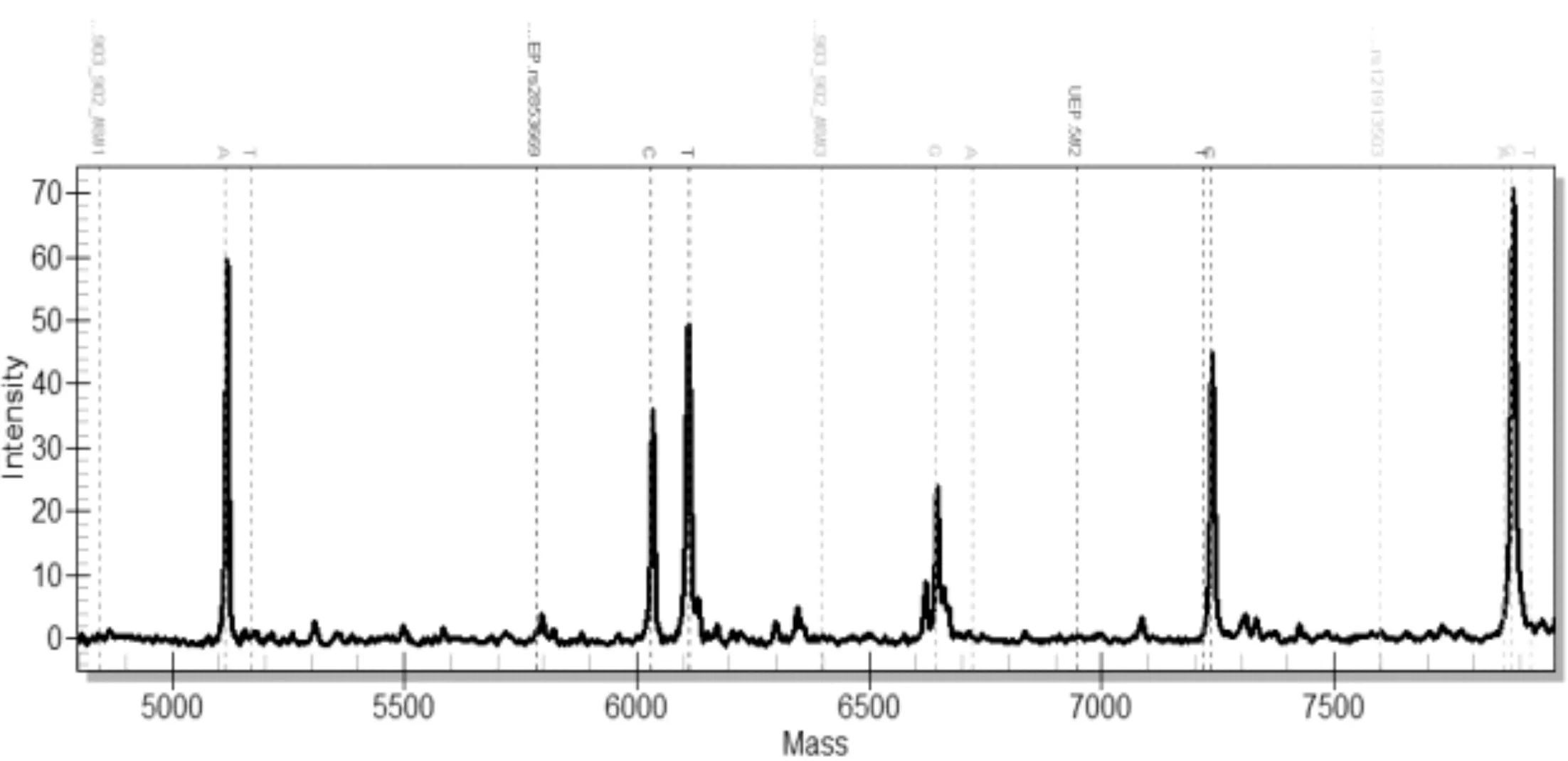
圖1 前5個基因突變位點的質譜圖型
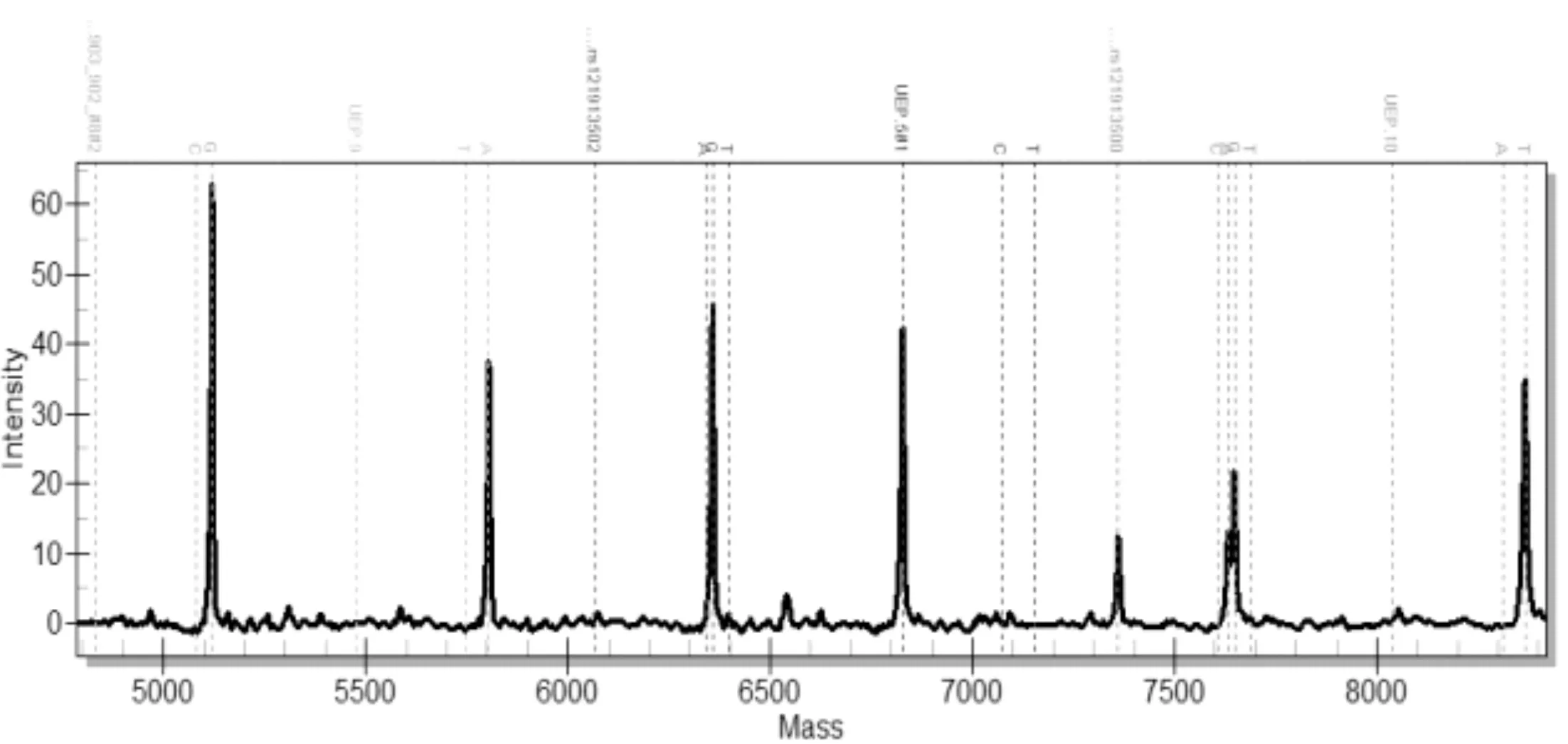
圖2 后6個基因突變位點質譜圖型
3.4 與一代測序結果比較
一代測序技術是熒光標記測序法,儀器通過檢測ddNTP上的熒光來讀取所測序列,熒光染料會干擾測序引物相鄰的幾十個堿基信號,導致無法讀出序列,加之引物本身不含熒光,都是沒信號的部分,這也要求設計引物時引物序列需距檢測的目標位點最少60bp以上;且測序前需純化回收PCR片段,為了保證回收效率,擴增的PCR片段長度不易低于200bp。與MassArray技術不同,引物前無需加標簽序列,其他仍需遵循引物設計原則。兩種技術檢測結果見表3,突變位點檢測一致率為96.4%,有2例樣本1號和2號分別在H3.3和IDH1兩個指標檢測中結果不一致。如圖3、圖4是1號樣本兩種方法檢測結果,從質譜圖上可見H3.3(27)這個位點發生了A/T突變,分子量在5171.3處的T峰面積約為13,分子量5114.4處的A峰面積約為125;而圖4一代測序所示無突變。同樣圖5、圖6是2號樣本檢測結果,圖5 質譜圖上顯示IDH1(132)位發生A/G堿基突變,A峰面積約84,G峰面積324,根據峰面積可計算突變比率;圖6箭頭所示背景峰高,無法判斷是否發生突變。表4示40例樣本在IDH1和H3.3兩個位點檢測結果比較,可知MassARRAY靈敏度能達100%,與一代測序檢測的真陰性數據相比62/64,特異度約97%。造成這種差異的原因與一代測序技術靈敏度低,大于20%以上的突變才能被檢測到有關[12]。測序反應的信號強弱除與模板量有關,還與同一位置不同堿基信號強度不同有關;這會導致即使突變的模板所占的比例較高時,也不一定能準確檢測到突變的存在。另外,測序儀軟件對掃描結果處理時,一般會將信號弱的峰做為背景信號處理,進一步壓低弱的峰,提高主峰,因此對低含量的突變不易檢測,高含量突變檢測到也不能定量判讀。且高GC、重復序列,復雜二級結構的DNA片段對一代測序是個巨大挑戰,普通PCR條件很難擴增出單一目的條帶,需利用高效熱啟動酶,梯度PCR程序及多對引物優化才能擴增出目的條帶[13,14],測序時需添加變性劑優化測序信號。質譜方法中因擴增的PCR片段短,可避開一些復雜二級結構;延伸引物只需延伸一個堿基后進行質譜鑒定其分子量。另外 MassARRAY 系統反應體系為非雜交依賴性,不存在潛在的雜交錯配干擾,無需各種標記。與芯片技術和質譜技術結合,使得它具備高度特異性、靈敏度和高精確度[15]。能夠以快速精確的進行基因型識別,直接測出帶有SNP 或其他突變的目標DNA[16]。
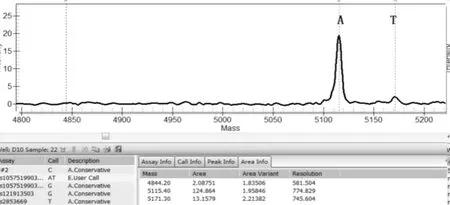
圖3 MassARRAY檢測1號樣本H3.3-27位點A/T 突變
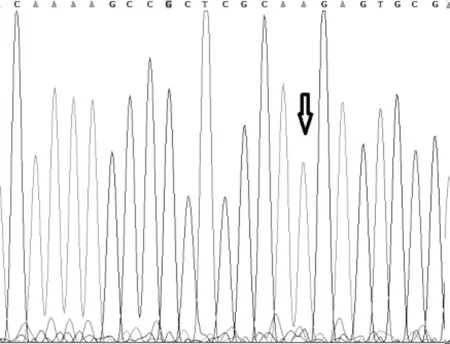
圖4 一代測序檢測1號樣本H3.3-27位點的結果
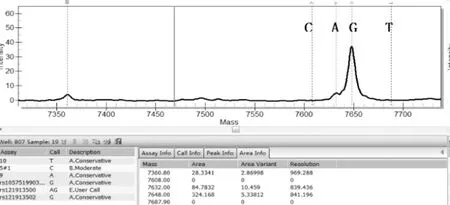
圖5 MassARRAY 檢測到的2號樣本IDH1-132位點A/G突變
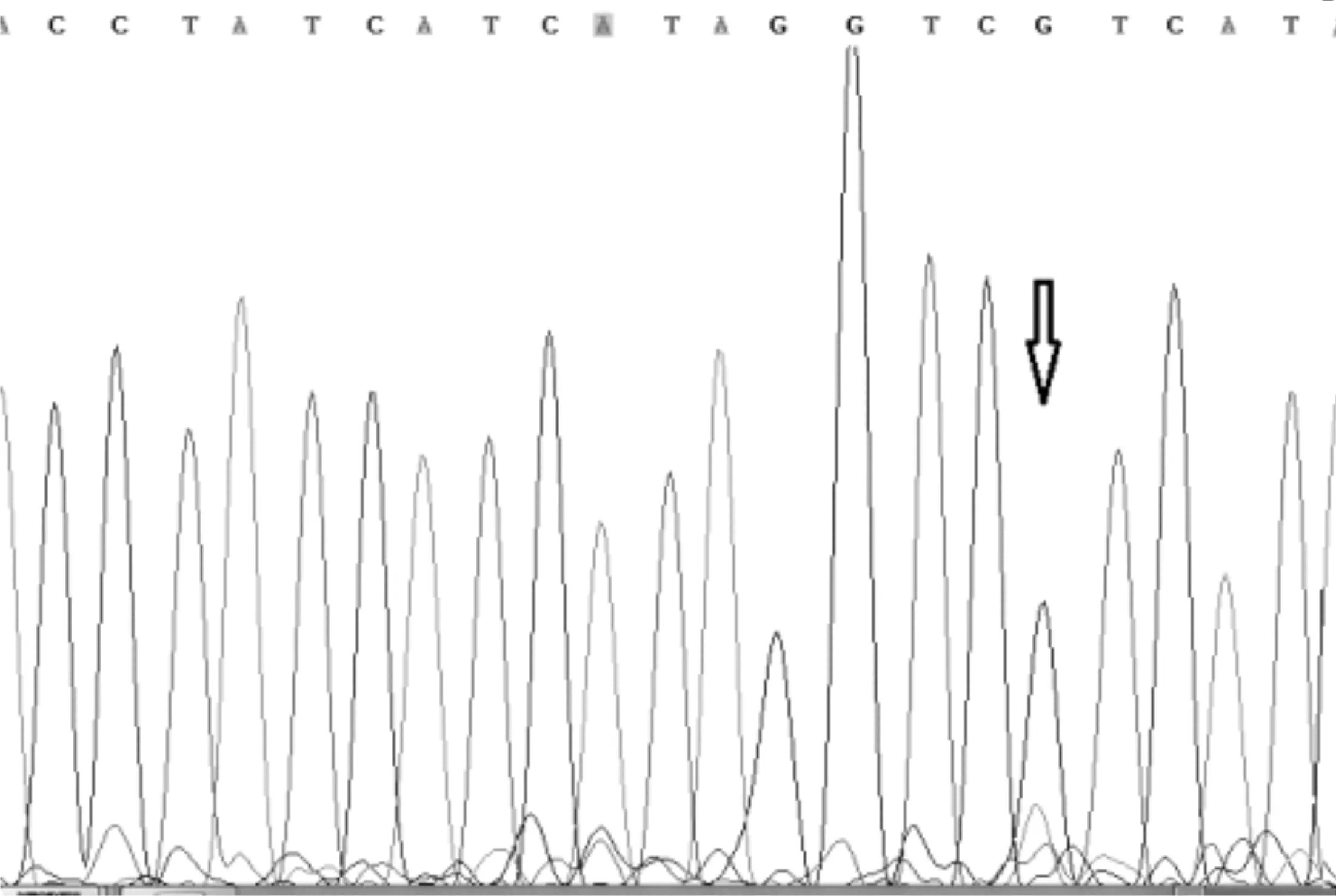
圖6 一代測序檢測2號樣本IDH1-132結果
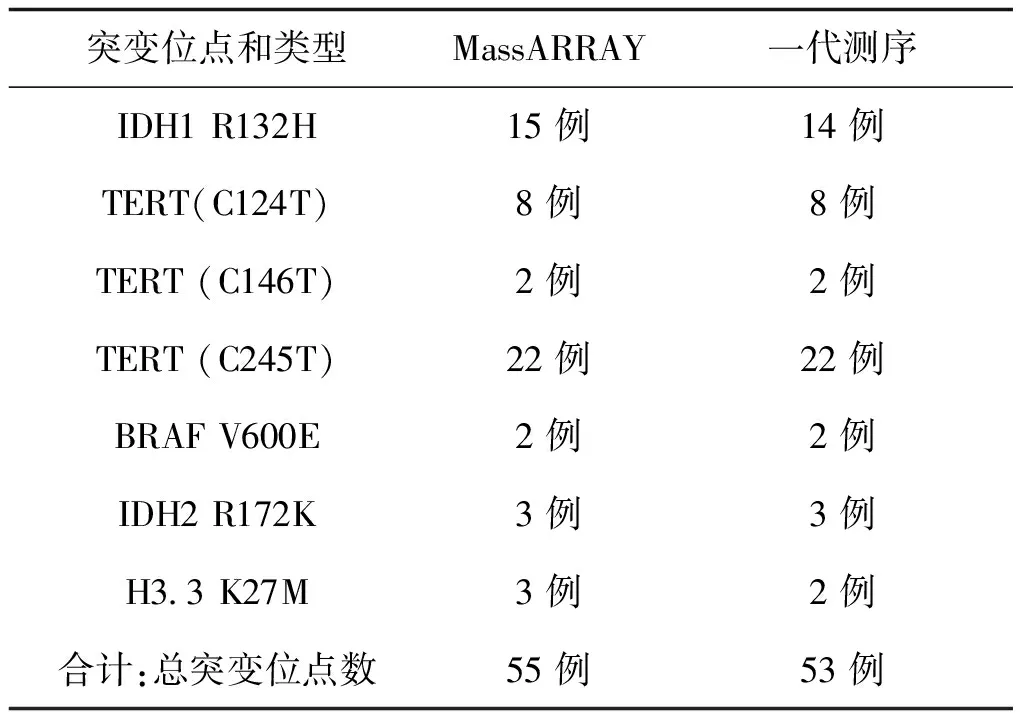
表3 MassARRAY 和一代測序對40例樣本檢測結果
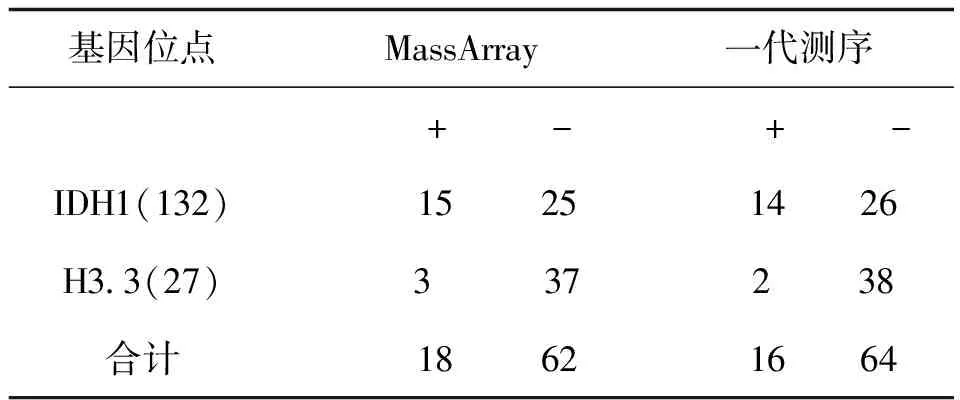
表4 40例樣本IDH1和H3.3 兩種測方法比較
4 結論
目前腦膠質瘤的病理分級和分型,常采用的是免疫組化或一代測序方法進行突變檢測;在臨床基因檢測方面,因多個單基因分次檢測的復雜性和穿刺等來源標本總量不足,成為多基因同時檢測的限制因素。基于二代測序平臺的高通量檢測也因建庫、測序及分析等專業化及價格貴還不能普及應用于臨床檢測。MassARRY技術通過擴增延伸反映與質譜技術結合,只需10ng DNA 樣本可理論上就可實現多達40個基因同時檢測,無需熒光標記;而一代測序需要每個基因單獨擴增,極大增加了檢測樣本量和成本。MassARRY在定量分析基因突變檢測中檢測基因數量,除受基因分子量影響,也受PCR擴增引物及引物增加的多個堿基前綴影響,尚需多次嘗試多對引物組合,建立合適的基因配伍檢測集合。

