新型“磁包金”金磁納米粒子免疫層析試紙條定量檢測血清中的人絨毛膜促性腺激素
張燚 郝良文 沈軒昂 江湖 黃小林 熊勇華
摘 要 將油酸修飾的氧化鐵納米粒子(Oleic acid coated iron oxide nanoparticles, OC-IONPs)與油胺修飾的金納米粒子(Oleylamine-coated gold nanoparticles, OA-AuNPs)通過乳液自組裝法共封裝在聚合物基質中, 合成了具有“磁包金”核殼異質結構的新型金磁納米粒子(Magnetic coated gold nanoparticles, MGNPs)。由于OA-AuNPs聚集在內核, OC-IONPs分布于外殼, 有效避免了OA-AuNPs的磁屏蔽效應, 相較于傳統“金包磁”型納米結構, 此MGNPs具有高的磁飽和強度(為初始氧化鐵納米粒子的80%)和強的吸光度(為傳統30 nm膠體金納米粒子的12.5倍)。進一步以此MGNPs為免疫層析(Immunochromatographic assay, ICA)的新型雙功能標記探針, 以人絨毛膜促性腺激素(Human chorionic gonadotropin, HCG)為模型檢測物, 建立了高靈敏檢測人血清中HCG的免疫層析方法(MGNPs-ICA)。本研究所構建的試紙條定量檢測人血清中HCG的線性范圍為0.97~250 mIU/mL(y=0.2561lnx-0.0429, R2=0.9816), 檢出限為0.97 mIU/mL; 試紙條的批內及批間回收率為93.7%~109.1%, 相對標準偏差小于14.3%; 特異性實驗結果表明, 本方法僅對目標物HCG有顯著的信號響應。本方法檢測結果與化學發光免疫分析(Chemiluminescence immunoassay, CLIA)結果具有較好的一致性(y=1.11x + 14.71, R2=0.958), 但在檢測時間、成本和便攜性方面具有明顯優勢。本研究合成的MGNPs具有優異的磁學性能和良好的光學傳感性能, 能夠顯著改善免疫層析平臺的檢測性能。
關鍵詞 磁包金納米粒子; 免疫層析試紙條; 人絨毛膜促性腺激素; 定量檢測
1 引 言
生物標記物是客觀評估生物過程、致病過程或治療干預的重要指標[1,2]。定性和定量檢測血液和尿液等體液中的生物標記物對疾病臨床診斷具有重要的意義[3,4]。膠體金免疫層析技術(Gold nanoparticle based immunochromatographic assay, AuNP-ICA)結合了免疫標記與層析技術的優勢, 具有檢測速度快、操作簡單及價格低廉等優點, 是目前臨床上應用最為廣泛的即時檢測技術之一[5~7]。但是, 該方法對于檢測成分復雜的樣本, 常會因樣品的基質干擾問題, 導致檢測的靈敏度及準確性下降, 甚至出現假陰性或假陽性的結果。免疫磁分離技術(Immuno-magnetic separation, IMS)通過磁介導的方式可以從復雜基質中分離和濃縮目標分析物, 顯著提高ICA方法的檢測靈敏度和準確性[8,9]。但是, 傳統的磁性納米粒子(Magnetic nanoparticles, MNPs)的摩爾消光系數遠低于AuNPs的摩爾消光系數, 難以提高ICA的檢測靈敏度。
金磁雙功能納米材料由于兼具MNPs以及AuNPs磁、光雙重優勢, 近年來被廣泛應用于生物標記、生物成像、生物分離以及檢測等領域[10~12]。其中基于金磁納米材料的ICA已廣泛應用于多種分析物檢測, 如沙門氏菌[13]、黃曲霉毒素B2[14]、寡核苷酸多態性[15]、磺胺二甲嘧啶[16]等。然而, 上述金磁納米材料多呈“金包磁”的納米結構。該類材料因AuNPs的強磁屏蔽效應, 導致其磁響應能力極大下降[17,18]。本研究組的前期工作顯示, 以磁性材料為金納米材料的外殼, 形成一種“磁包金”核殼異質結構的納米材料(Magnetic coated gold nanoparticles, MGNPs), 可有效避免金納米材料對磁性材料的屏蔽效應; 此外, 通過增加金納米材料在“磁包金”復合納米材料中的質量百分比, 可以極大地提高MGNPs的光學活性, 進而提高ICA的檢測靈敏度[19]。據此, 本研究通過乳液自組裝法將油酸化的氧化鐵納米粒子(Oleic acid coated iron oxide nanoparticles, OC-IONPs)與油胺化的金納米粒子(Oleylamine-coated gold nanoparticles, OA-AuNPs)共封裝在聚(馬來酸酐-alt-1-十八碳烯)(PMAO)中, 利用OC-IONPs及OA-AuNPs與PMAO的溶解性差異, 基于相分離原理合成了一種“磁包金”核殼異質結構的新型金磁納米粒子(MGNPs)雙功能材料。人絨膜促性腺激素(Human chorionic gonadotropin, HCG)是一種由胎盤滋養細胞產生的糖蛋白激素, 是妊娠診斷的常見生物標志物[20,21]。此外, 某些其它的疾病也會產生HCG, 例如異位妊娠[22]和非滋養細胞腫瘤[23](如生殖細胞腫瘤)等。本研究以新型MGNPs為ICA的標記探針, 以HCG為檢測物模型, 構建了檢測血清中HCG的ICA方法。
2 實驗部分
2.1 儀器與試劑
XYZ3000型點膜儀、自動切條儀(金標生物科技公司); 電熱恒溫鼓風干燥箱、紫外-可見分光光度計(上海福瑪實驗設備有限公司); JEOL JEM 2100型高分辨率透射電鏡(日本電子株式會社); ZEN3700納米粒度及電位分析儀(英國馬爾文公司); GIC-S2011-S2型金標免疫層析讀數儀(蘇州和邁精密儀器有限公司)。
硝酸纖維素(NC)膜、樣品墊、吸水紙及PVC底板(美國Millipore公司); HCG標準品、HCG-α單克隆抗體、HCG-β單克隆抗體、羊抗鼠二抗(重慶欣源佳和生物科技有限公司); 人血清(索萊寶公司); 牛血清白蛋白、PMAO、十二烷基磺酸鈉(Sodium dodecyl sulfonate, SDS)、氯金酸(Sigma公司); 其它試劑均為分析純。
2.2 實驗方法
2.2.1 MGNPs的合成 OA-AuNPs[24]及OC-IONPs[25]參照文獻方法合成。MGNPs的合成按本研究組已報道的方法[19]并略作改進。首先, 將5 mg PMAO、7 mg OA-AuNPs和3 mg OC-IONPs混合溶于100 μL氯仿, 然后將氯仿溶液加入250 μL SDS溶液(2 mg/mL)中充分混勻, 超聲乳化2 min (功率76.8 W, 工作5 s, 暫停10 s), 所得的細乳液于60℃下蒸發4 h, 隨后以13500 r/min離心15 min以分離MGNPs, 將MGNPs用超純水洗滌3次, 重懸于pH=10的超純水中, 水解MGNPs表面PMAO的酸酐24 h, 離心收集羧基化MGNPs, 重懸于1 mL超純水中。
2.2.2 檢測探針(MGNP@HCG-β-mAbs)的制備 采用1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)介導的共價偶聯法制備MGNP@HCG-β。具體過程為:將10 μL MGNPs(12 mg/mL)和2 μL HCG-β-mAbs (3 mg/mL)加入到200 μL 0.01 mol/L磷酸鹽緩沖液(PB, pH=7.4)中, 靜電吸附30 min后, 加入10 μg EDC進行偶聯, 反應30 min后, 加入100 μL (10 mg/mL)BSA封閉MGNPs表面多余位點, 13500 r/min離心15 min, 棄上清液, 沉淀重懸于50 μL含25%蔗糖、1% BSA和0.1% NaN3的溶液中, 即得到檢測探針MGNPs@HCG-β-mAbs。
2.2.3 免疫層析試紙條的制備 將1 mg/mL HCG-α-mAbs和1 mg/mL羊抗鼠二抗以0.74 μL/cm的速度分別噴涂于NC膜上作為試紙條的檢測線(T線)和質控線(C線), 37℃干燥12 h。將NC膜、樣本墊及吸水紙依次貼在PVC底板上, 切割成寬3.9 mm的小條, 置于卡殼中, 干燥環境中保存, 備用。
2.2.4 免疫層析試紙條定量檢測HCG 檢測流程如圖1所示。將2 μL MGNPs@HCG-β-mAbs加入350 μL人血清樣品中, 室溫孵育5 min, 磁性分離, 棄上清液, 隨后加入70 μL PB緩沖液重懸MGNPs@HCG-β-mAbs, 將混合液滴加至試紙條加樣孔中, 孵育10 min, 用膠體金讀取儀讀取試紙條ODT/ODC值(T線與C線的吸光度比值), 根據標準曲線計算血清中HCG含量。C線為質控線, 若C線無顯色讀值, 則判定檢測結果無效。
2.2.5 免疫反應動力學分析 根據免疫反應動力學確定試紙條定量檢測HCG的最佳判讀時間。將2 μL MGNPs@HCG-β-mAbs與350 μL血清樣品(濃度分別為7.8、15.6和31.25 mIU/mL, 1 mIU/mL可換算為0.375 ng/mL)室溫孵育反應5 min, 磁性分離, 將MGNPs@HCG-β-mAbs復溶于70 μL PB緩沖液中, 用膠體金讀取儀每隔30 s記錄試紙條ODT/ODC值, 連續監測 30 min。以反應時間為橫坐標, ODT/ODC值為縱坐標, 繪制免疫反應動力學曲線, 以ODT/ODC值進入穩定期為試紙條定量檢測HCG的最佳讀取時間。
2.2.6 定量檢測血清中HCG的標準曲線 將HCG標準品加入到HCG陰性血清中, 配制HCG終濃度為0.24~2000 mIU/mL的血清標準溶液, 按2.2.4節進行磁性富集和試紙條檢測, 10 min后讀取試紙條ODT/ODC值, 各濃度樣本重復檢測3次。以HCG濃度對數值為橫坐標, ODT/ODC值為縱坐標, 繪制標準曲線。
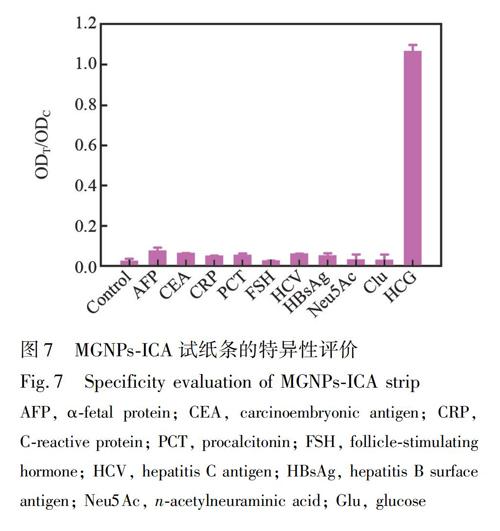
2.2.7 免疫層析試紙條性能評價 試紙條檢測血清HCG的特異性通過分析試紙條對血清中常見8種生物標志物的交叉反應進行評價。8種常見生物標志物包括:甲胎蛋白(AFP)、癌胚抗原(CEA)、C反應蛋白(CRP)、降鈣素原(PCT)、卵泡刺激素(FSH)、丙型肝炎抗原(HCV)、乙肝表面抗原(HBsAg), 葡萄糖(Glu)和N-乙酰神經氨酸(Neu5Ac)。其中, FSH的α亞基與HCG序列相似, 為HCG結構類似物, 其它為血清中常見疾病生物標志物。
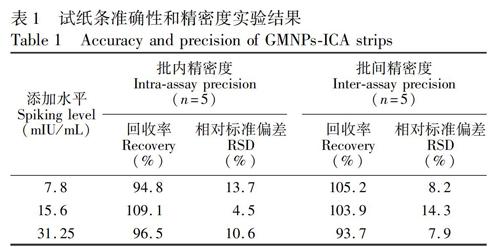
試紙條的精密性和準確性通過批內及批間的加標回收實驗進行評價。取HCG陰性血清樣品, 分別添加HCG至終濃度為7.8、15.6和31.25 mIU/mL。批內分析為同一天內重復測定4次, 批間分析為連續測定3天, 每個濃度重復測定4次, 計算試紙條檢測HCG的批內和批間加標回收率及相對標準偏差(RSD)。
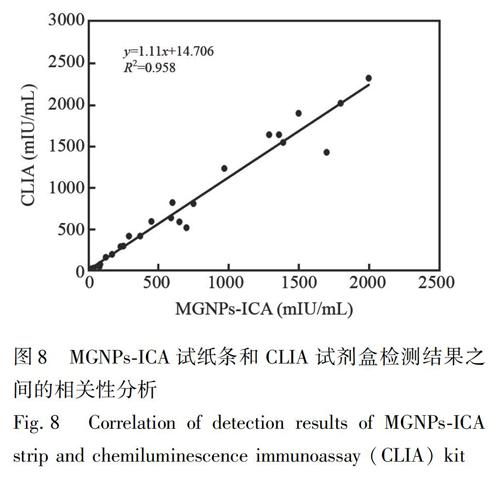
試紙條的實用性和可靠性通過與商業化學發光免疫分析(CLIA)試劑盒檢測結果進行相關性分析進行評價。取HCG陰性血清樣品, 隨機添加HCG至終濃度為20~2500 mIU/mL, 制備24份HCG陽性樣本, 同時采用本試紙條和商業化CLIA試劑盒進行檢測, 每個濃度重復測定3次。
3 結果與討論
3.1 MGNPs的表征
采用乳液自組裝法合成MGNPs。高分辨電子顯微鏡(TEM)圖(圖2A)顯示, MGNPs呈現近球形, 具有典型的核殼異質結構, 粒徑約為265 nm。動態光散射測定結果(圖2B)顯示, MGNPs的平均水化粒徑為285 nm。由于OA-AuNPs在TEM成像中較 OC-IONPs具有更高的對比度, 因此MGNPs核心部位的暗點為OA-AuNPs, 殼層部位為OC-IONPs, 表現為典型的“磁包金”核殼納米結構。此結構的形成主要是由于OA-AuNPs和OC-IONPs在聚合物PMAO中的溶解度差異以及疏水作用力, 從而驅動OA-AuNPs和OC-IONPs在微球中實現了定向分布。
使用磁性能測量系統測量MGNPs的飽和磁化強度表征。由圖3A可知, MGNPs的飽和磁化強度為28.1 emu/g, 為OC-IONPs(41.5 emu/g)的80%。MGNPs優異的磁學性能可能是因為OA-AuNPs優先聚集成核, 占據了MGNPs的內部空間, 使OC-IONPs主要分布在MGNPs的外殼層。外殼層的OC-IONPs有效規避了OA-AuNPs的磁屏蔽效應, 從而極大地保留了OC-IONPs的磁學特性。為了探究MGNPs材料的光學特性以及對試紙條顯色的貢獻率, 進一步將等摩爾濃度的MGPNs和AuNPs(30 nm)噴涂在試紙條的NC膜上, 用膠體金讀取儀讀取其吸光值, 結果如圖3B所示。在相同濃度(30 pmol/L)下, MGNPs在試紙條上的吸光值達到343.7, 比30 nm AuNPs高約12.5倍。MGNPs優越的光學特性得益于微球中包埋了大量的OA-AuNPs。綜上, 本研究合成的“磁包金”核殼結構的MGNPs具有優異的磁學以及光學特性, 可以作為磁分離的載體以及試紙條的信號輸出探針, 提高試紙條的檢測靈敏度。
3.2 MGNPs表面抗體標記量的優化
MGNPs表面標記的HCG-β-mAbs量過少, 會影響探針對HCG的捕獲效率, 而標記的HCG-β-mAbs過量, 會在MGNPs表面產生位阻效應, 反而導致HCG的捕獲量降低。為了獲得具有最佳活性的MGNPs@HCG-β-mAbs, 本研究進一步優化了MGNPs表面的抗體標記量。如圖4所示, 當MGNPs微球表面抗體標記量從12.5 μg/mg增加至50 μg/mg時, 試紙條T線顯色強度從606增加至963; 但是, 隨著抗體標記量的進一步增加, 試紙條T線顯色強度反而呈下降趨勢。因此, 選擇每毫克MGNBs標記50 μg HCG-β-mAbs為最佳標記量。
3.3 免疫層析試紙條參數的優化
進一步優化了試紙條T線HCG-α-mAbs噴涂濃度和MGNPs@HCG-β-mAbs檢測探針用量。如圖5A所示, 隨著HCG-α-mAbs噴涂濃度增加, 試紙條T線顯色強度逐漸增強, 當T線HCG-α-mAbs噴涂量為1.0 mg/mL時,? T線信號值趨于飽和。為了能夠獲得更寬的HCG檢測線性范圍, 避免過早出現“Hook”效應, 選擇T線噴涂HCG-α-mAbs濃度為 2.0 mg/mL。進一步優化了MGNPs@HCG-β-mAbs探針用量, 結果如圖5B所示。當每張試紙條MGNPs@HCG-β-mAbs探針用量為2 μL時, T線顯色信號趨于飽和, 因此選擇單張試紙條的探針用量為2 μL。
為了提高試紙條定量的準確度和重現性, 以試紙條ODT/ODC隨免疫反應時間變化繪制免疫動力學曲線, 通過免疫動力學曲線確定了試紙條定量檢測HCG的最佳判讀時間, 結果如圖5C所示。隨著免疫反應時間延長, 試紙條ODT/ODC比值逐漸降低, 10 min后即趨于穩定, 因此確定加樣后10 min為試紙條定量檢測的判讀時間。
3.4 試紙條定量檢測HCG的標準曲線
在最佳條件下, 采用制備的免疫層析試紙條檢測含不同濃度HCG的血清樣本。以HCG濃度的對數值為橫坐標, ODT/ODC值為縱坐標, 繪制標準曲線。如圖6B所示, 當血清中HCG濃度從0.97 mIU/mL增加至250 mIU/mL時, 試紙條ODT/ODC值與HCG濃度對數值呈良好的線性關系:y=0.256lnx-0.0429(R2=0.9816), 其中, x為HCG濃度, y為ODT/ODC值。當血清中HCG濃度低于0.97 mIU/mL時, 試紙條T線吸光值為零, 因此確定試紙條檢測血清中HCG的檢出限為0.97 mIU/mL。由圖6A可知, 當血清中HCG濃度大于1000 mIU/mL時, ODT/ODC值呈下降趨勢, 試紙條有可能出現“Hook”效應。因此, 當采用試紙條檢測超高濃度的HCG時, 需將樣本進行恰當稀釋后進行檢測。
3.5 試紙條的選擇性和精密度
試紙條的特異性通過其與血清中其它常見生物標志物的交叉反應性進行評價。如圖7所示, 當血清中FSH及Neu5Ac的濃度為1000 mIU/mL, AFP、CEA、PCT、CRP、HCV、Glue以及HBsAg的濃度為1 μg/mL, 試紙條T線上幾乎無信號響應, 試紙條ODT/ODC值為零; 而血清中HCG濃度僅為62.5 mIU/mL, 試紙條ODT/ODC值達到1.086值, 表明試紙條對HCG具有高度的選擇性, 可用于血清中HCG的特異性檢測。
在血清中分別添加7.8、15.6 和31.25 mIU/mL的HCG, 每個濃度重復檢測3次, 結果如表1所示, 批內及批間回收率為93.7%~109.1%, RSD均低于14.3%, 表明MGNPs-ICA試紙條檢測血清HCG具有較好的準確性和精密度。
3.6 實際樣品分析
進一步評價了MGNPs-ICA試紙條檢測臨床實際樣品的準確率及可靠性。從江西省人民醫院收集了24例HCG陽性血清樣品, 實驗經過醫院倫理委員會批準, 患者均知情同意。使用本研究制備的試紙條以及市售CLIA試劑盒檢測, 兩種方法檢測結果進行相關性分析。如圖8所示, 兩種方法檢測血清樣品中HCG具有良好的一致性, 表明MGNPs-ICA試紙條檢測實際樣本中HCG具有較好的實用性和可靠性, 可望用于臨床血清樣品中HCG的快速檢測。相較于傳統CLIA試劑盒, 本研究制備的試紙條在檢測時間、 成本和便攜性方面具有明顯優勢。
4 結 論
采用乳液自組裝法成功合成了具有“磁包金”核殼結構的新型雙功能納米粒子。相比于傳統的“金包磁”納米粒子, “磁包金”雙功能納米粒子的磁性組分(OC-IONPs)分布在微球的殼層, 從而有效地避免了AuNPs對磁性材料的磁屏蔽效應。此新型材料展示出較好的磁學特性(磁飽和強度為OC-IONPs的80%)和較優異的光學強度(在試紙條上的光信號強度為30 nm膠體金的12.5倍)。進一步以MGNBs為新型雙功能標記探針, 建立了高靈敏檢測血清中HCG的免疫層析新方法。MGNBs結合了磁性材料的富集、純化優勢, 同時又有較好的光學靈敏度, 檢測血清中HCG靈敏度達到0.97 mIU/mL, 且檢測臨床實際樣本的結果與商業化CLIA方法具有較好的一致性, 表明此新型“磁包金”良好的實用性。
References
1 Dragsted L O, Gao Q, Scalbert A,? Vergeres G,? Kolehmainen M,? Manach C,? Brennan L,? Afman L A,? Wishart D S,? Lacueva C A,? Garciaaloy M,? Verhagen H,? Feskens E J M,? Pratico G. Genes Nutr.,? 2018, 13(1): 1-14
2 Andre F, Mcshane L M,? Michiels S,? Ransohoff D F,? Altman D G,? Reisfilho J S,? Hayes D F,? Pusztai L. Nat. Rev. Clin. Oncol.,?? 2011,?? 8(3): 171-176
3 Wang X,? Zhu Y,? Olsen T R,? Sun N,? Zhang W,? Pei R,? Lin Q. Electrochim. Acta,?? 2018:? 356-363
4 Liu P,? Fang X,? Cao H,? Gu M,? Kong J,? Deng A. Talanta,?? 2018:? 472-477
5 Chen X,? Leng Y,? Hao L,? Duan H,? Yuan J,? Zhang W,? Huang X,? Xiong Y. Theranostics,?? 2020,?? 10(8): 3737-3748
6 XU Jun-Li,? LIU Bei-Bei,? WANG Yu-Long,? LI Pan,? YANG Kang,? WU Qin,? JIANG Lan,? ZHANG Hao-Ran,? YANG Li-Fei,? ZHANG Cun-Zheng. Chinese J. Anal. Chem.,?? 2019,? 47(11): 1823-1831
許俊麗,? 劉貝貝,? 王玉龍,? 李 盼,? 楊 康,? 吳 勤,? 蔣 嵐,? 張皓然,? 楊立飛,? 張存政. 分析化學,? 2019,? 47(11): 1823-1831
7 WU Yu-Hao,? LIU Wen-Juan,? WU Yan-Hua,? ZHOU Yao-Feng,? XIONG Yong-Hua. Chin. J. Bioprocess Eng.,? 2018,? 16(2): 74-79
吳雨豪,? 劉文娟,? 武燕華, 周耀鋒,? 熊勇華.? 生物加工過程,??? 2018,? 16(2): 74-79
8 Guo L,? Shao Y,? Duan H,? Ma W,? Leng Y,? Huang X,? Xiong Y. Anal. Chem.,?? 2019,?? 91(7): 4727-4734
9 Huang Z, Xiong Z,? Chen Y,? Hu S,? Lai W. J. Agric. Food Chem.,?? 2019,?? 67(10): 3028-3036
10 GUO Bo-Yang,? MA Le,? ZHANG Meng-Dan,? YANG Jiang-Cun,? DU Hai-Ping,? MA Ting,? CUI Ya-Li. Chin. J. Cell. Mol. Immunol.,?? 2015,? 31(11): 1468-1472, 1478
郭博陽,? 馬 樂,? 張夢丹,? 楊江存,? 杜海平,? 馬 婷,? 崔亞麗.? 細胞與分子免疫學雜志,??? 2015,? 31(11): 1468-1472, 1478
11 Liu Y,? Yang Z,? Huang X,? Yu G,? Wang S,? Zhou Z,? Shen Z,? Fan W,? Liu Y,? Davisson M, Kalish H,? Niu G,? Nie Z,? Chen X. ACS Nano,?? 2018,?? 12(8): 8129-8137
12 Zhang L,? Zhu X,? Jiao D,? Sun Y,? Sun H. Mater. Sci. Eng. C,?? 2013,?? 33(4): 1989-1992
13 Xia S,? Yu Z,? Liu D,? Xu C,? Lai W. Food Control,?? 2016,?? 59: 507-512
14 Tang D,? Sauceda J C,? Liu Z,? Ott S,? Basova E,? Goryacheva I,? Biselli S,? Lin J,? Niessner R,? Knopp D. Biosens. Bioelectron.,?? 2009,?? 25(2): 514-518
15 Liu X,? Zhang C,? Liu K,? Wang H,? Lu C,? Li H,? Hua K,? Zhu J,? Hui W,? Cui Y,? Zhang X. Anal. Chem.,?? 2018,?? 90(5): 3430-3436
16 Hu S,? Huang Z,? Chen W,? Xing K,? Peng J,? Lai W. Food Agric. Immunol.,?? 2019,?? 30(1): 163-177
17 Mazuel F,? Espinosa A,? Radtke G,? Bugnet M,? Neveu S,? Lalatonne Y,? Botton G A,? Abouhassan A,? Wilhelm C. Adv. Funct. Mater.,?? 2017,?? 27(9): e1605799
18 Hu Y, Meng L,? Niu L,? Lu Q. ACS Appl. Mater. Interfaces,?? 2013,?? 5(11): 4586-4591
19 Hao L,? Leng Y,? Zeng L,? Chen X,? Chen J,? Duan H,? Huang X,? Xiong Y,? Chen X. Adv. Sci.,?? 2020,?? 7(2): e1902433
20 MAO Qin-Qin,? WANG Xiao-Ming. Jilin Med. J.,? 2020,? 41(05): 1206-1207
毛琴琴,? 王曉明.? 吉林醫學,??? 2020,? 41(05): 1206-1207
21 Ozgur E,? Roberts K E,? Ozgur E O,? Gin A,? Bankhead J B,? Wang Z,? Su J. Anal. Chem.,?? 2019,?? 91(18): 11872-11878
22 LI Hu-Ping,? GONG Wen-Jing,? ZHOU Chun-Hong. Medical Equipment,?? 2019,? 32(23): 56-57
李胡萍,? 龔文婧,? 周春紅.? 醫療裝備,??? 2019,? 32(23): 56-57
23 SHEN Xiao-Yan,? REN Tong,? FENG Feng-Zhi,? WAN Xi-Run,? XIANG Yang. Chin. J. Clin. Obstet. Gynecol.,?? 2012,? 13(3): 198-201
沈曉燕,? 任 彤,? 馮鳳芝,? 萬希潤,? 向 陽.? 中國婦產科臨床雜志,??? 2012,? 13(3): 198-201
24 Hiramatsu H,? Osterloh F E. Chem. Mater.,?? 2004,?? 16(13): 2509-2511
25 Fu R,? Jin X,? Liang J,? Zheng W,? Zhuang J,? Yang W. J. Mater. Chem.,?? 2011,?? 21(39): 15352-15356
Novel Magnet-coated Gold Nanoparticles-based
Immunochromatographic Strip for Quantitative Detection
of Human Chorionic Gonadotropin in Serum
ZHANG Yi1,? HAO Liang-Wen2,3,? SHEN Xuan-Ang1,
JIANG Hu2,3,? HUANG Xiao-Lin1,2,3,? XIONG Yong-Hua*1,2,3
1(School of Food Science,? Nanchang University,? Nanchang 330031,? China)
2(State Key Laboratory of Food Science and Technology,? Nanchang University,? Nanchang 330047,? China)
3(Jiangxi-OAI Joint Research Institute,? Nanchang University,? Nanchang 330047,? China)
Abstract A facile emulsion self-assembly strategy by co-assembling oleylamine-coated gold nanoparticles (OA-AuNPs) with oleic acid-coated iron oxide nanoparticles (OC-IONPs) into polymer nanobeads to form magnetic coated gold nanoparticles (MGNPs) was reported. The synthesized MGNPs exhibited a typical "magnetic-coated gold" core-shell heterostructure. Due to that OA-AuNPs aggregated in core and OC-IONPs assembled in shell,? the magnetic shielding effect of OA-AuNPs was effectively avoided. Therefore,? compared with the traditional "gold-coated magnetic" nanostructures,? the MGNPs synthesized here had higher magnetic saturation intensity (80% of OC-IONPs) and strong absorbance (12.5 times that of the traditional 30 nm colloidal gold nanoparticles). By using MGNPs as the dual-function labeled probe and human chorionic gonadotropin (HCG) as a model biomarker,? a highly sensitive immunochromatographic method (MGNPs-ICA) for detecting biomarkers in human serum was established. The results showed that the linear range of the MGNPs-ICA strip for quantitative detection of HCG in human serum was 0.97-250 mIU/mL,? and the linear regression equation was y=0.2561lnx-0.0429 (R2=0.9816). The detection limit was 0.97 mIU/mL. The intra-and inter-assay recoveries for HCG spiked serum were 93.7%-109.1%,? and the coefficient of variation was less than 14.3%. The specific experimental results showed that the method only showed a significant signal response to target HCG. In addition,? the results of this method were in good agreement with those of chemiluminescence immunoassay (CLIA). Compared with CLIA method,? MGNPs-ICA method had significant advantages in detection time,? cost and portability. In a word,? the as-prepared MGNPs had excellent magnetic properties and strong optical sensing ability,? and could significantly improve the detection performance of ICA platform.
Keywords Magnetic coated gold nanoparticles; Immunochromatographic strip; Human chorionic gonadotropin; Quantitative detection
(Received 1 June 2020; Received 25 September 2020)
This work was supported by the National Key Research and Development Program of China (No. 2018YFC1602505).
2020-06-01收稿; 2020-09-25接收
本文系“十三五”科技部重點研發計劃專項項目(No. 2018YFC1602505)資助
* E-mail: yhxiongchen@163.com

