鞣花酸對阿爾茨海默病小鼠學習和記憶能力的影響及其分子機制
仲麗麗,于穎,易婭靜,倪雪妍,劉思瑩,劉旭,劉宏 黑龍江中醫(yī)藥大學,哈爾濱50040;黑龍江中醫(yī)藥大學附屬第一醫(yī)院
阿爾茨海默病(AD)也稱老年癡呆,是一種起病隱匿的退行性神經疾病,主要以大腦皮層顳葉和額葉萎縮為主[1, 2]。其臨床表現為緩慢進展的認知功能的全面衰退,如記憶障礙、失語、失用、失認、視空間能力損害、抽象思維和計算力損害、人格和行為改變等,病程長達數年或數十年。目前尚缺乏對AD有效的治療方法,因此研發(fā)AD的新型治療藥物十分必要。鞣花酸(EA)是一種廣泛存在于各種軟果、堅果等植物組織中的天然多酚類化合物[3],具有酚類化合物的結構和性質。研究表明,EA在體內外均有清除氧自由基、抗氧化作用[4, 5],同時還具有抗菌、抗腫瘤、抑制細胞凋亡等作用[6~8]。研究顯示,APP/PS1雙轉基因小鼠可較好地模擬AD的病理變化及行為學特征,可作為研究AD發(fā)病機制及開發(fā)AD防治藥物的實驗模型[9]。2019年9月~2020年7月,本研究觀察了EA對AD小鼠學習記憶能力的改善作用,并從氧化應激、神經元凋亡、β淀粉樣蛋白表達等角度探究其作用機制。現報告如下。
1 材料與方法
1.1 材料 實驗動物:SPF級雄性APP/PS1雙轉基因小鼠20只,野生型C57BL/6小鼠10只,體質量24~28 g,均購自南京大學生物醫(yī)學研究所。藥物與主要試劑:EA(批號:E102710)、二甲基亞砜(DMSO)均購自上海阿拉丁生化科技有限公司,超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽過氧化物酶(GSH-PX)ELISA試劑盒均購自南京建成生物工程研究所,β淀粉樣蛋白1-40、1-42(Aβ1-40、Aβ1-42)試劑盒及Caspase-3抗體購自中國武漢愛博泰克生物科技有限公司。主要儀器:光學顯微鏡購自德國Leica公司,Morris水迷宮購自安徽淮北正華生物儀器公司,酶標儀購自美國RT公司。
1.2 動物分組及處理 將20只雄性APP/PS1雙轉基因小鼠隨機分為APP/PS1組、APP/PS1+EA組,每組10只,10只野生型C57BL/6小鼠作為WT組。適應性飼養(yǎng)1周后,APP/PS1+EA組按照50 mg/(kg·d)給予EA灌胃,WT組、APP/PS1組給予等體積DMSO灌胃,均連續(xù)給藥60 d。
1.3 學習、記憶能力觀察 采用Morris水迷宮實驗。各組給藥后先進行連續(xù)4 d的Morris水迷宮實驗,每只小鼠每次訓練120 s,每天訓練2次;在訓練過程中,若小鼠入水后找到并爬到站臺,則讓小鼠在平臺上停留30 s;若入水后2 min 內小鼠未能找到或爬上站臺,則將其引導至站臺上并站立30 s;平臺停留后將小鼠取下休息,記錄各組小鼠2 min內初次到達平臺的時間即潛伏期。實驗第5天進行空間探索實驗,去掉水中平臺,記錄小鼠2 min內的潛伏期、穿越平臺次數、目標象限停留時間。
1.4 腦組織氧化應激相關指標及Aβ1-40、Aβ1-42蛋白表達檢測 采用ELISA法。各組小鼠Morris水迷宮實驗結束后斷頭處死,快速取腦組織;部分腦組織用4 ℃生理鹽水制備成10%的組織勻漿,3 000 r/min離心10 min,取上清液。采用ELISA法檢測氧化應激相關指標SOD、MDA、GSH-PX及Aβ1-40、Aβ1-42蛋白表達,嚴格按照試劑盒說明書進行操作。
1.5 腦組織凋亡蛋白Caspase-3表達檢測 采用免疫組化法。取各組小鼠部分腦組織,用4%多聚甲醛固定,依次乙醇梯度脫水,浸蠟、包埋組織,切片、沖洗、微波修復。使用3%的H2O2阻斷內源性過氧化物酶,反復PBS沖洗5 min×3次,按照說明依次滴入一抗、二抗,沖洗后DAB顯色,蘇木素復染、乙醇梯度脫水、樹脂膠封片。在100倍光學顯微鏡下觀察Caspase-3蛋白陽性顆粒的表達情況并拍照,采用Imgagepro Plus6.0軟件分析圖像的積分光密度(IOD)值。

2 結果
2.1 各組學習、記憶能力比較 與WT組比較,APP/PS1組、APP/PS1+EA組第1、2、4、5天潛伏期均延長(P均<0.05);與APP/PS1組比較,APP/PS1+EA組第4、5天潛伏期均縮短(P均<0.05);見表1。與WT組比較,APP/PS1組穿越平臺次數減少、目標象限停留時間縮短(P均<0.01);與APP/PS1組比較,APP/PS1+EA組穿越平臺次數增加、目標象限停留時間延長(P均<0.05);見表2。
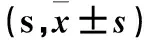
表1 各組連續(xù)5 d潛伏期比較

表2 各組穿越平臺次數、目標象限停留時間比較
2.2 各組腦組織SOD、MDA、GSH-PX、Aβ1-40、Aβ1-42、Caspase-3蛋白表達比較 與WT組比較,APP/PS1組腦組織SOD、GSH-PX蛋白表達均降低,MDA、Aβ1-40、Aβ1-42、Caspase-3蛋白表達均升高(P均<0.05);與APP/PS1組比較,APP/PS1+EA組腦組織SOD、GSH-PX蛋白表達均升高,MDA、Aβ1-40、Aβ1-42、Caspase-3蛋白表達均降低(P均<0.05)。見表3。

表3 各組腦組織SOD、MDA、GSH-PX、Aβ1-40、Aβ1-42、Caspase-3蛋白表達比較
3 討論
AD是臨床上常見的緩慢進展且不可逆性的進行性疾病,對患者家庭以及整個社會造成巨大負擔。對于AD的發(fā)病機制存在多種假說,包括氧化應激、Aβ、Tau蛋白過度磷酸化、細胞凋亡、膽堿能系統(tǒng)失調等[10~13]。EA廣泛存在于多種水果和堅果之中,其化學分子結構式中含有四個酚羥基,使其在生物活性方面具有較強的提供氫原子或與孤對電子配對的能力。因此,EA具有較強的清除自由基、抗氧化能力[14, 15]。研究顯示,對APP/PS1雙轉基因小鼠給予灌胃富含EA的石榴汁后,小鼠空間學習和記憶能力得到了明顯改善,小鼠腦組織中斑塊數量和Aβ堆積也顯著減少[16]。Morris水迷宮實驗常用于檢測小鼠的認知功能。本研究結果顯示,與WT組比較,APP/PS1組第1、2、4、5天潛伏期均延長,第5天穿越平臺次數減少、目標象限停留時間縮短,說明APP/PS1組發(fā)生認知功能障礙、學習記憶能力明顯降低;與APP/PS1組比較,APP/PS1+EA組第4、5天潛伏期均縮短,第5天穿越平臺次數增加、目標象限停留時間延長,說明EA可以減輕APP/PS1小鼠的認知功能障礙并提高其學習、記憶能力。
氧化應激在AD發(fā)生、發(fā)展中具有重要作用,可以導致神經元凋亡并加速AD的發(fā)生[17]。MDA是衡量機體內發(fā)生氧化應激反應的重要參考指標,SOD和GSH-PX是抗氧化酶中的重要成員,可以幫助機體清除自由基,防止機體發(fā)生過氧化反應。神經元凋亡是AD發(fā)生的重要機制之一,其中Caspase-3是凋亡過程中處于中心環(huán)節(jié)的蛋白酶,也是半胱氨酸蛋白酶家族的成員,可在細胞表面互相作用,參與介導細胞凋亡[18]。Aβ沉積在AD發(fā)病過程中處于中心環(huán)節(jié),也是AD發(fā)病的核心蛋白,是由39~42個氨基酸殘基組成的蛋白質[19]。淀粉樣前體蛋白APP水解生成Aβ,穿過血腦屏障后向外運輸。正常情況下,機體內Aβ的產生和清除處于動態(tài)平衡之中,若生成增多或清除減慢,則會出現Aβ在機體內不斷積累、聚集、沉積,最后會形成老年斑。經過一系列反應,可引發(fā)AD的發(fā)生。Aβ1-40和Aβ1-42是Aβ的主要成分,Aβ1-42從時程和量的積累上均較Aβ1-40表現出更強的毒性,更加容易積累和聚集[20]。本研究結果顯示,與WT組比較,APP/PS1組腦組織SOD、GSH-PX蛋白表達均降低,MDA、Aβ1-40、Aβ1-42、Caspase-3蛋白表達均升高,說明APP/PS1小鼠氧化應激水平升高、神經元凋亡明顯增加、Aβ蛋白表達升高;與APP/PS1組比較,APP/PS1+EA組腦組織SOD、GSH-PX蛋白表達均升高,MDA、Aβ1-40、Aβ1-42、Caspase-3蛋白表達均降低,說明EA具有顯著的抗氧化活性、海馬神經元保護作用,并能有效降低Aβ蛋白表達。
綜上所述,EA可以改善AD小鼠的學習和記憶能力,其作用機制可能與降低氧化應激水平、減少神經元凋亡及降低Aβ蛋白表達有關,為臨床治療AD提供一種新的方法和思路。

