優化高效液相色譜法測定雞肉及雞湯中嘌呤含量
方妍,謝定源,丁璐,余永昊,羅鑫
(華中農業大學 食品科技學院,環境食品學教育部重點實驗室,武漢 430070)
高尿酸血癥與痛風都是分解的代謝產物,是體內尿酸生成過多或排泄過少引起的嘌呤代謝性障礙疾病[1]。研究表明,長期食用高嘌呤食物將大大提高痛風的發病率[2]。隨著社會進步和經濟發展,加上不良的飲食結構和生活習慣,痛風病明顯上升,并引發“三高”病、糖尿病、腎病等相關疾病[3]。隨著人們生活水平的不斷提高,雞肉和雞湯受到越來越多消費者的歡迎。過多食用動物內臟、魚、蝦、肉湯等高嘌呤食物,會增加外源性嘌呤,導致血液尿酸升高。而屬于高嘌呤食品中的肉湯,包括濃汁湯、雞湯、魚湯、火鍋湯,痛風患者應禁食[4]。因此,準確測定雞肉和雞湯中的嘌呤含量可為消費者尤其是痛風患者提供科學的飲食指導。
目前國內外對于食品中嘌呤含量的檢測還沒有一個系統的標準檢測方法。嘌呤的檢測早在20世紀50年代就引起關注,目前應用較為廣泛的方法有薄層色譜法、電泳法、紙層析法、氣相色譜法、液相色譜法和離子色譜法等[5-10]。目前高效液相色譜法在食品檢測中應用廣泛[11-15],而對于嘌呤含量的檢測,較主流的檢測方法是高效液相色譜法[16]。對于不同的前處理方法會導致樣品中嘌呤的提取率不同,從而導致不同的測定結果[17-18],對于提取條件的優化能為樣品中嘌呤含量的準確測定奠定基礎。本實驗將通過正交實驗優化提取雞肉和雞湯中嘌呤含量,并選擇最佳的色譜條件,建立準確、可靠的檢測雞肉和雞湯中嘌呤含量的方法,為痛風患者合理食用雞肉和雞湯提供了理論依據。
1 材料與方法
1.1 原料及藥品
老母雞:雞齡在1年半到2年左右,養殖地黃陂,購于華農梧桐生鮮超市;腺嘌呤、鳥嘌呤、次黃嘌呤、黃嘌呤(色譜級,純度>99.0%):上海源葉生物科技有限公司;甲醇(色譜純)、氫氧化鉀(分析純):國藥集團化學試劑有限公司;磷酸二氫鉀(色譜純)、三氟乙酸(色譜純):麥克林公司;磷酸(色譜純):Aladdin公司。
1.2 儀器及設備
R214型旋轉蒸發儀 上海申生科技有限公司;PK-324型電熱恒溫水浴鍋 上海精宏實驗設備有限公司;LC-20A型高效液相色譜儀 日本島津公司;SB-3200超聲波清洗機 寧波新芝生物科技股份有限公司;MillQ型超純水系統 美國Millipore公司;ME104E102型電子天平 梅特勒-托利多(上海)有限公司;TP-B3000型電子天平 福州華志科學儀器有限公司;pH818型pH計 香港希瑪公司;ST22H1蘇泊爾304不銹鋼燉鍋 蘇泊爾股份有限公司;QSJ-B03D1型切碎機 廣東小熊電器有限公司;9HB-III型循環水式多用真空泵 鄭州恒巖儀器有限公司;TDZ4-WS型醫用離心機 長沙平凡儀器儀表有限公司。
1.3 實驗方法
1.3.1 溶液的配制
分別準確稱取腺嘌呤、鳥嘌呤、次黃嘌呤及黃嘌呤標準品0.012 g,加入適量超純水超聲助溶,再分別轉移至10 mL容量瓶中用超純水定容,得到1200 mg/L的各嘌呤標準液,于4 ℃的冰箱中保存備用。移取等體積的嘌呤標準儲備液,配制成混合標準儲備液,質量濃度為300 mg/L,放入4 ℃冰箱貯藏備用。
1.3.2 色譜條件
采用LC-20A型島津高效液相色譜儀,色譜柱為Waters Atlantis dC18(4.6 mm×250 mm,5 μm)。
1.3.2.1 甲醇-水色譜條件優化
參考程慶紅等[19]的色譜方法:流動相為甲醇-水(5∶95,V/V),流速 1.0 mL/min,柱溫 30 ℃,檢測波長254 nm,進樣量20 μL,在此基礎上稍作修改,并進行優化和驗證,得到在此流動相條件下最佳的色譜條件。
分別在流動相為V甲醇∶V水為2∶98、3∶97、5∶95、7∶93、10∶90的條件下對混合標準儲備液進行測定,柱溫30 ℃,流速1.0 mL/min,進樣量10 μL,檢測波長254 nm,根據分離效果確定最終的甲醇-水的配比。
選用確定的最佳甲醇-水的配比,在其他色譜條件保持不變的條件下,分別在流速為0.8,1.0,1.2,1.4 mL/min的不同流速下,對混合嘌呤標準品進行進樣檢測,根據分離效果確定最終的流速。
1.3.2.2 磷酸二氫鉀色譜條件優化
參考劉鎮等[20]的色譜方法:流動相為7×10-3mol/L KH2PO4-H3PO4(pH為4.0),流速 1.0 mL/min,柱溫25 ℃,檢測波長254 nm,進樣量10 μL,在此基礎上稍作修改,并進行優化和驗證,得到在此流動相條件下最佳的色譜條件。
分別在流動相0.007 mol/L磷酸二氫鉀的pH為3.4,3.6,3.8,4.0,4.2的條件下對混合嘌呤標準品進行測定,柱溫30 ℃,流速1.0 mL/min,進樣量10 μL,檢測波長254 nm,根據分離效果確定最終的流動相pH值。
選用確定的最佳流動相的pH,在其他色譜條件保持不變的條件下,分別在流速為0.8,1.0,1.2,1.4 mL/min的不同流速下,對混合嘌呤標準品進行進樣檢測,根據分離效果確定最終的流速。
1.3.3 標準曲線的制作
移取等體積的嘌呤標準儲備液,配制成混合標準儲備液,質量濃度為300 mg/L,臨用前用超純水稀釋為300,100,50,10,5,1,0.5 mg/L的系列梯度混合標準液。利用上述建立的最佳色譜條件,分別進樣檢測,記錄峰面積。以混合液的濃度為橫坐標,峰面積為縱坐標作線性回歸,繪制4種嘌呤的標準曲線,確定線性范圍。以3倍的信噪比(S/N)所對應的濃度作為檢出限(LOD)。
1.3.4 方法精密度
取質量濃度為10 mg/L的混合標準液連續進樣6次,進樣量為10 μL,計算相對標準偏差(RSD),確定此方法的精密度。
1.3.5 雞肉和雞湯樣品的制備
將購買的老母雞(含內臟)切成均勻大小的肉塊,上冷水沖洗,瀝干稱重,將雞肉去骨,取可食部分用絞肉機攪碎,每份稱取0.2 g分裝,于4 ℃冰箱中貯藏備用。稱取洗凈的雞肉,按料水比雞肉∶水為1∶3(m/m)放入實驗鍋中,用旺火煮沸后,撇去上層浮沫,轉小檔繼續煮制,時間為60 min(計時從水煮沸后開始)。雞湯煮制好后,用雙層200目絹布過濾,冷卻后放入4 ℃冰箱中澄清24 h,去除上層黏稠雞油,取清液過濾后放入4 ℃冰箱貯藏備用。
1.3.6 樣品前處理方法的確定
參考楊平等[21]的前處理方法,并稍作修改。雞肉前處理:稱取0.2 g肉泥置于玻璃頂空瓶中,向其中加10 mL混合酸,其中三氟乙酸∶甲酸∶超純水為5∶5∶1,90 ℃水浴中振蕩15 min后迅速冷卻,轉移至250 mL燒瓶中,55 ℃減壓濃縮至干,殘余物用5 mL最佳流動相配比復溶,復溶后的液體以3000 r/min轉速離心20 min,取約1 mL過0.45 μm水系濾膜后進樣。雞湯前處理:取1 mL肉湯置于玻璃頂空瓶中,處理方法與雞肉前處理方法一致。
1.3.6.1 三氟乙酸濃度的確定
稱取0.2 g雞肉與1 mL雞湯樣品各15份,按1.3.6的樣品處理方法進行操作,改變三氟乙酸濃度為80%、85%、90%、95%、100%,比較不同三氟乙酸濃度對雞肉和雞湯中嘌呤提取率的影響。
1.3.6.2 水解溫度的確定
稱取0.2 g雞肉與1 mL雞湯樣品各15份,按1.3.6的樣品處理方法進行操作,改變水解溫度為75,80,85,90,95 ℃,比較不同水解溫度對雞肉和雞湯中嘌呤提取率的影響。
1.3.6.3 水解時間的確定
稱取0.2 g雞肉與1 mL雞湯樣品各15份,按1.3.6的樣品處理方法進行操作,改變水解時間為5,10,15,20,25 min,比較不同水解時間對雞肉和雞湯中嘌呤提取率的影響。
1.3.6.4 正交實驗優化前處理方法
在單因素實驗結果的基礎上,設計L9(34)正交表進行正交實驗,以嘌呤的提取率作為實驗指標,確定最佳的雞肉及雞湯的前處理條件,實驗方案見表1和表2。
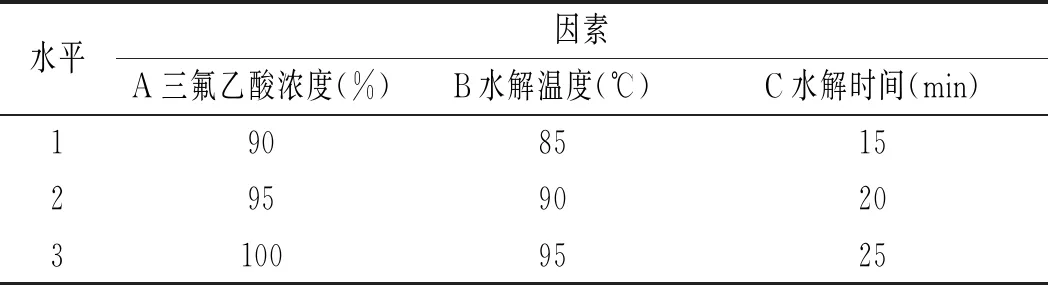
表1 雞肉前處理正交實驗表Table 1 The orthogonal experiment table of chicken pretreatment
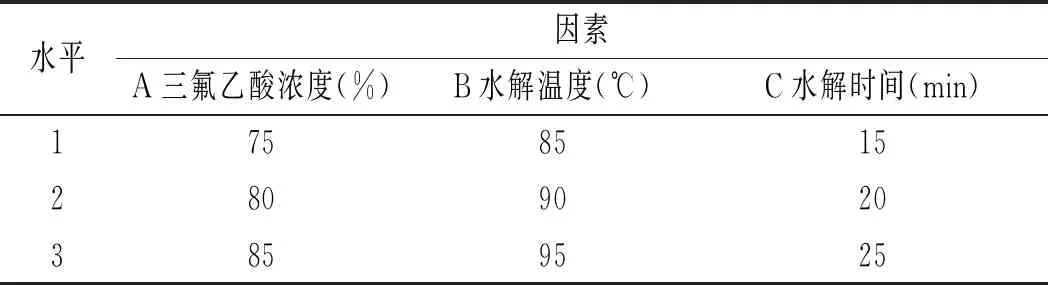
表2 雞湯前處理正交實驗表Table 2 The orthogonal experiment table of chicken soup pretreatment
1.3.7 重復性實驗
取雞肉及雞湯樣品各6份,按照確定的最佳前處理條件提取雞肉和雞湯中的嘌呤,再用選定的色譜條件進行進樣分析,根據檢測結果計算相對標準偏差(RSD),檢驗雞肉和雞湯前處理方法的重現性。
1.3.8 加標回收率
稱取已知各嘌呤含量的雞肉及雞湯樣品12份,分別按照每種嘌呤含量的5,8,10倍加入嘌呤標準品,配制成3個不同的濃度,再按照確定的最佳前處理條件以及色譜條件進行處理和進樣分析,每個樣品平行測定3次,取平均值,求出平均回收率。
1.4 數據分析
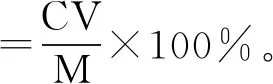
式中:C為嘌呤的質量濃度,mg/L;V為復溶后液體的體積,L;M為樣品質量,g。
加標回收率(%)=(測定值-本底值)/加標量×100%。
數據采用Excel 13.0和SPSS 26.0進行分析,作圖使用Excel 13.0。
2 結果與分析
2.1 優化的色譜條件
2.1.1 流動相為甲醇-水
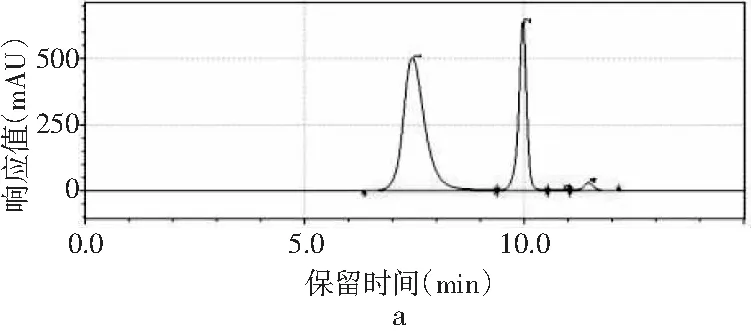
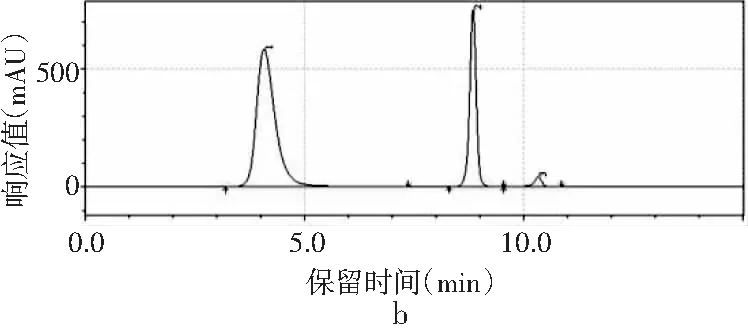
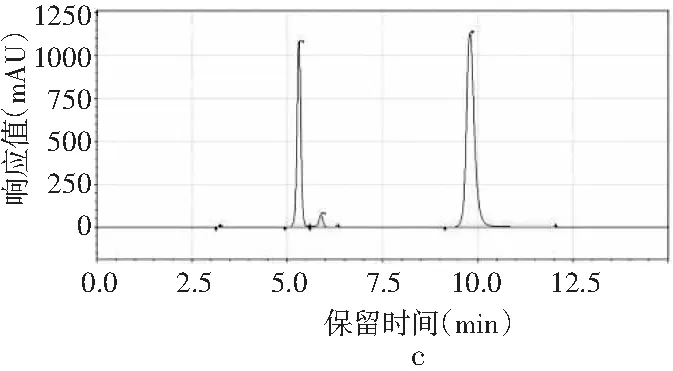
圖1 4種嘌呤在不同甲醇-水配比下的分離情況Fig.1 The separation of four purines under different methanol-water ratios
采用甲醇-水作為流動相測定嘌呤標準品中4種嘌呤的含量。根據測定嘌呤單一標準品可知,4種嘌呤的出峰順序依次是鳥嘌呤、腺嘌呤、次黃嘌呤、黃嘌呤。由圖1中a可知,當流動相配比V甲醇∶V水為2∶98時,4種嘌呤可以完全分離,查看峰表可知4種嘌呤的保留時間分別是7.442,9.958,10.877,11.450 min。甲醇配比對4種嘌呤分離效果的影響見圖1,隨著甲醇比例的增加,當甲醇∶水的比例為3∶97、10∶90時,4種嘌呤無法完全分離,只出現3個峰,黃嘌呤和次黃嘌呤無法分離,因此甲醇比例的增加會導致4種嘌呤的分離效果變差,從而選擇甲醇∶水的最佳配比為2∶98進行進一步的優化。
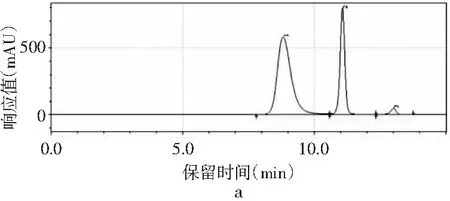
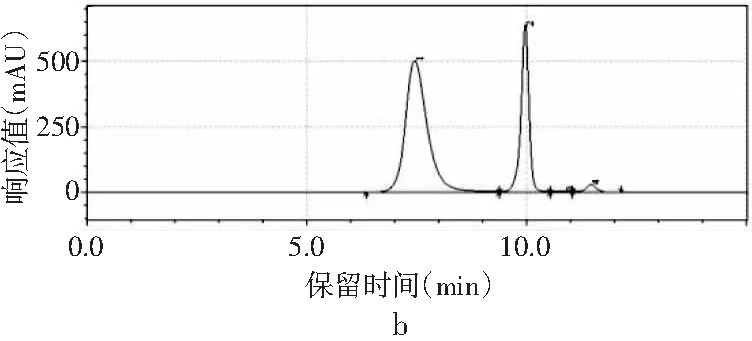
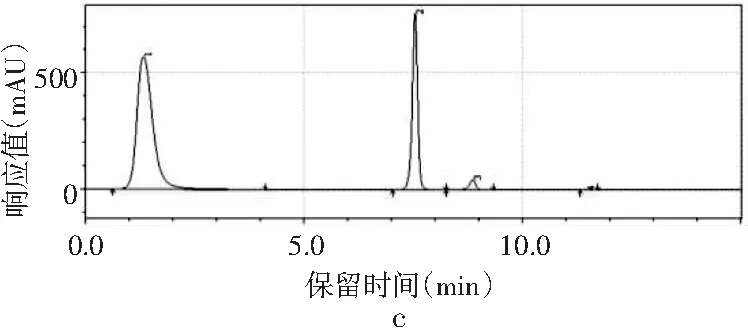
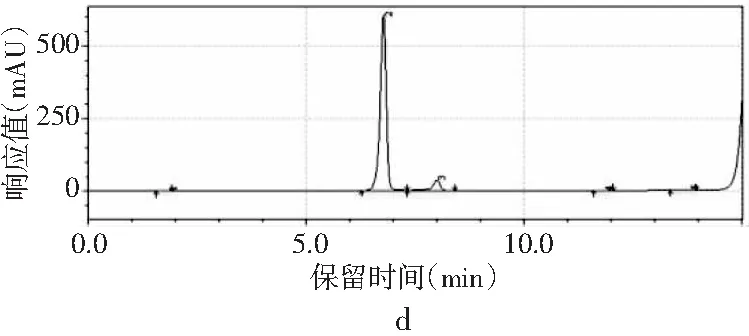
圖2 4種嘌呤在不同流速下的分離情況Fig.2 The separation of four purines at different flow rates
當其他色譜條件不變,只改變流速時,由圖2中a可知,當流速為0.8 mL/min時,只能出現3個峰,4種嘌呤無法完全分離。當流速增加時,分離度也隨之增加。當流速增加到1.0 mL/min時,4種嘌呤分開,出峰順序依次是鳥嘌呤、腺嘌呤、次黃嘌呤和黃嘌呤,出峰尖銳,峰形較好。當流速增加到1.2 mL/min時,各嘌呤的保留時間提前,分離度也進一步增大,峰形也較好。而當流速為1.4 mL/min時,在15 min內出峰不完整,且峰形較差,比較1.0 mL/min與1.2 mL/min發現,流速為1.0 mL/min時,次黃嘌呤與黃嘌呤的保留時間僅相差0.573 min,而流速為1.2 mL/min時,兩者保留時間相差達到2.611 min,因此最終選擇流速1.2 mL/min作為最佳流速。因此,以甲醇-水為流動相測定嘌呤標準品的最優色譜條件是:色譜柱為Waters Atlantis dC18(4.6 mm×250 mm,5 μm),流動相是V甲醇∶V水為2∶98,流速為1.2 mL/min,柱溫為30 ℃,檢測波長為254 nm,進樣量為10 μL。
2.1.2 流動相為KH2PO4-H3PO4
磷酸二氫鉀不同pH值對4種嘌呤的分離效果見圖3。
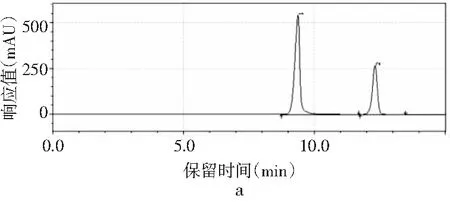
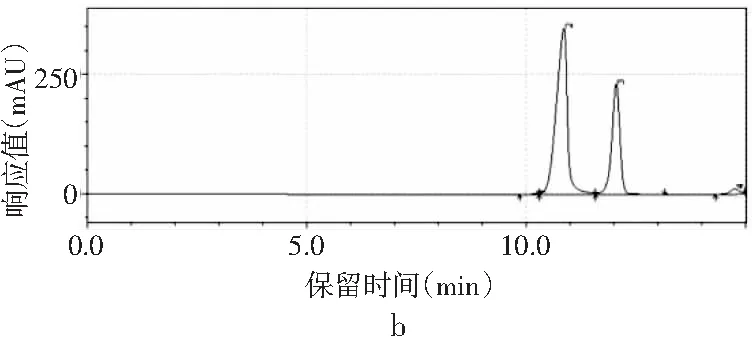
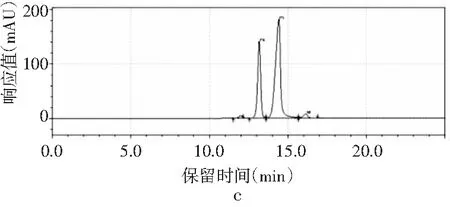
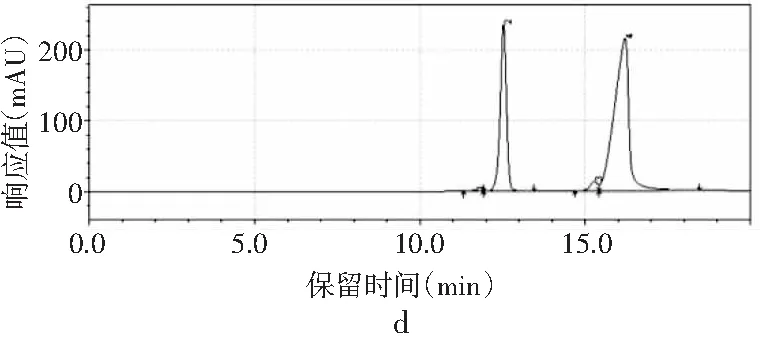
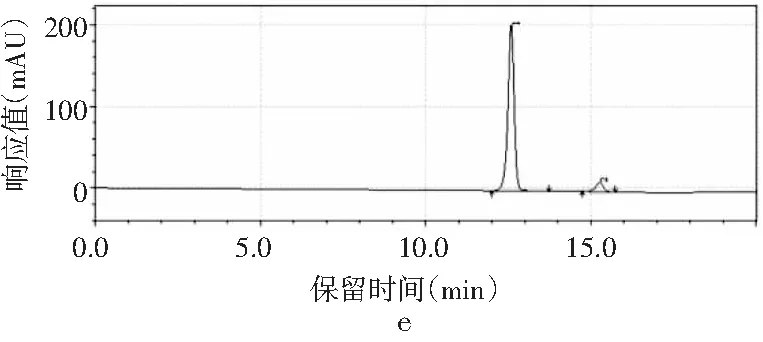
圖3 4種嘌呤在磷酸二氫鉀不同pH下的分離情況Fig.3 The separation of four purines at different pH values of potassium dihydrogen phosphate
由圖3可知,當pH為3.4時,只出現2個峰,4種嘌呤無法完全分離,峰1是腺嘌呤與鳥嘌呤的混合峰,峰2是次黃嘌呤與黃嘌呤的混合峰。隨著pH增大,4種嘌呤的分離度也隨之增加。當pH為3.6時,出現4個峰,出峰順序依次是鳥嘌呤、次黃嘌呤、腺嘌呤和黃嘌呤,但是鳥嘌呤與次黃嘌呤的保留時間僅相差0.624 min,兩峰相隔太近,出峰效果較差。當pH增加到3.8時,4種嘌呤完全分離開,且峰形尖銳、完整,出峰效果好。而當pH進一步增大到4.0時,出現4個峰,但是腺嘌呤與黃嘌呤未出現明顯分峰現象。當pH為4.2時,在20 min內只出現了2個峰,因此最終選擇pH為3.8的磷酸二氫鉀作為流動相進行進一步的優化。
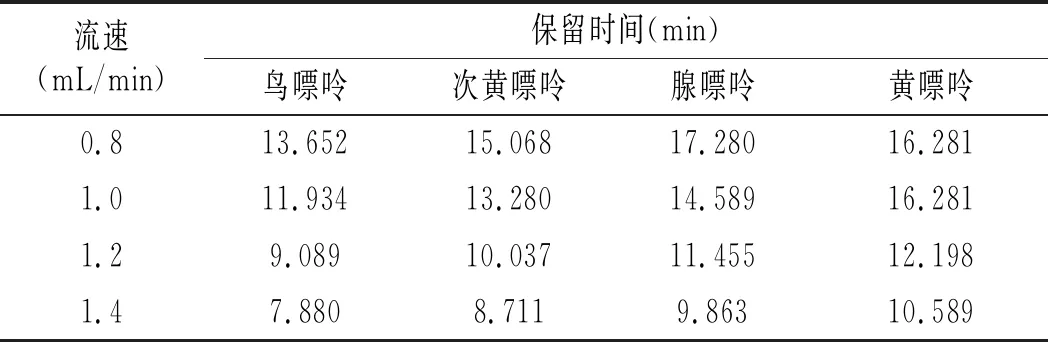
表3 不同流速下4種嘌呤的保留時間Table 3 The retention time of four purines at different flow rates
由表3可知,當其他色譜條件不變,只改變流速時,4種流速下均分離出4種峰,且峰形均較好。隨著流速的增加,4種嘌呤的保留時間均提前,且腺嘌呤與黃嘌呤的分離程度也隨之變化。流速對4種嘌呤保留時間的影響見表3。流速為0.8 mL/min時,腺嘌呤與黃嘌呤的保留時間僅相差1.022 min;流速為1.0 mL/min時,相差1.692 min;1.2 mL/min時,相差0.743 min;1.4 mL/min時,相差0.726 min。由此可見,當流速為1.0 mL/min時,腺嘌呤與黃嘌呤的分離程度最大,峰形最好,因此選擇流速1.0 mL/min作為最佳流速。 以磷酸二氫鉀作為流動相分離4種嘌呤的最優色譜條件是:色譜柱是Waters Atlantis dC18(4.6 mm×250 mm,5 μm);流動相為7.0×10-3mol/L的磷酸二氫鉀(pH 為3.8),流速為1.0 mL/min,柱溫為30 ℃,檢測波長為254 nm,進樣量為10 μL。
對比甲醇-水與磷酸二氫鉀作為流動相時的色譜圖可發現,以甲醇和水作為流動相時黃嘌呤的出峰效果不如以磷酸二氫鉀作為流動相時的效果。并且相比兩者的流速而言,磷酸二氫鉀作為流動相的最佳流速為1.0 mL/min,而甲醇-水為1.2 mL/min,流速高時會減少色譜柱的使用壽命,因此在本實驗中最終選擇以7.0×10-3mol/L的磷酸二氫鉀(pH為3.8)為流動相,色譜柱為Waters Atlantis dC18(4.6 mm×250 mm,5 μm);流速1.0 mL/min、柱溫30 ℃、檢測波長254 nm、進樣量10 μL為最終的色譜條件。
2.2 標準曲線
根據2.1最終確定的色譜條件進樣檢測不同濃度的嘌呤混合標準品,以峰面積(Y)和質量濃度(X)做線性回歸,線性實驗結果見表4。4種嘌呤在0.5~300 mg/L質量濃度范圍內線性關系良好,相關系數在0.9998~0.9999之間,檢出限在0.024~0.129 mg/L之間。
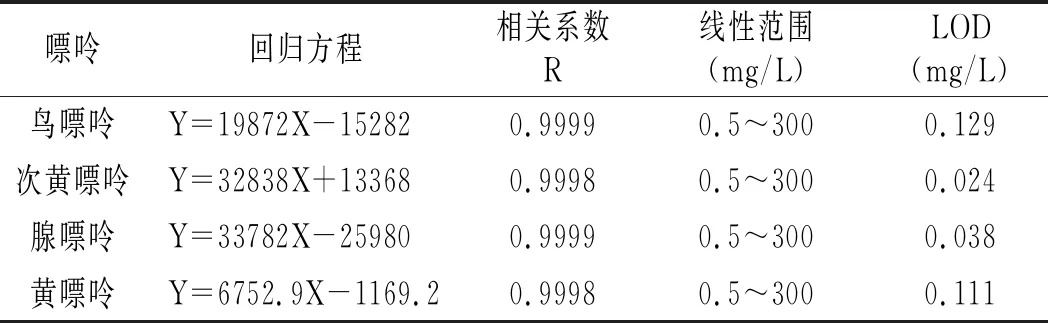
表4 線性實驗結果Table 4 The linearity experiment results
2.3 方法精密度
檢測方法精密度實驗結果見表5。相對標準偏差在0.4673%~0.8132%之間,表明本實驗建立的高效液相色譜檢測方法精密度好,可用于樣品中嘌呤含量的檢測。
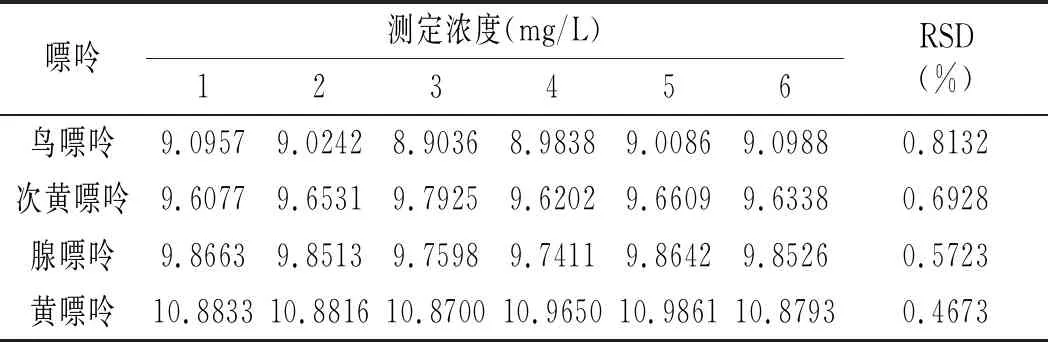
表5 精密度實驗結果Table 5 The precision test results
2.4 優化的前處理條件
2.4.1 三氟乙酸濃度對嘌呤提取率的影響
利用SPSS統計分析,以5個三氟乙酸濃度,每組3個平行實驗作因子,以總嘌呤提取率作實驗指標進行單因素方差分析,分析結果見表6和表7。
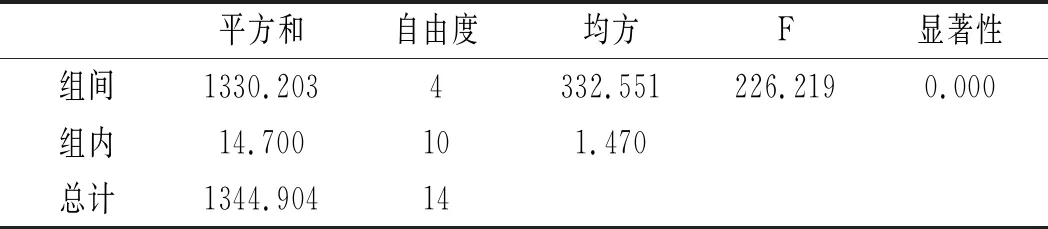
表6 雞肉-三氟乙酸濃度方差分析結果Table 6 The variance analysis results of chicken- trifluoroacetic acid concentration
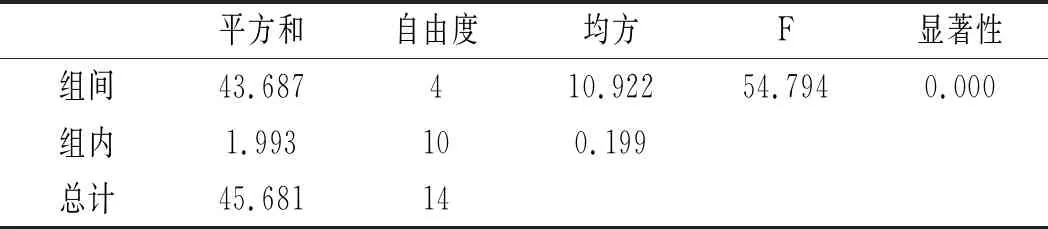
表7 雞湯-三氟乙酸濃度方差分析結果Table 7 The variance analysis results of chicken soup- trifluoroacetic acid concentration
由表6和表7可知,當其余條件固定時,三氟乙酸濃度對雞肉和雞湯中嘌呤提取率的影響顯著,其P值均為0.000<0.05。三氟乙酸濃度對雞肉和雞湯中4種嘌呤和總嘌呤提取率的影響見圖4和圖5。在濃度80%~95%之間,雞肉中鳥嘌呤隨濃度的增加而不斷上升,次黃嘌呤提取率則隨著濃度的增加不斷上升,腺嘌呤與黃嘌呤整體上呈現先上升后下降的趨勢。從總嘌呤提取率來看,當三氟乙酸濃度達到100%時總嘌呤提取率顯著下降,說明高濃度的三氟乙酸反而會降解雞肉樣品中的嘌呤,造成嘌呤損失,因此選擇95%三氟乙酸濃度作為雞肉中總嘌呤提取率最優。隨著三氟乙酸濃度的增加,雞湯中鳥嘌呤呈現先下降后上升的趨勢,腺嘌呤、黃嘌呤與次黃嘌呤的提取率呈現下降的趨勢,總嘌呤的提取率隨著三氟乙酸濃度的增加呈現不斷下降后趨于穩定的趨勢,總嘌呤提取率在三氟乙酸濃度為80%時最大,因此選擇三氟乙酸濃度為80%時雞湯中總嘌呤提取率最優。
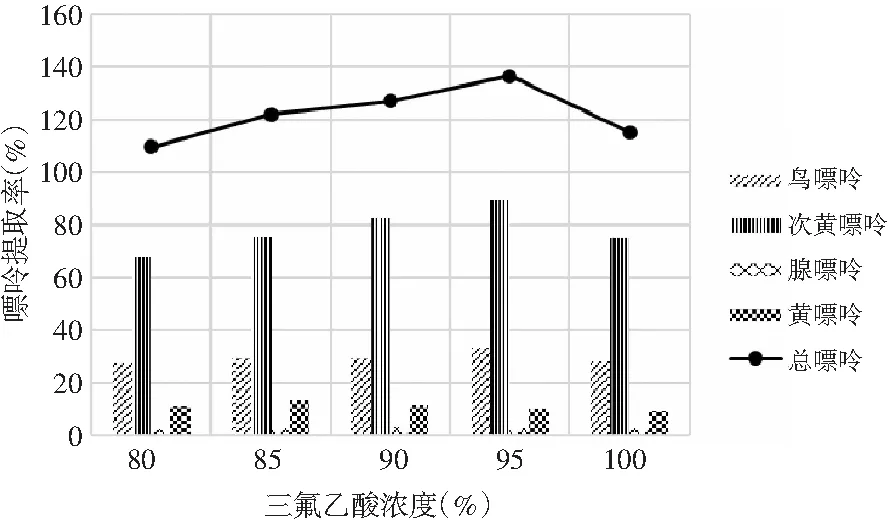
圖4 三氟乙酸濃度對雞肉中嘌呤提取率的影響Fig.4 The effect of trifluoroacetic acid concentration on the extraction rate of purine in chicken
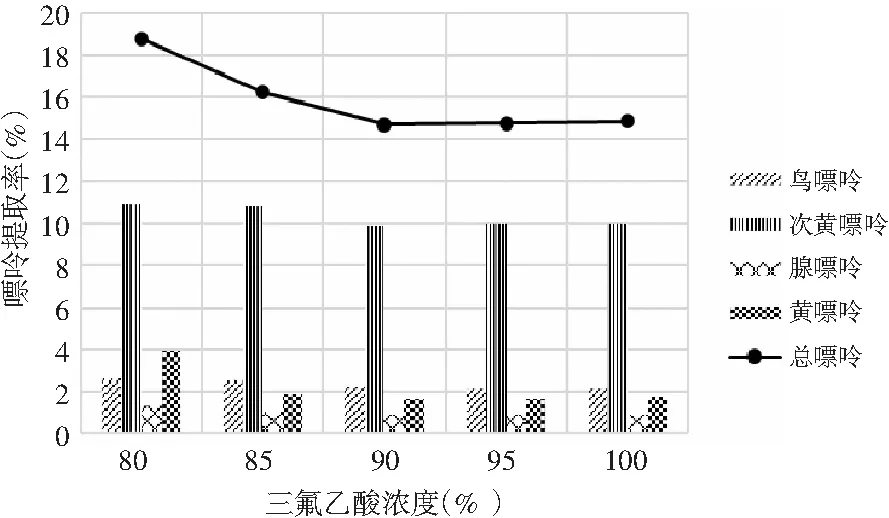
圖5 三氟乙酸濃度對雞湯中嘌呤提取率的影響Fig.5 The effect of trifluoroacetic acid concentration on the extraction rate of purine in chicken soup
2.4.2 水解溫度對嘌呤提取率的影響
利用SPSS統計分析,以5個水解溫度,每組3個平行實驗作因子,以總嘌呤提取率作實驗指標進行單因素方差分析,分析結果見表8和表9。
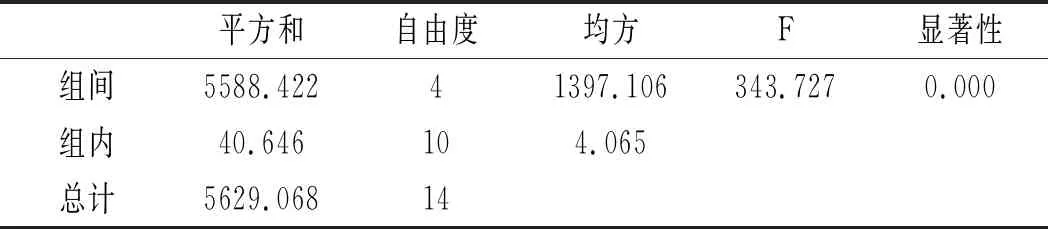
表8 雞肉-水解溫度方差分析結果Table 8 The variance analysis results of chicken- hydrolysis temperature

表9 雞湯-水解溫度方差分析結果Table 9 The variance analysis results of chicken soup-hydrolysis temperature
由表8和表9可知,當其余條件固定時,水解溫度對雞肉和雞湯中嘌呤提取率的影響顯著,其P值均為0.000<0.05。水解溫度對雞肉和雞湯中4種嘌呤和總嘌呤提取率的影響見圖6和圖7。隨著水解溫度的增加,雞肉中鳥嘌呤、次黃嘌呤、黃嘌呤整體上均呈現先上升后下降的趨勢,腺嘌呤整體上呈上升的趨勢,總嘌呤在90 ℃時有最大提取率。這是由于溫度的升高使得分子間的運動加劇,嘌呤從雞肉和雞湯樣品中的溶出速度加快。雞湯樣品中溫度對嘌呤提取率的影響與雞肉中一致,總嘌呤提取率在90 ℃時達最大。因此,選擇水解溫度為90 ℃時雞肉和雞湯中總嘌呤提取率最優。
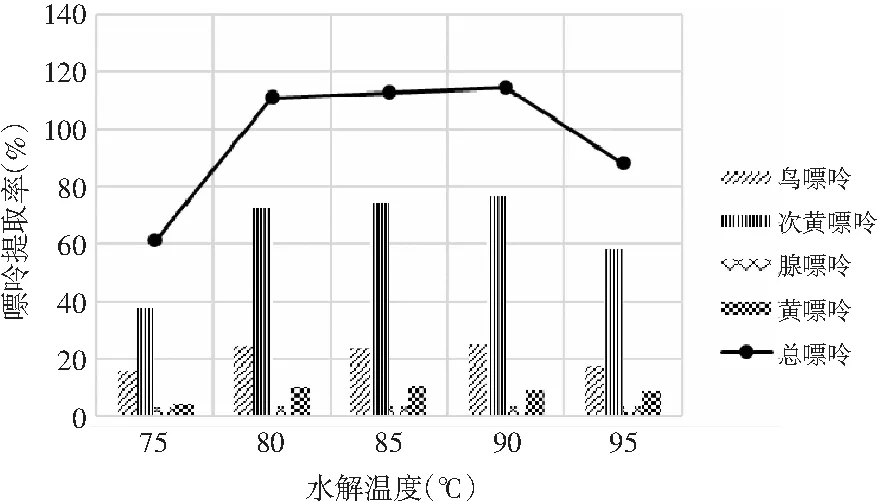
圖6 水解溫度對雞肉中嘌呤提取率的影響Fig.6 The effect of hydrolysis temperature on the extraction rate of purine in chicken
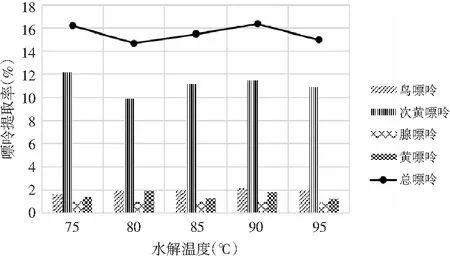
圖7 水解溫度對雞湯中嘌呤提取率的影響Fig.7 The effect of hydrolysis temperature on the extraction rate of purine in chicken soup
2.4.3 水解時間對嘌呤提取率的影響
利用SPSS統計分析,以5個水解時間,每組3個平行實驗作因子,以總嘌呤提取率作實驗指標進行單因素方差分析,分析結果見10和表11。
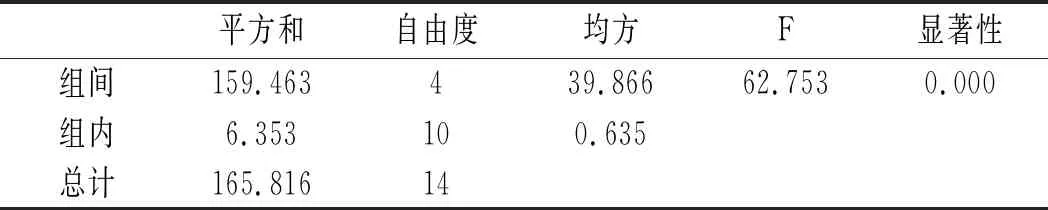
表10 雞肉-水解時間方差分析結果Table 10 The variance analysis results of chicken- hydrolysis time
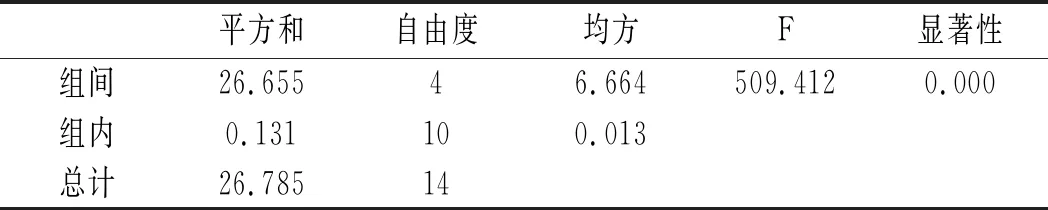
表11 雞湯-水解時間方差分析結果Table 11 The variance analysis results of chicken soup-hydrolysis time
由表10和表11可知,當其余條件固定時,水解時間對雞肉及雞湯中嘌呤提取率的影響顯著,其P值均為0.000<0.05。水解時間對雞肉及雞湯中4種嘌呤和總嘌呤提取率的影響見圖8和圖9。雞肉中鳥嘌呤、腺嘌呤、黃嘌呤含量隨著水解時間的增加呈現先上升后下降的趨勢,而次黃嘌呤則在水解5 min時提取率最大,然后呈下降的趨勢。總嘌呤含量在20 min時達最大值。雞湯樣品嘌呤提取率的變化與雞肉類似,水解20 min時總嘌呤提取率達最大值。因此,選擇水解時間為20 min時雞肉和雞湯中總嘌呤提取率最優。
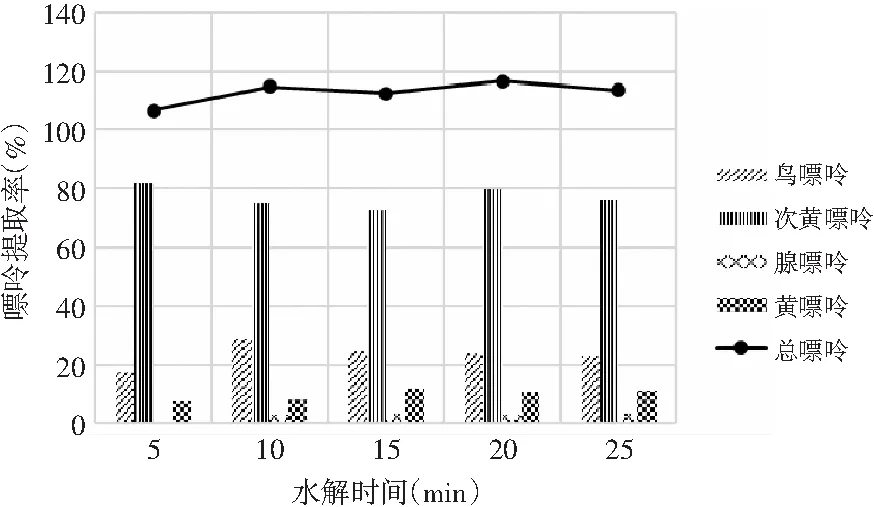
圖8 水解時間對雞肉中嘌呤提取率的影響Fig.8 The effect of hydrolysis time on the extraction rate of purine in chicken
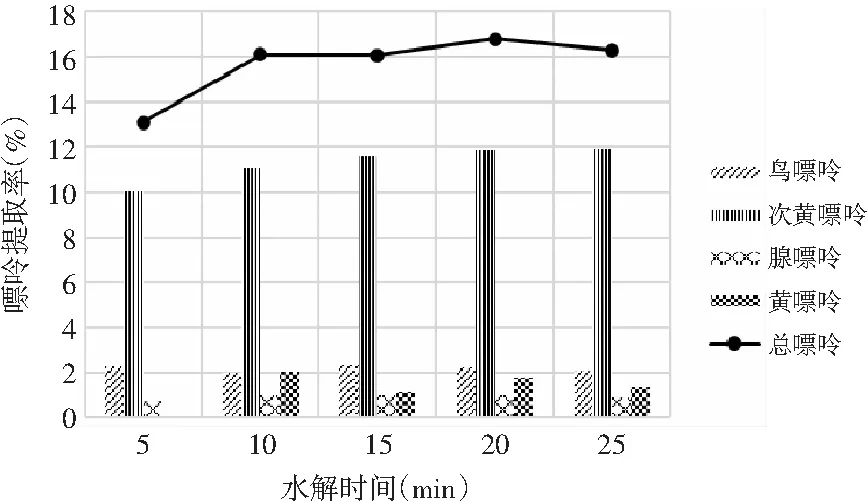
圖9 水解時間對雞湯中嘌呤提取率的影響Fig.9 The effect of hydrolysis time on the extraction rate of purine in chicken soup
2.4.4 正交實驗優化
雞肉及雞湯樣品的正交實驗優化結果見表12和表13。
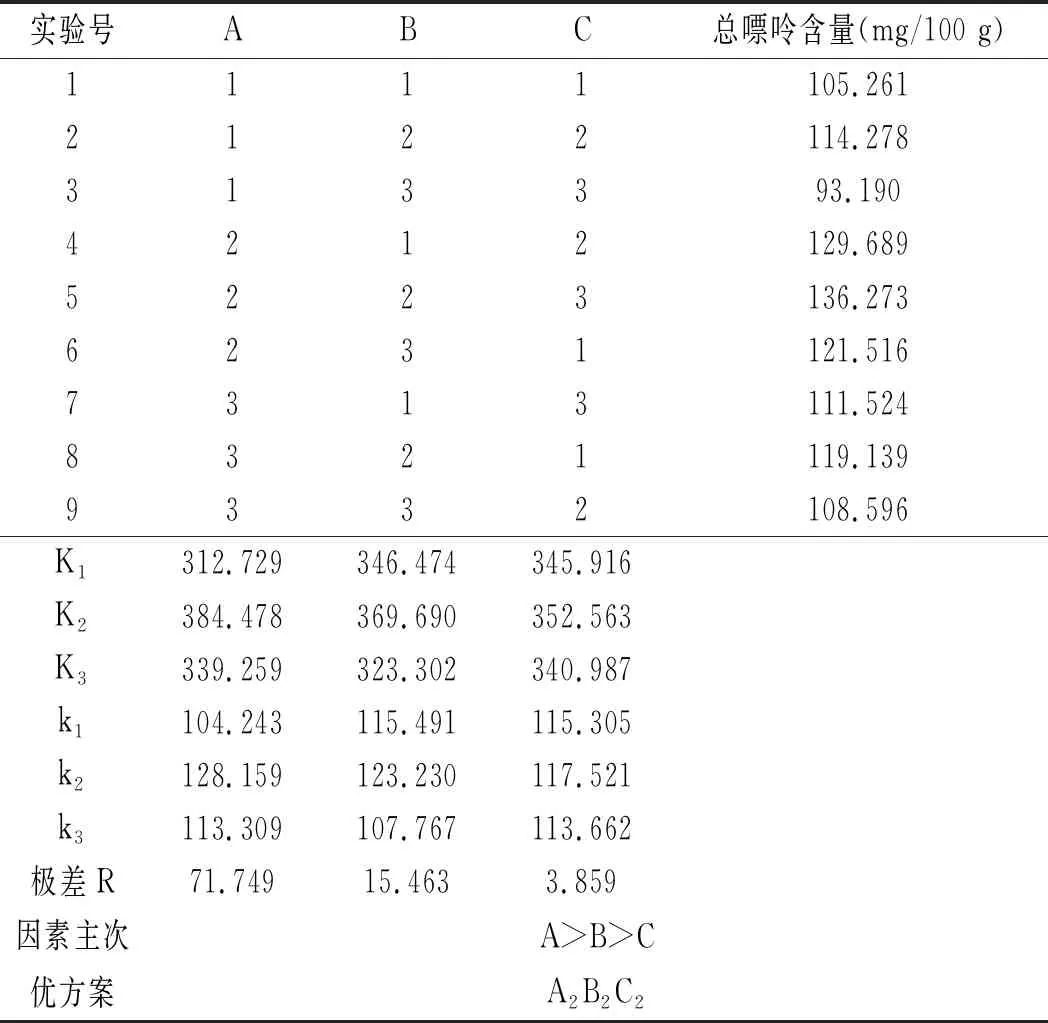
表12 雞肉前處理正交實驗結果Table 12 The orthogonal test results of chicken pretreatment
由表12可知,影響雞肉中嘌呤提取率因素的順序依次是三氟乙酸濃度>水解溫度>水解時間,最佳組合是A2B2C2,即三氟乙酸濃度為95%,水解溫度為90 ℃,水解時間為20 min。
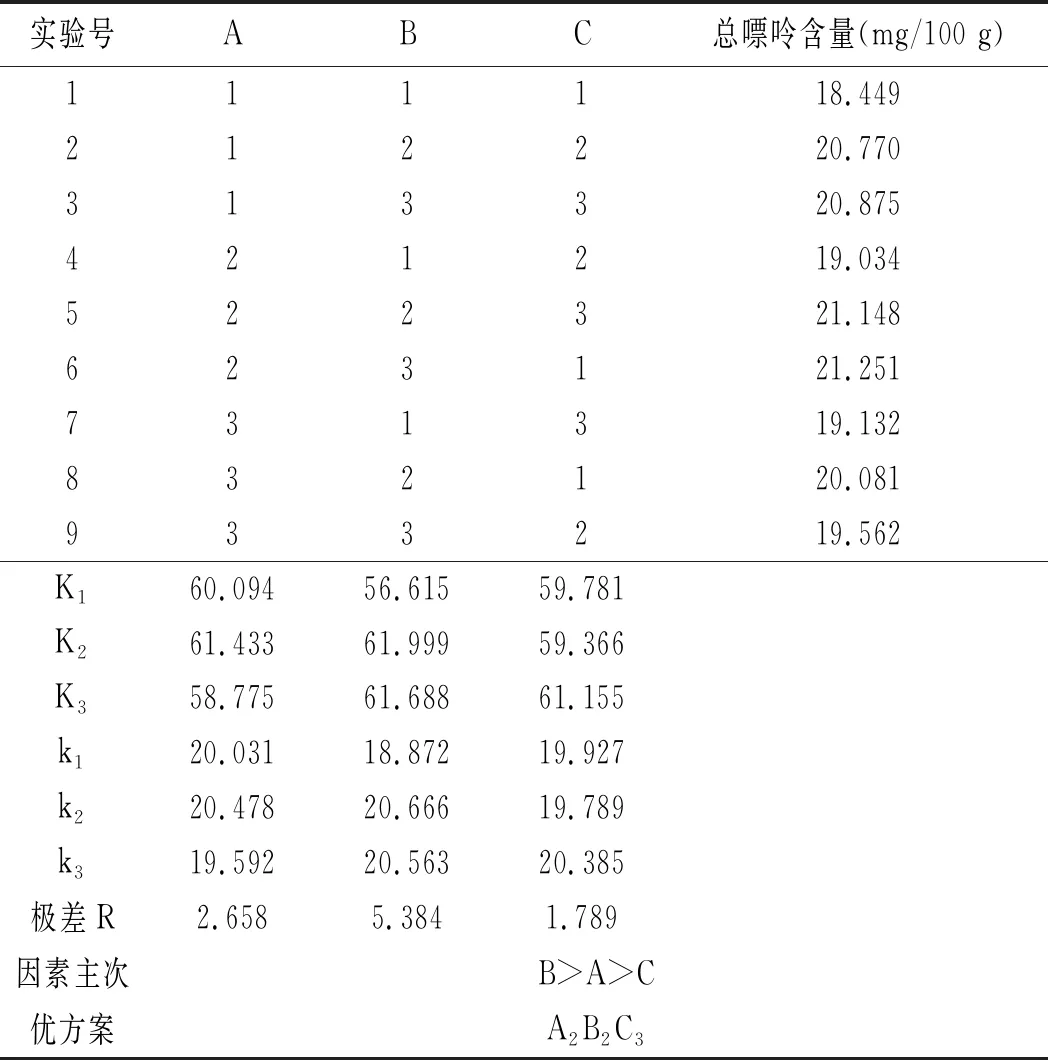
表13 雞湯前處理正交實驗結果Table 13 The orthogonal test results of chicken soup pretreatment
由表13可知,影響雞湯中嘌呤提取率因素的順序依次是水解溫度>三氟乙酸濃度>水解時間,最佳組合是A2B2C3,即三氟乙酸濃度為80%,水解溫度為90 ℃,水解時間為25 min。
2.5 重復性實驗
按照2.1與2.4節確定的最佳色譜條件與前處理條件,取雞肉樣品與雞湯樣品各6份進行處理后進樣分析,雞肉與雞湯重復性實驗結果見表14和表15。結果顯示:雞肉中鳥嘌呤、次黃嘌呤、腺嘌呤與黃嘌呤4種嘌呤含量RSD分別為7.293%、2.494%、6.527%、3.935%,雞湯中分別為2.202%、2.302%、4.705%、2.658%,重復性均較好。
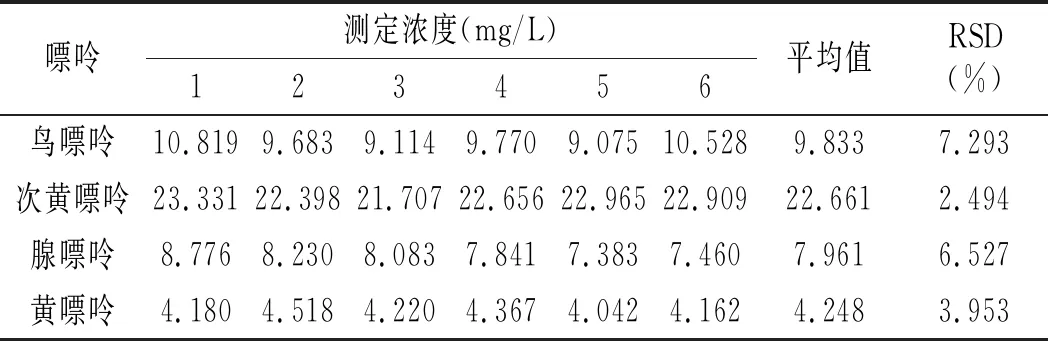
表14 雞肉重復性實驗結果Table 14 The reproducibility test results of chicken
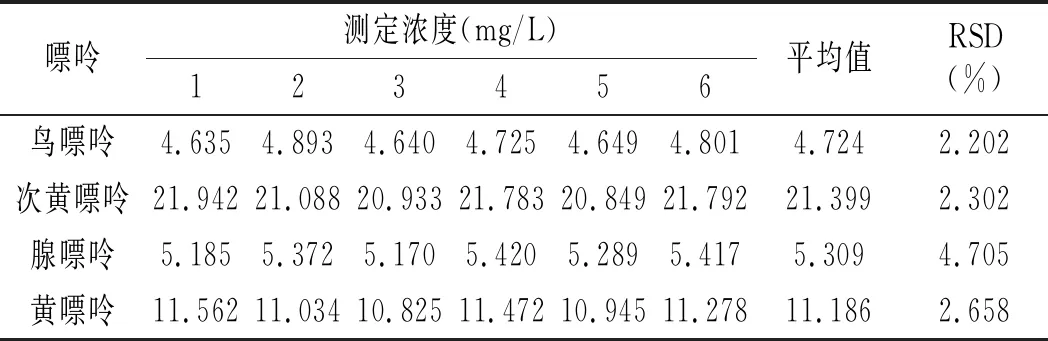
表15 雞湯重復性實驗結果Table 15 The reproducibility test results of chicken soup
2.6 加標回收率
雞肉及雞湯樣品加標回收率結果見表16和表17。雞肉樣品中鳥嘌呤、次黃嘌呤、腺嘌呤與黃嘌呤平均回收率分別為91.6343%、95.9119%、94.0015%、92.0173%,雞湯樣品中分別是94.9030%、96.6424%、94.6847%、93.3189%,說明優化的前處理條件可以有效減少提取雞肉及雞湯嘌呤過程中的嘌呤損失,能很好地提取樣品中的嘌呤。
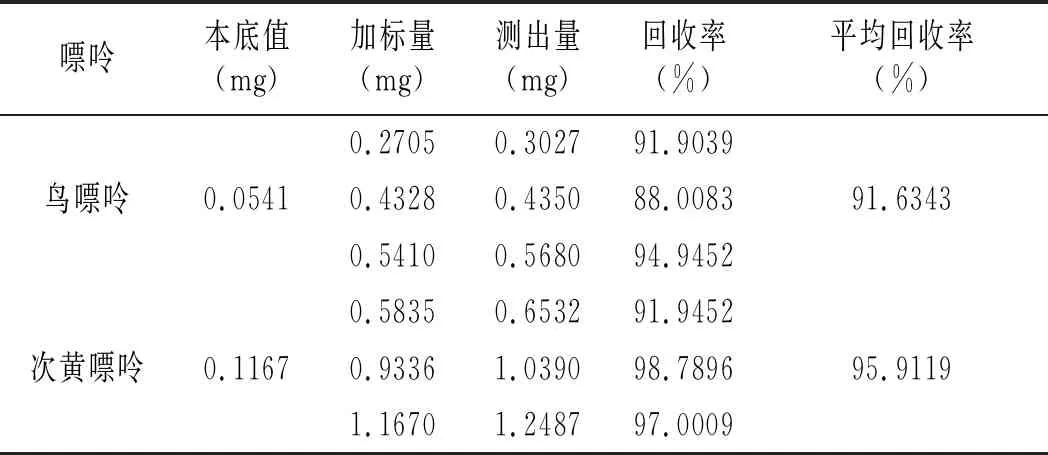
表16 雞肉加標回收實驗結果表Table 16 The chicken standard recovery experiment results
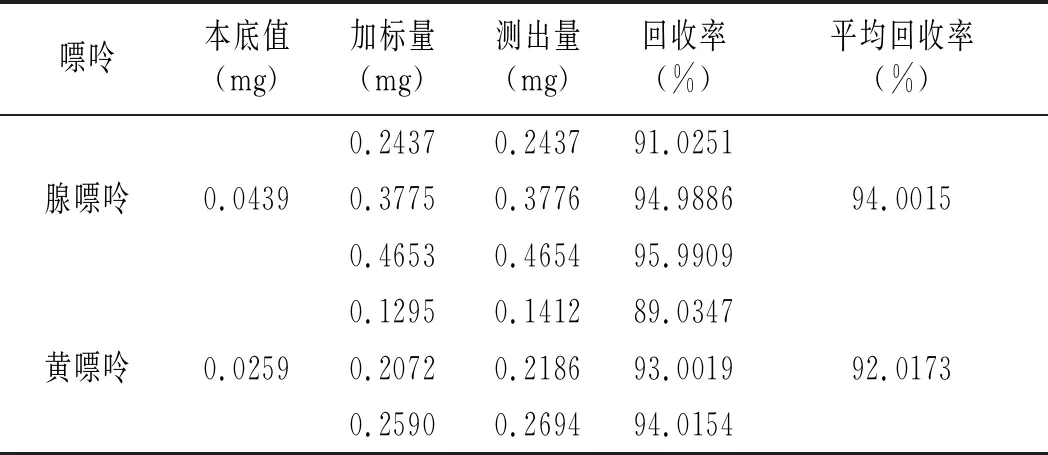
續 表
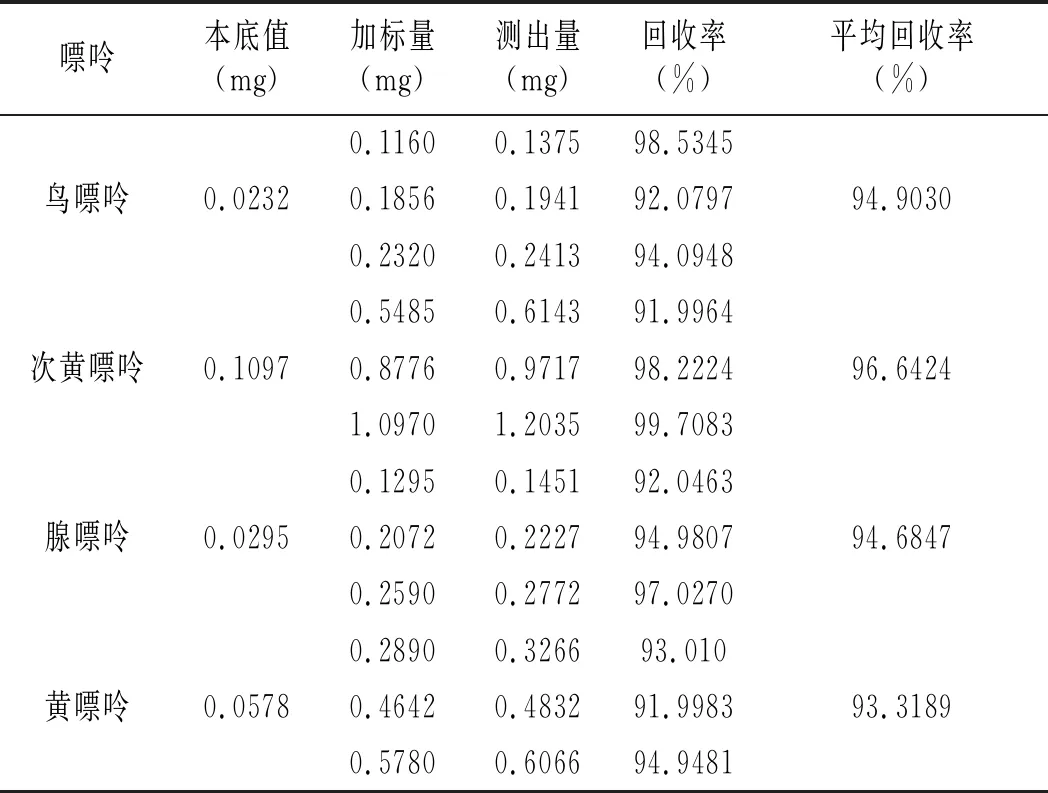
表17 雞湯加標回收實驗結果表Table 17 The chicken soup standard recovery experiment results
3 結論
本實驗確定了提取雞肉及雞湯中4種嘌呤的最佳前處理方法,并建立了同時檢測雞肉及雞湯中4種嘌呤的高效液相色譜法。使用Waters Atlantis dC18(4.6 mm×250 mm,5 μm)色譜柱,流動相為7×10-3mol/L的KH2PO4-H3PO4(pH為3.8),流速為1.0 mL/min,柱溫為30 ℃,紫外檢測器檢測波長為254 nm,進樣量為10 μL,檢測雞肉及雞湯中的鳥嘌呤、次黃嘌呤、腺嘌呤和黃嘌呤。經方法學驗證,4種嘌呤的質量濃度和峰面積在0.5~300 mg/L線性范圍內,線性關系良好,相關系數R在0.9998~0.9999之間,檢出限在0.024~0.129 mg/L范圍內,檢測方法精密度RSD為0.4673%~0.8132%。正交實驗優化混合酸提取雞肉及雞湯中嘌呤實驗結果表明,三氟乙酸濃度為95%,在90 ℃下水解20 min時,雞肉中總嘌呤的提取效果最好;三氟乙酸濃度為80%,在90 ℃下水解25 min時,雞湯中總嘌呤的提取效果最好,樣品處理重復性RSD在2.202%~7.293%之間,雞肉樣品平均加標回收率在91.6343%~95.9119%之間,雞湯樣品平均加標回收率在93.3189%~96.6424%之間,適用于檢測雞肉及雞湯中4種嘌呤含量。應用此方法測定雞肉及雞湯中的嘌呤含量可為痛風病人提供科學健康的飲食指導。

