小麥光溫敏雄性不育系穗發芽抗性鑒定及相關分子標記驗證
侯起嶺,趙昌平,楊衛兵,高建剛,陳現朝, 楊吉芳,白秀成,張立平,張風廷,孫 輝
(北京雜交小麥工程技術研究中心/雜交小麥分子遺傳北京市重點實驗室,北京 100097)
小麥穗發芽(pre-harvest sprouting,PHS)是指小麥在成熟期遇到連續陰雨天氣或處在潮濕環境下,籽粒在穗部發芽的現象。小麥穗發芽是一種世界性災害,不僅導致籽粒產量降低,而且降低小麥加工品質和種子質量[1]。小麥光溫敏雄性不育系在可育條件下繁殖,在不育條件下制種,成熟期如遇連續陰雨天氣,將嚴重降低穗發芽率較高的不育系繁殖和雜交小麥制種的種子質量。因此,抗穗發芽小麥不育系種質的挖掘和抗穗發芽品種選育是雜交小麥育種的重要課題之一。
小麥穗發芽受多種因素的影響,包括籽粒休眠特性、穗部性狀、淀粉酶活性、植物內源激素和外部環境(如溫度、濕度)等,其中籽粒休眠特性是主要因素[2-3]。小麥穗發芽的鑒定受外部環境因素影響較多,鑒定難度較大,目前主要鑒定方法有整穗發芽法、籽粒發芽法、大田發芽法、酶反應生化標記選擇法等。整穗發芽法、籽粒發芽法是常用方法;整穗發芽法能直觀反映品種的總體穗發芽抗性,籽粒發芽法主要反映籽粒的休眠特性,但不能反映品種穗發芽的綜合抗性。分子標記輔助選擇法能夠從早代準確選擇目標,開發、驗證并利用有效的分子標記是鑒定小麥穗發芽抗性的有效方法之一[4]。
小麥穗發芽的抗性機制較為復雜,是由主效基因和微效基因(QTLs)控制的遺傳性狀,根據穗發芽抗性相關的QTL位點開發有效的分子標記是分子標記輔助育種的關鍵。目前,已發現了一系列與穗發芽抗性相關的QTLs,主要集中在3AS和4AL染色體上[5]。Yang等[6]發現,Vp1基因的等位變異基因Vp1B與穗發芽抗性相關;標記Vp1B3在抗穗發芽品種中可擴增出845 bp或569 bp片段,在感穗發芽品種中可擴增出652 bp片段。Mares等[7]在小麥籽粒顏色合成相關基因(R基因)的作用機制研究中發現,位于4A染色體上的一個SSR標記Xwmc468與小麥種子的休眠特性相關。劉光輝等[4]利用發芽指數和整穗發芽率作為小麥穗發芽抗性鑒定指標,發現標記Xwmc468與穗發芽抗性相關。小麥TaSdr基因與水稻種子休眠相關基因OsSdr4是同源基因,對小麥種子休眠及穗發芽抗性起重要調控作用;基因序列分析表明,TaSdr-B1在其起始密碼子上游存在一個SNP(A/G),A類型為TaSdr-B1a,G類型為TaSdr-B1b,通過RIL群體(Yangxiaomai/Zhongyou 9507)的驗證發現,TaSdr-B1b基因型的GI(germination index)值顯著高于TaSdr-B1a基因型[8]。研究發現,TaMFT-A1基因位于小麥3AS上,可以調控小麥籽粒的休眠,抑制籽粒的萌發,與抗休眠QTL位點QTsg.osu-3A緊密關聯[9]。TaMFT-A1基因在春小麥品種中國春(Chinese Spring,CS)中與種子休眠調控有關,其Jagger等位變異類型在冬小麥和春小麥品種間存在差異[10]。Liu等[11]從白粒小麥Rio Blanco中克隆了一個位于小麥3AS染色體上的控制穗發芽抗性基因TaPHS1,該基因是TaMFT的同源基因,對小麥穗發芽抗性起正向調控作用。
小麥穗發芽抗性易受環境因素影響,很多已經開發的分子標記只在特定環境和遺傳背景下有效,很難在小麥育種中被廣泛應用,已開發的標記對于具有不同遺傳背景小麥的適用性和有效性還需要進一步驗證。鑒于此,本研究利用STS標記Vp1B3,SSR標記Xwmc468和基于小麥穗發芽抗性基因開發的KASP標記TaSdr-B1、TaMFT-721J、TaPHS1-646和TaPHS1-646,結合整穗發芽法對88份小麥光溫敏雄性不育系進行穗發芽抗性鑒定,以期篩選出抗穗發芽的不育系品系,為育種提供優質親本,同時篩選出能有效評價小麥光溫敏不育系穗發芽抗性的分子標記,為雜交小麥育種提供參考。
1 材料與方法
1.1 材 料
供試材料為北京雜交小麥工程技術研究中心選育的88份不育系,于2018年秋季在北京順義試驗基地(40°08′N,116°39′E)種植,試驗采取隨機區組排列,每份材料4行,行長1.5 m,株距 0.03 m,行距0.25 m,3次重復,常規田間管理。
1.2 方 法
1.2.1 整穗發芽率測定
參照Yang等[6]的方法并稍作調整,將穗發芽抗性水平劃分為4類,分別為高抗、中抗、中感和高感,對應的發芽率依次為0~10%、10%~30%、30%~60%和60%~100%。在小麥蠟熟期,每個品系的每個重復選取成熟一致的主莖穗10個,室溫下自然風干后置于-20 ℃冰箱存放,以維持種子休眠特性。所有供試麥穗都用0.5%的NaClO表面消毒20 min,在蒸餾水中浸泡洗凈,放在不同的塑料自封袋中,每個重復做好標記,置于25 ℃恒溫培養箱中發芽。發芽期間保持培養箱濕度,每天查看穗子發芽狀況。7 d后取出立即放置于60 ℃烘箱中烘干24 h,然后手工脫粒,記錄總穗粒數及發芽粒數,計算整穗發芽率(spike germination rate,SGR)。整穗發芽率=10個穗子總發芽籽粒數/10個穗子總籽粒數×100%。三次重復。
1.2.2 基因組DNA提取
每份材料取6~8粒種子置于鋪有濾紙的培養皿中培養,萌發后取適量葉片裝入2.0 mL的離心管中,加入鋼珠,液氮中研磨后用CTAB法[13]提取基因組DNA。
1.2.3 分子標記檢測
分子標記引物由北京六合華大基因科技有限公司合成,引物序列見表1。標記Vp1B3和Xwmc468的PCR擴增體系為20 μL,包括2×Mix混合液10 μL,模板DNA 2 μL(200 ng·μL-1),上、下游引物各1 μL(2 μmol·μL-1),ddH2O 5.0 μL;反應程序為:95 ℃預變性5 min;95 ℃變性1 min,58 ℃退火1 min,72 ℃延伸1 min ,35個循環;72 ℃延伸10 min。Vp1B3的反應產物用1.5%瓊脂糖凝膠電泳進行檢測,Xwmc468的反應產物用6%聚丙烯酰胺凝膠電泳進行檢測。
KASP標記檢測采用QuantStudioTM7 Flex實時定量PCR進行。PCR反應體系為:模板DNA 1.5 μL(50 ng·μL-1),2×Master mix 0.75 μL,引物0.0417 μL,ddH2O補充至3.0 μL。PCR反應程序為:I: 94 ℃ 15 min,1次循環;II:94 ℃變性20 s,61 ~55 ℃,60 s 10次循環(每次循環降低0.6 ℃);III:94 ℃ 20 s,57 ℃ 60 s,26次循環。以ddH2O為空白對照。

表1 抗穗發芽相關分子標記Table 1 Markers associated with PHS tolerance applied in this study
1.3 數據分析
用Excel 2010進行數據統計,采用SPSS 22.0進行方差及相關性分析。
2 結果與分析
2.1 供試不育系材料的整穗發芽率
88份供試不育系材料的整穗發芽率為 3.75%~93.23%,平均整穗發芽率為45.49%,變異系數為0.59。由表2可知,各抗性等級間小麥整穗發芽率(SGR)差異明顯,SGR小于10%的材料有10份,平均值為 6.51%,占比為11.36%,抗性等級為高抗;SGR在10%~30%之間的材料有19份,平均值為 20.23%,占比為21.59%,抗性等級為中抗;SGR在30%~60%之間的材料有25份,平均值為39.22%,占比為28.41%,抗性等級為中感;SGR在60%~100%之間的材料有34份,平均值為75.69%,占比為38.64%,抗性等級為高感。

表2 供試材料整穗發芽分析Table 2 Analysis of sprouting of the tested materials

表3 88份小麥光溫敏雄性不育系的穗發芽抗性及6個標記的擴增產物分析Table 3 PHS tolerance and amplified products of six markers in 88 wheat sterile lines
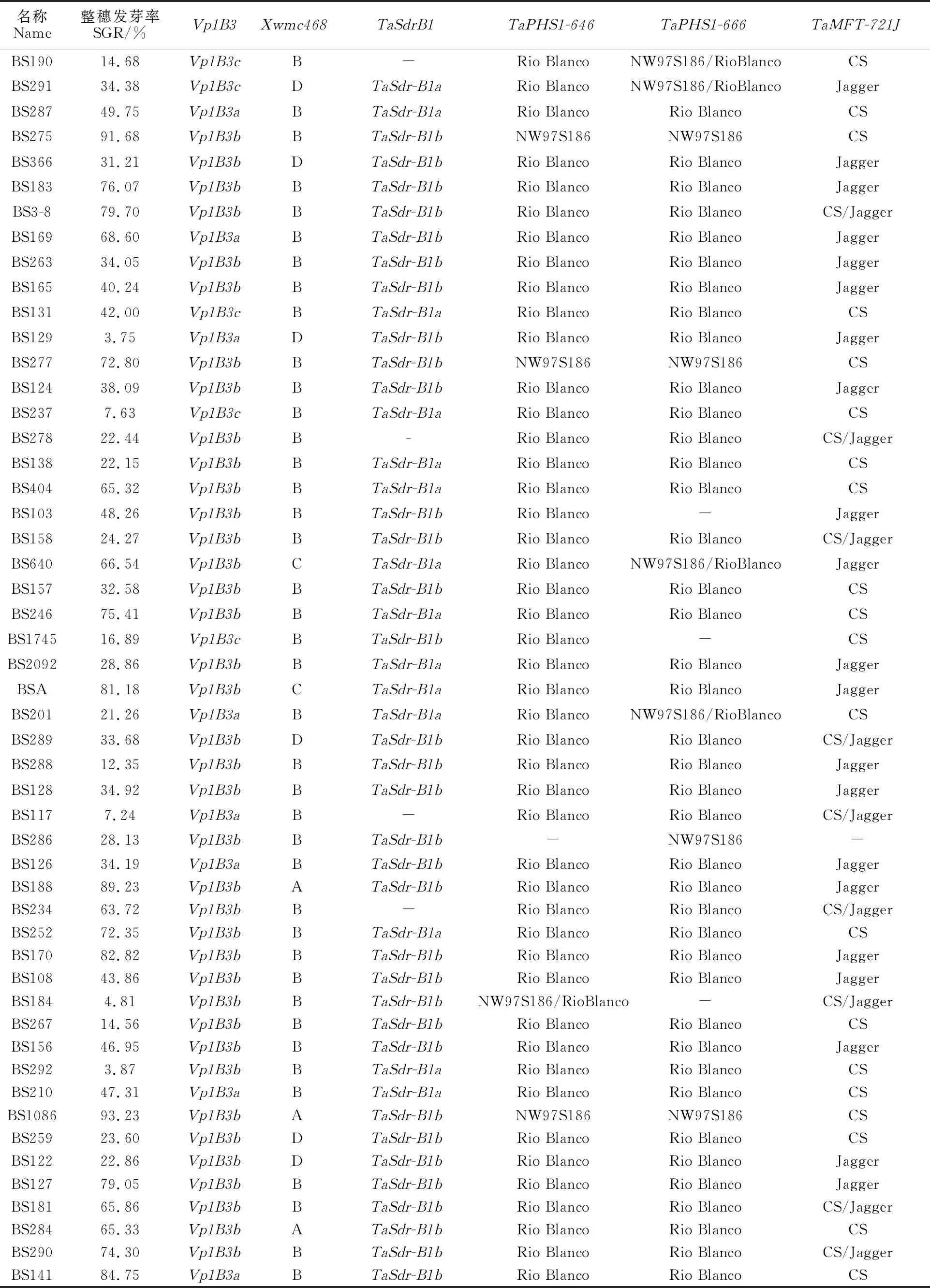
(續表3 Continued table 3)
2.2 不同穗發芽抗性標記的有效性分析
2.2.1 STS標記Vp1B3鑒定結果
由表3可知,在88份小麥光溫敏雄性不育系材料中,共擴增出片段長度為569 bp、652 bp和845 bp三種Vp1B3類型的條帶,分別命名為Vp1B3a、Vp1B3b和Vp1B3c,部分結果如圖1所示。供試材料中,擴增出Vp1B3a類型片段的有24份,占供試材料數的27.27%,平均SGR為34.73%,變化范圍為3.75%~84.75%;擴增出Vp1B3b類型片段的有59份,占供試材料數的67.05%,平均SGR為51.77%,變化范圍為 3.87%~ 93.23%;擴增出Vp1B3c類型片段的有5份,占供試材料數的5.68%,平均SGR為23.12%,變化范圍為7.63%~42.00%。相關性分析表明,Vp1B3a類型片段與SGR值呈顯著負相關關系;Vp1B3b類型片段與SGR值呈顯著正相關關系;Vp1B3c類型片段與SGR值相關性不顯著(表4)。擴增出Vp1B3a和Vp1B3c類型片段的材料的平均SGR明顯低于Vp1B3b類型片段的材料,說明標記Vp1B3可用于供試材料的穗發芽抗性鑒定。

M:D2000 marker; 1:BS104; 2:BS212; 3:BS252; 4:BS206; 5:BS283; 6:BS237.
2.2.2 SSR標記Xwmc468鑒定結果
用標記Xwmc468共擴增出A、B、C和D共4種類型的片段,部分結果如圖2所示。擴增出A類型片段的材料有9份,占總材料的10.23%,平均SGR為53.30%,變化范圍為4.73%~ 93.23%;擴增出B類型片段的材料有65份,占供試材料的73.86%,平均SGR為46.91%,變化范圍為3.87%~91.68%;擴增出C類型片段的材料有6份,占供試材料的6.82%,平均SGR為47.63%,變化范圍為8.39%~81.18%;擴增出D類型片段的材料有8份,占供試材料的 9.09%,平均SGR為23.57%,變化范圍為 3.18%~34.38%。擴增出D類型片段材料的SGR平均值明顯低于其他類型片段的材料。相關性分析表明A、B和C類型片段與SGR值的相關性均不顯著;D類型片段與SGR值呈顯著負相關(表4)。由此可見,標記Xwmc468可用于供試材料的穗發芽抗性鑒定。

1:BS265; 2:BS104; 3:BS177; 4:BS293; 5:BS283; 6:BS182; 7:BS129; 8:BS270; 9:BS485; 10:BS166; 11:BS130.
2.2.3TaSdr-B1鑒定結果
用標記TaSdr-B1在供試材料中共檢測出TaSdr-B1a和TaSdr-B1b兩種等位變異類型(圖3)。其中TaSdr-B1a等位變異類型有26份,占供試材料的29.55%,SGR平均值為45.06%;TaSdr-B1b等位變異類型有54份,占供試材料的61.36%,SGR平均值為46.33%(表3)。TaSdr-B1a和TaSdr-B1b兩種等位變異類型品系間的SGR值無顯著差異,二者與SGR的相關性均不顯著(表4)。
2.2.4TaPHS1-646鑒定結果
用標記TaPHS1-646在88份供試材料中共檢測出Rio Blanco和NW97S186兩種等位變異類型(圖3)。其中Rio Blanco等位變異類型有78份,占供試材料的88.64%,SGR平均值為 42.99%;NW97S186等位變異類型有7份,占供試材料的7.95%,SGR平均值為76.20%(表3)。Rio Blanco和NW97S186兩種等位變異類型品系間的SGR值差異顯著;Rio Blanco等位變異類型與SGR值呈顯著負相關關系,NW97S186等位變異類型與SGR值呈顯著正相關關系(表4)。表明標記TaPHS1-646可用于供試材料的穗發芽抗性鑒定。
2.2.5TaPHS1-666鑒定結果
用標記TaPHS1-666在供試材料中共檢測出Rio Blanco和NW97S186兩種等位變異類型(圖3)。其中Rio Blanco等位變異類型有64份,占供試材料的72.73%,SGR平均值為44.10%;NW97S186等位變異類型有8份,占供試材料的9.09%,SGR平均值為70.19%(表3)。RioBlanco和NW97S186兩種等位變異類型品系間的SGR值差異顯著,Rio Blanco等位變異類型與SGR值相關不顯著,NW97S186等位變異類型與SGR值呈顯著正相關(表4)。
2.2.6TaMFT-721J鑒定結果
用標記TaMFT-721J在供試材料中共檢測出Jagger和CS兩種等位變異類型(圖3)。其中Jagger等位變異類型有42份,占供試材料的 47.73%,SGR平均值為45.79%;CS等位變異類型有36份,占供試材料的40.90%,SGR平均值為46.56%(表3)。Jagger和CS兩種等位變異類型品系間的SGR值差異不顯著,二者與SGR的相關性均不顯著(表4)。

紅色點:HEX基因型;藍色點:FAM基因型;黑色點:空白對照。圖A為 TaSdr-B1標記檢測結果;圖B為 TaPHS1-646標記檢測結果;圖C為 TaPHS1-666標記檢測結果;圖D為 TaMFT-721J標記檢測結果。
3 討 論
穗發芽抗性是受多基因調控、多因素影響的復雜性狀,抗性機理十分復雜。目前已開發出很多與種子休眠或穗發芽相關的的分子標記,但這些標記對不同基因型小麥品種的有效性還需進一步驗證。本研究采用整穗發芽的鑒定方法,同時選擇6個被認為與穗發芽相關的分子標記對88份小麥光溫敏雄性不育系的穗發芽抗性進行鑒定。結果顯示,整穗發芽率低于10%的有10份,占供試材料的11.36%,表現為高抗;在10%~30%之間的有19份,占比為21.59%,表現為中抗;這說明小麥光溫敏雄性不育系中存在豐富的抗穗發芽材料。其中有4個標記的部分基因型與穗發芽抗性顯著相關,與前人研究結果一致[3-4,21]。本研究所用的6個分子標記中,Vp1B3等位變異Vp1B3a和Vp1B3b與SGR顯著相關(P<0.01);Xwmc468的D片段類型與SGR顯著相關(P<0.05);TaSdr-B1和TaMFT-721J與SGR相關不顯著;TaPHS1-646與SGR值呈顯著相關(P<0.05);TaPHS1-666的NW97S186單倍型與SGR顯著相關(P<0.01)。因此,標記Vp1B3、Xwmc468和TaPHS1-646可用于小麥光溫敏雄性不育系穗發芽抗性的分子鑒定;KASP標記TaPHS1-666可作為小麥光溫敏雄性不育系穗發芽抗性鑒定的參考標記。

表4 分子標記等位類型與SGR的相關性Table 4 Correlation between alleles and SGR
本研究發現,標記Vp1B3可用于小麥不育系穗發芽抗性鑒定,與前期研究人員的研究結果基本一致[3-4,6,12,14-17,19-25];而楊 燕等[22]發現標記Vp1B3不適合紅粒小麥抗性篩選,孫果忠等[26]認為,標記Vp1B3難以用于品種的穗發芽抗性篩選,具體原因有待更多相關研究。本研究發現,標記Xwmc468可用于小麥不育系穗發芽抗性鑒定,與劉光輝等[4],馬 麗等[16],楊 燕等[22]研究結果一致。Zhang[8]等發現,TaSdr-B1b基因型的GI值顯著高于TaSdr-B1a基因型;Nakamura等[9]發現,TaMFT基因與籽粒休眠呈正相關,而本研究發現,TaSdr基因的兩個等位變異的SGR差異不顯著,TaMFT-721J與SGR相關不顯著,與張維軍等[21]的研究結果一致。TaPHS1基因是在白粒小麥中發現的[11]。鄒景偉等[18]利用基于TaPHS1基因開發的KASP標記對120份小麥進行了抗穗發芽基因檢測,可顯著提高小麥育種效率;張維軍等[21]發現,分子標記Phs646、Phs666可用于寧夏引黃灌區小麥穗發芽抗性的分子鑒定;而本研究發現,標記TaPHS1-646與SGR顯著相關,TaPHS1-666的NW97S186單倍型與SGR顯著相關,與前人研究結果不完全一致的原因可能是穗發芽抗性與溫度、濕度、激素和穗部性狀等因素有關,另外標記對品種和生態區可能具有特異型。
本研究發現,整穗發芽率與抗穗發芽分子標記不完全對應,如BS184的SGR值為4.81%,BS286的SGR值為28.13%,分別屬于高抗和中抗穗發芽品系,但6個分子標記均未檢測到抗穗發芽基因型,推測這些材料有可能攜帶有其他未被發現的抗性基因;BS141的SGR值為 84.75%,BS169的SGR值為68.60%,BS111的SGR值為67.15%,都屬于高感穗發芽品系,但分子標記TaPHS1-646、TaPHS1-666和Vp1B3的檢測結果均為抗穗發芽基因型; BS291的SGR值為34.38%,屬于中感穗發芽品系,但分子標記TaPHS1-646、Vp1B3和Xwmc468檢測結果均為抗穗發芽基因型。這些結果說明小麥穗發芽抗性是受多基因控制的復雜性狀,受自身休眠特性、籽粒顏色、穗部性狀和外源激素等因素影響;現有的分子標記都是在特定的生態區和不同材料構建群體開發出來的,對品種具有特異性。因此,小麥穗發芽抗性鑒定要綜合利用表型鑒定和分子鑒定,對不同區域不同類型的材料進行分子鑒定時要進行有效性檢驗,鑒定結果會相對準確。
綜合整穗發芽抗性鑒定和分子標記檢測結果,篩選出BS212、BS143、BS206、BS129、BS117和BS237共計6份具有較低SGR值的不育系種質資源。在小麥光溫敏雄性不育系選育和強優勢組合配制中可以對這6份不育系材料加以利用。

