探究ADAMTS1對非小細胞肺癌血管生成及預后的影響*
陳大明,王 布,項保利,黃攀登,苑 程,趙建清△
(河北北方學院附屬第一醫院:1.輸血科;2.呼吸內科,河北張家口 075000)
非小細胞肺癌(NSCLC)是我國十分常見的惡性腫瘤,具有進展快、易轉移、病死率高等特點[1]。腫瘤血管生成是腫瘤生長和轉移的基礎,有效抑制腫瘤組織的血管生成對控制其復發和轉移具有積極意義[2]。血小板結合蛋白基序的解聚蛋白樣金屬蛋白酶(ADAMTS)家族屬于分泌型蛋白酶,有19個亞型,參與機體多種生理及病理過程,包括止血、關節炎和腫瘤發生等[3]。Ⅰ型ADAMTS(ADAMTS1)是ADAMTS家族中的一種亞型[4]。近年來有研究表明,ADAMTS1在結腸癌等多種腫瘤組織中起了重要作用,具有抗血管生成作用[5]。然而目前關于ADAMTS1在NSCLC中的表達情況少有報道。本次筆者就ADAMTS1 mRNA表達水平對NSCLC血管生成及患者預后的影響展開研究,現報道如下。
1 資料與方法
1.1一般資料 隨機選擇本院2014年1—10月因診斷NSCLC并行外科手術切除的患者68例,其中男性38例,女性30例,年齡37~69歲,平均(53.5±1.5)歲。納入標準:(1)入組資料完整;(2)均為首發,術前未行放、化療;(3)均經病理診斷證實。其中鱗狀上皮細胞癌25例,腺癌22例,大細胞癌21例;分化類型中,高分化7例,中分化21例,低分化40例;臨床分期Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期36例;有淋巴結轉移27例,無淋巴結轉移41例。所有患者及家屬均簽署知情同意書,自愿入組。
1.2方法
1.2.1標本處理 每例患者分別取肺癌組織及距腫瘤切緣>5 cm的癌旁正常肺組織(簡稱癌旁組織)。所有組織均分為2塊,一部分加入Trizol試劑(約每1 mm3組織中加入1 mL Trizol),置于-80 ℃冰箱保存,另一部分利用石蠟包埋,制成切片。
1.2.2實時熒光定量聚合酶鏈反應(qPCR) 參照Trizol試劑說明書和反轉錄試劑盒說明書,將肺癌組織及癌旁組織中的RNA在低溫下提取并反轉錄成cDNA。ADAMTS1的上游引物為5′-CCTGGTGGTGGTGA AGAT-3′,下游引物為5′-TTCACCACCACCAGGCTAAC-3′;血管內皮生長因子(VEGF) mRNA的上游引物為5′-G GCAGAATCATCACGAAGT-3′,下游引物為5′-CACAGGATGGCTTGAAGAT-3′;選取β -actin作為內參,上游引物為5′-AGATCAAGATCATTGCTCCTC-3′,下游引物為5′-ACTCGTCA TACTCCTGCTT-3′。反應條件:94 ℃預變性10 min,94 ℃變性45 s,退火45 s,72 ℃延伸45 s,經過35個循環擴增后,72 ℃ 7 min。PCR產物進行2%瓊脂糖凝膠電泳,采用GelPro Analysizer 3.1軟件進行半定量分析,計算得到相對表達量[6-9]。
1.2.3微血管密度(MVD)測定 參照Weidner法[10],首先在低倍鏡(10×10)下掃描整張切片,找到“熱點區”,即FⅢ Ag明顯染為棕褐色的微血管區。然后換為高倍鏡(10×40)下觀察計數。在腫瘤組織之間及腫瘤組織與周圍結締組織之間每一個被染為棕褐色的細胞或細胞簇計數為1個血管,最終結果以3個視野的平均數表示[11-12]。
1.3術后隨訪 分別于術后1個月、3個月、6個月進行隨訪,之后每半年隨訪一次,并記錄患者的術后腫瘤復發、死亡等情況,隨訪5年。
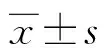
2 結 果
2.1NSCLC原位灶及癌旁組織中ADAMTS1、VEGF mRNA表達水平及MVD檢測結果比較 qRT-PCR結果顯示,NSCLC組織中ADAMTS1 mRNA表達水平低于癌旁組織, VEGF mRNA表達水平、MVD高于癌旁組織,差異均有統計學意義(P<0.05)。見圖1。

注:A為NSCLC原位灶與癌旁組織ADAMTS1 mRNA表達水平比較;B為NSCLC原位灶與癌旁組織VEGF mRNA表達水平比較;C為NSCLC原位灶與癌旁組織MVD比較。NSCLC原位灶與癌旁組織比較,*P<0.05。
2.2NSCLC原位灶中ADAMTS1 mRNA的表達水平與VEGF mRNA表達水平及MVD的相關性 由相關性結果分析可得,NSCLC原位灶中ADAMTS1 mRNA的表達水平與VEGF mRNA表達水平及MVD呈負相關。NSCLC原位灶中ADAMTS1 mRNA的表達水平越低,其VEGF mRNA水平越高,MVD測定越多。見圖2。

注:A為NSCLC原位灶中ADAMTS1與VEGF mRNA表達水平的相關性;B為NSCLC原位灶中ADAMTS1的表達水平與MVD的相關性。
2.3NSCLC原位灶中ADAMTS1 mRNA的表達水平與NSCLC病理特征的相關性 ADAMTS1 mRNA在NSCLC原位灶中的表達水平與患者性別、年齡、吸煙史、腫瘤位置、病理類型、分化程度無相關性,差異均無統計學意義(P>0.05)。見表1。

表1 ADAMTS1 mRNA的表達水平與NSCLC病理特征的相關性

續表1 ADAMTS1 mRNA的表達水平與NSCLC病理特征的相關性
2.4ADAMTS1 mRNA的表達水平與TNM分期的相關性 ADAMTS1 mRNA在NSCLC原位灶中的表達水平與TNM分期相關,TNM分期越高,NSCLC患者ADAMTS1低表達的比例越高,差異有統計學意義(P<0.05)。見表2。

表2 ADAMTS1 mRNA的表達水平與TNM分期的相關性
2.5NSCLC中ADAMTS1 mRNA的表達水平與患者預后的相關性 生存曲線顯示,低表達水平的ADAMTS1的NSCLC患者生存率下降;Cox比例風險模型分析顯示,NSCLC患者原發灶中ADAMTS1 mRNA的表達水平是影響患者預后的危險因素。ADAMTS1 mRNA的表達水平越低,患者預后越差。見圖3、表3。

圖3 ADAMTS1 mRNA的表達水平對NSCLC患者生存率的影響

表3 Cox比例風險模型生存分析結果
3 討 論
ADAMTS家族屬于分泌型蛋白酶,有19個亞型,可由多種細胞合成和分泌,參與機體多種生理及病理過程,包括止血過程、器官生成、血管生成、關節炎和癌癥等,其與基質金屬蛋白酶(MMPs)相同,二者均屬于金屬蛋白酶,結構非常相似[13-15]。目前對MMPs在生命活動中的功能已有大量研究,但對ADAMTS家族的研究并未深入[16]。對于ADAMTS結構的研究發現,ADAMTS家族含有多個結構域,其主要結構特點是C-端含有凝血酶敏感蛋白(TSP)基序[17]。ADAMTS1是ADAMTS家族中的一種亞型[18]。有研究結果表明,ADAMTS1在多種腫瘤組織中起重要作用,具有抗血管生成作用[19],但關于ADAMTS1在NSCLC中的表達情況少有報道。筆者就ADAMTS1表達水平對NSCLC血管生成及患者預后的影響展開本次研究。
本研究結果顯示,ADAMTS1 mRNA在NSCLC原位灶與癌旁組織中存在差異性表達。ADAMTS1 mRNA在NSCLC原位灶中的表達水平遠遠低于癌旁組織,且VEGF mRNA表達水平及MVD高于癌旁組織。該結果提示ADAMTS1的低表達水平可能與NSCLC的發生有關,表明ADAMTS1是一個腫瘤生長抑制因子。相關性分析指出,NSCLC原位灶中ADAMTS1 mRNA的表達水平與VEGF mRNA表達水平及MVD呈負相關,低表達水平的ADAMTS1可能促進腫瘤組織中血管的生成,高表達水平可能會抑制血管的生成,表明ADAMTS1也是一個腫瘤血管生成抑制因子,這與很多研究報道中結果相一致。有研究報道指出,在體外試驗中,ADAMTS1 C-末端TSP1基序能夠結合內皮生長因子,從而抑制VEGF 165達到抑制血管內皮細胞增殖的作用; 另外ADAMTS1也可與成纖維細胞生長因子-2(FGF2)共同作用,導致FGF2裂解,產生TSP,釋放出具有抗血管生成片段,該片段同樣通過抑制血管內皮細胞增殖,達到抑制血管新生的作用[20-21]。本研究推測ADAMTS1是通過抑制血管內皮細胞增殖從而抑制新生血管生成,低表達水平的ADAMTS1對新生血管的抑制作用降低,從而表現出NSCLC原位灶中ADAMTS1 mRNA的表達水平與VEGF mRNA表達水平及MVD呈負相關。
本研究證明了ADAMTS1 mRNA的表達水平與肺癌患者病理特征和TNM分期的相關性。研究結果顯示,ADAMTS1 mRNA的表達水平與肺癌患者病理特征無關,而與TNM分期相關。腫瘤血管生成是腫瘤生長和轉移的基礎,這與上述結果相互印證。目前有研究表明,腫瘤在頭頸部癌轉移灶中ADAMTS1 mRNA的表達水平高于原發癌灶,且ADAMTS1在經淋巴結轉移后的病灶中的表達水平高于無淋巴結轉移及原發灶,對于其具體機制目前研究尚不十分清楚,這與本研究中ADAMTS1 mRNA的表達水平與TNM分期相關相吻合[22]。目前研究發現ADAMTS1與多種腫瘤組織預后相關,如:結腸癌等[23]。本研究通過Cox分析顯示,NSCLC患者原發灶中ADAMTS1 mRNA的表達水平是影響患者預后的危險因素。 ADAMTS1 mRNA的表達水平越低,患者預后越差。生存曲線顯示低表達水平ADAMTS1的NSCLC患者生存率下降。該結果表明ADAMTS1 mRNA表達水平與NSCLC患者預后呈負相關。該結果表明,ADAMTS1是影響NSCLC患者預后的重要因素之一,其主要機制或與ADAMTS1抑制腫瘤中血管內皮細胞增殖,抑制新生血管的生成有關。
4 結 論
ADAMTS1可能是一種NSCLC生長抑制因子,低表達水平的ADAMTS1可能促進NSCLC組織中血管生成,是患者預后不良的重要影響因素,其機制可能與抑制NSCLC組織中血管內皮細胞增殖及新生血管的生成有關。ADAMTS家族在機體生命活動中所產生的作用及其作用機制目前尚不清楚,對于ADAMTS1在NSCLC的病理病程中的作用機制尚需進一步探討。

