超重力強化堿液氧化吸收脫除NO的研究
李秋瑾,楊鑫,李瑞,賈麗娟,常玉,劉天成
(1.云南民族大學 化學與環境學院 云南省高校民族地區資源清潔轉化重點實驗室,云南 昆明 650500;2.云南技師學院 化學與制藥系,云南 昆明 650500)
中國NOx排放有近70%來自于煤炭的直接燃燒[1-3],其中燃煤鍋爐排放的NOx占90%以上,NOx的大量排放對環境造成壓力的同時,也危害動植物健康,因而NOx控制問題日趨嚴峻[4-7]。
目前,燃煤鍋爐成為固定源大氣污染控制重點[8]。Wang等[9-10]對O3氧化NO研究表明,O3對NO的氧化效果好,但是運行成本高,同時考慮到O3對環境會造成一定負擔,限制O3氧化技術進一步發展。
本實驗首先探究H2O2和Ca(OH)2的最佳脫除濃度,H2O2作為氧化劑、Ca(OH)2作為吸收劑協同旋轉填充床(RPB)強化吸收脫除NO。實驗原理為雙組分吸收液中H2O2分解出HO·,將煙氣中水溶性極低的NO氧化為溶解性更強的高價態NOx,再用 Ca(OH)2溶液進行吸收,從而實現煙氣脫硝[11]。
1 實驗部分
1.1 材料與儀器
雙氧水(H2O2)、氫氧化鈣、高錳酸鉀等均為分析純;NO(濃度,1.001%);O2(濃度,99.2%);N2(濃度,99.999%)。
超重力旋轉填充床(RPB),自制;KANE9506煙氣分析儀;D08-4F質量流量計;BT100-1J蠕動泵。
1.2 實驗原理
實驗中模擬煙氣由NO、O2和N2組成,NO不易溶于水,但是因為NO帶有自由基,這使它的化學性質非常活潑,與模擬煙氣中的O2發生反應,被氧化成NO2。雙氧水具有強氧化性也會將NO氧化,盡可能地提高了NO的氧化率。最后用Ca(OH)2溶液進一步吸收NO2、N2O4等NOx,達到NO有效脫除。反應機理如下:
2NO+O2=2NO2
(1)
2NO2=N2O4
(2)
NO+NO2=N2O3
(3)
H2O2+NO=NO2+H2O
(4)
N2O3+H2O=2HNO2
(5)
N2O4+H2O=HNO2+HNO3
(6)
NO+NO2+H2O=2HNO2
(7)
2NO2+H2O=HNO2+ HNO3
(8)
Ca(OH)2+2H+=Ca2++H2O
(9)
2HNO2+Ca(OH)2=Ca(NO2)2+ 2H2O
(10)
由上述機理可以看出,NO被氧化成NO2后較易去除,要提高NOx的脫除率,主要是提高NO氣體的氧化率,其次是提高NO2在吸收液的吸附能力。NOx在水中的存在形態較為復雜,溶于水中的NOx可以被液相中的氧化劑氧化成鈣鹽。
1.3 實驗方法
實驗裝置見圖1,主要由四個部分組成,模擬煙氣裝置、RPB反應裝置、煙氣檢測裝置和尾氣處理裝置。實驗中模擬煙氣NO、O2和N2的混合氣體通過質量流量計,在混合罐混合均勻后,通過RPB上端的氣體入口進入反應腔內,而吸收劑由蠕動泵帶入到RPB下端,吸收劑與氣體逆流接觸,電機帶動旋轉填充床高速旋轉,吸收劑在高速旋轉的反應器內被分散、破碎形成不斷更新的表面積,吸收液與逆流進入的模擬煙氣充分接觸,強化了傳質的過程。進出口煙氣由煙氣分析儀檢測。經過充分吸收后,煙氣進入盛有高錳酸鉀的尾氣處理系統進行尾氣處理。
模擬煙氣流量為0.3 L/min,液相流量為 0.1 L/min,O2的體積分數為4%,NO的體積分數為0.05%,N2作為平衡氣體。旋轉填充床的最佳轉速900 r/min[12],配制不同吸收劑,探究NO的脫除效率的最佳實驗條件。NO脫除率(η,%)的計算公式如下:
式中Cin——入口NO的濃度,mg/m3;
C——出口NO的濃度,mg/m3。
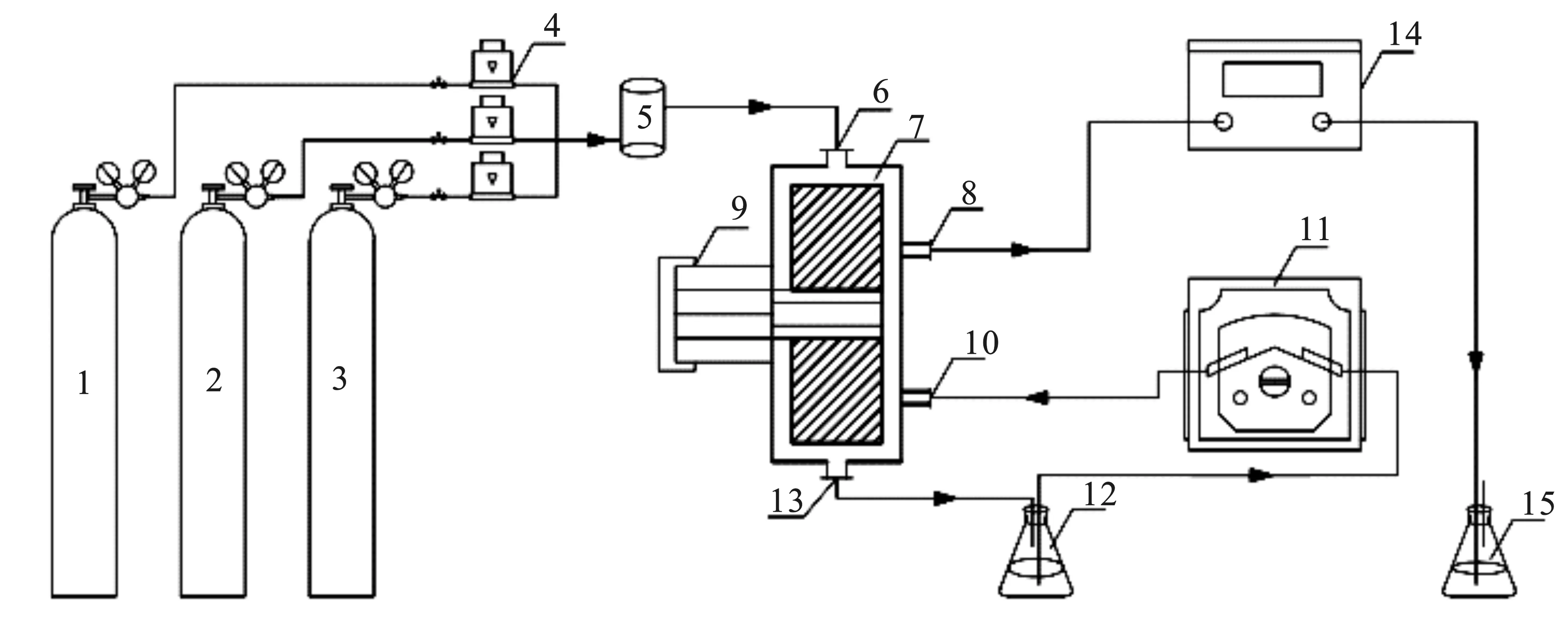
圖1 實驗裝置流程圖Fig.1 Experimental device flow chart1.N2;2.O2;3.NO;4.質量流量計;5.緩沖罐;6.RPB氣體入口;7.旋轉填充床;8.氣體出口;9.電機;10.吸收液入口;11.蠕動泵;12.吸收液;13.吸收液出口;14.煙氣分析儀;15.尾氣吸收裝置
2 結果與討論
2.1 H2O2濃度對NO脫除率的影響
模擬煙氣流量為0.30 L/min,液相流量為0.10 L/min,O2體積分數4%,旋轉填充床轉速900 r/min,考察H2O2溶液濃度對NO脫除率的影響,結果見圖2。
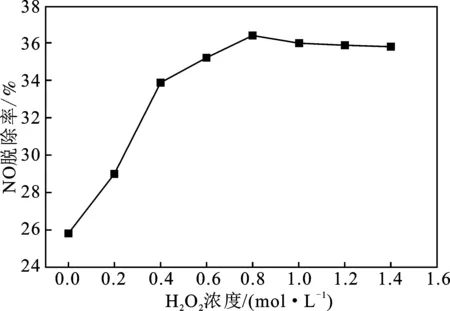
圖2 H2O2濃度對脫硝率的影響Fig.2 Effect of H2O2 concentration on denitration rate
由圖2可知,在超重力強化作用下水吸收NO,NO的脫除率為25.80%,說明混合氣體在氣路管道直至混合罐的過程中,一部分不易溶于水的NO氣體已經被O2氧化成易溶于水的NO2,部分水分解出羥基自由基HO·,也能對NO起到氧化作用,氧化產物最后溶于水形成HNO3和HNO2。RPB加強氣體與水的接觸,使NO的脫除效率高于用水作為吸收液的,但是水單獨吸收NO的能力有限,隨著H2O2的濃度的逐漸升高,H2O2溶液更容易分解出HO·,能夠提高NO的氧化效率。NO的脫除率隨著H2O2溶液濃度的增加而升高,達到一定值后呈現平緩趨勢。H2O2對NO的氧化效率有限的主要原因是高濃度的H2O2溶液容易發生副反應,消耗掉一部分HO·自由基,降低了體系的氧化能力[13],不利于NO的吸收。
2.2 Ca(OH)2濃度對脫硝效率的影響
氫氧化鈣作為堿性吸收液時,以相同的實驗條件,考察不同Ca(OH)2的濃度對NO脫除效率的影響,結果見圖3。
由圖3可知,NO的脫除率隨Ca(OH)2濃度增加而升高,濃度0.03 mol/L時NO的脫除率最高,均保持在70%以上。這是因為不易溶于水的NO被氧化成易溶于水的NO2,且NO2溶于水后形成HNO2和HNO3,這些酸類物質可以和Ca(OH)2溶液發生中和反應,NO2溶于水的量增加,使NO的脫除效率升高。當Ca(OH)2溶液濃度達到0.05 mol/L時,NO脫除效率反而呈現下降趨勢,NO的脫除率在50%左右。在化學吸收過程,因為NO的轉化率有限,所以當吸收劑濃度升高也不會提高NO的脫除率,反而對NO脫除有抑制作用。
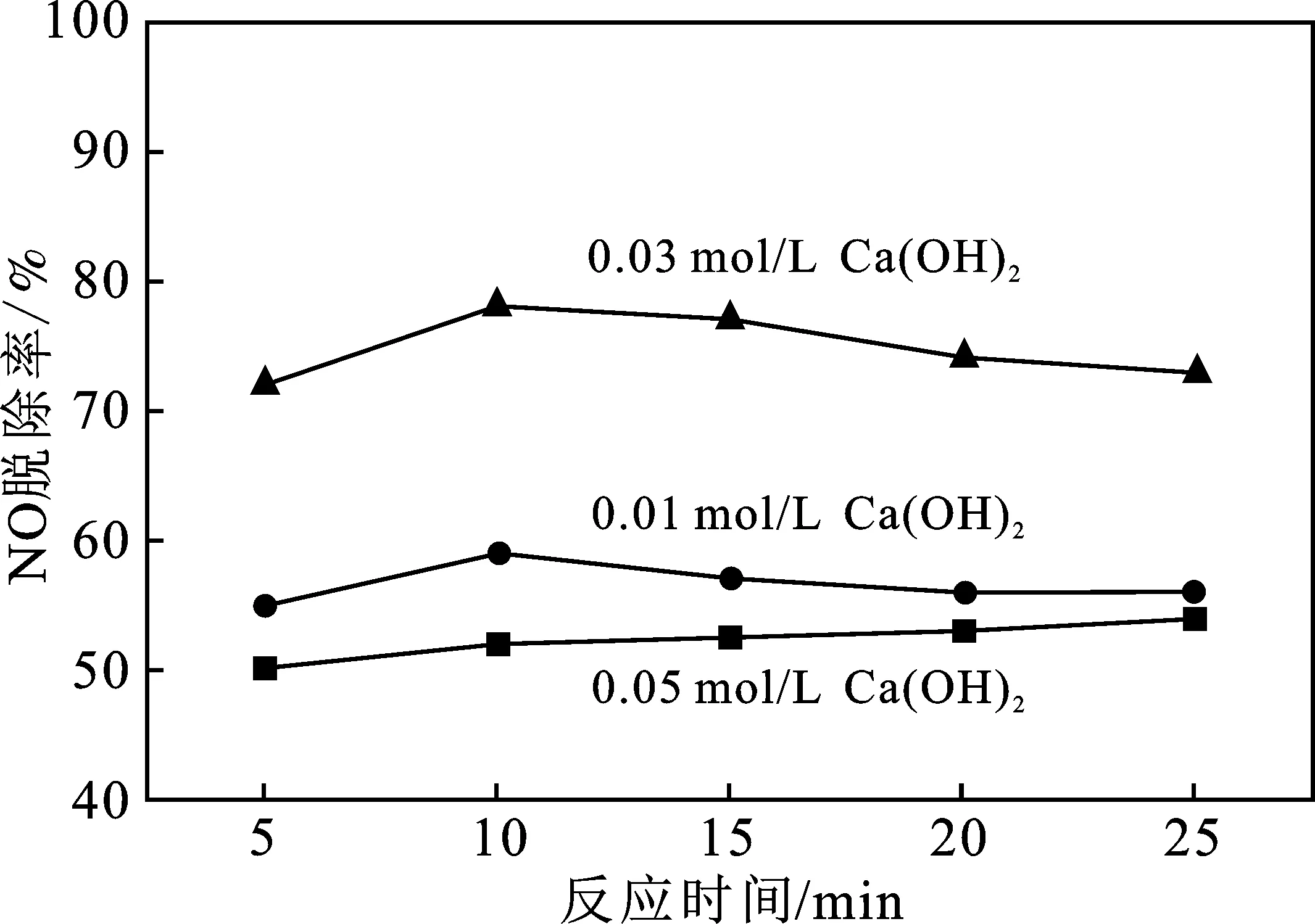
圖3 Ca(OH)2濃度對脫硝效率的影響Fig.3 Effect of Ca(OH)2 concentration ondenitration efficiency
2.3 單一吸收液與復合吸收液對比實驗
將最佳條件下的0.03 mol/L Ca(OH)2單一吸收液、0.80 mol/L H2O2單一吸收液和體積比為1∶1的0.03 mol/L Ca(OH)2+0.80 mol/L H2O2雙組分吸收液進行對比實驗,結果見圖4。
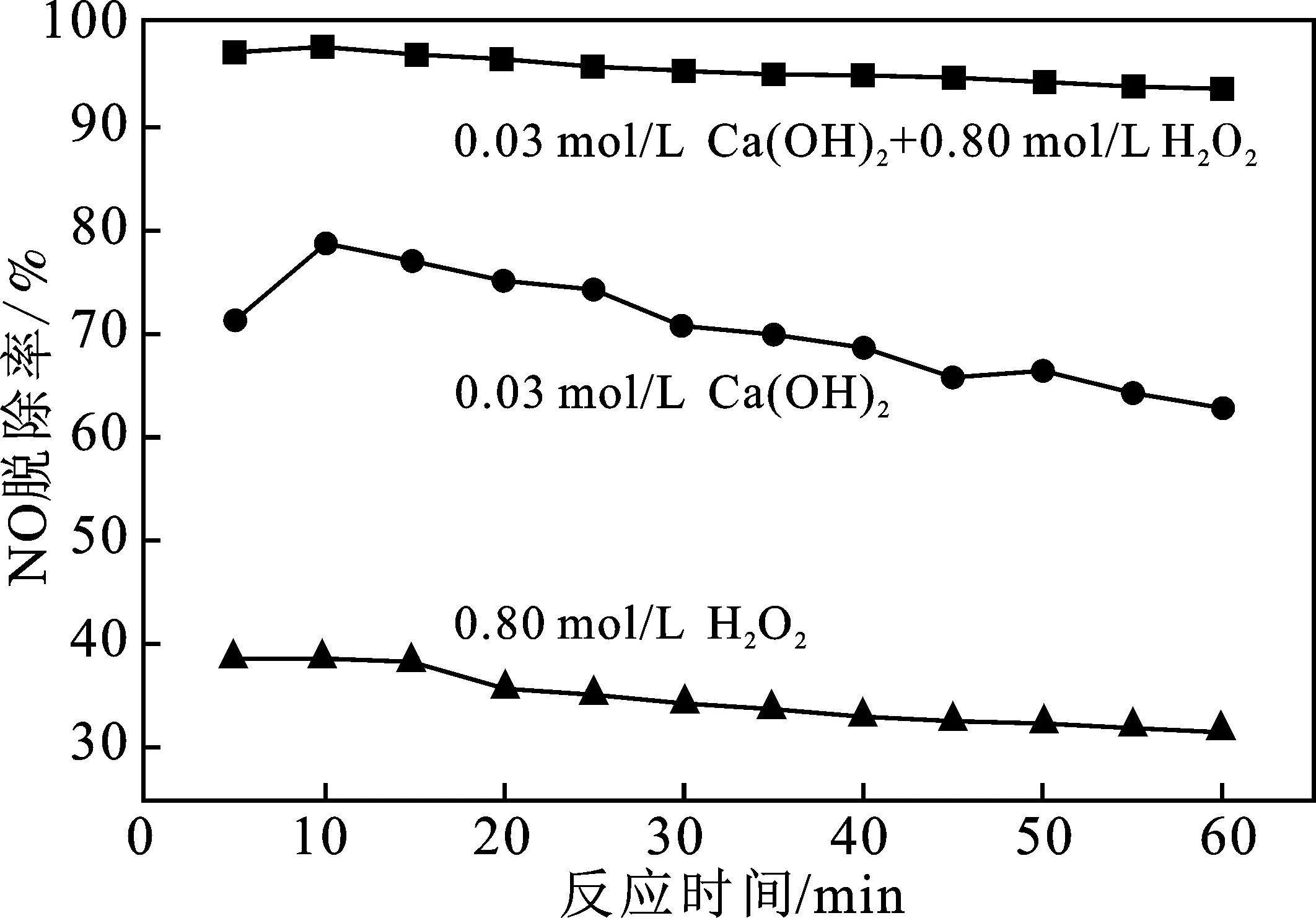
圖4 單一吸收液與復合吸收液對NOx脫除效率的影響Fig.4 Effect of single absorption liquid and compositeabsorption liquid on NOx denitrification efficiency
由圖4可知,Ca(OH)2+H2O2吸收液體系脫硝率遠遠高于其單組分吸收液。雙氧水濃度為0.80 mol/L 時,NO脫除率在40%~30%;氫氧化鈣濃度為0.03 mol/L時,NO脫除率在60%~80%;而雙組分吸收劑的NO脫除率維持在90%以上。主要是因為在雙組分吸收劑中Ca(OH)2的加入促進了雙氧水分解出大量的羥基自由基HO·,提高了NO的氧化率。
2.4 含氧量對Ca(OH)2+H2O2脫除NO的影響
O2濃度是影響NO脫除率的關鍵因素,雙組分吸收劑的濃度0.03 mol/L Ca(OH)2+0.80 mol/L H2O2,并且以體積比為1∶1配制于500 mL錐形瓶中,RPB轉速為900 r/min,考察不同含氧量對NO脫除的影響,結果見圖5。
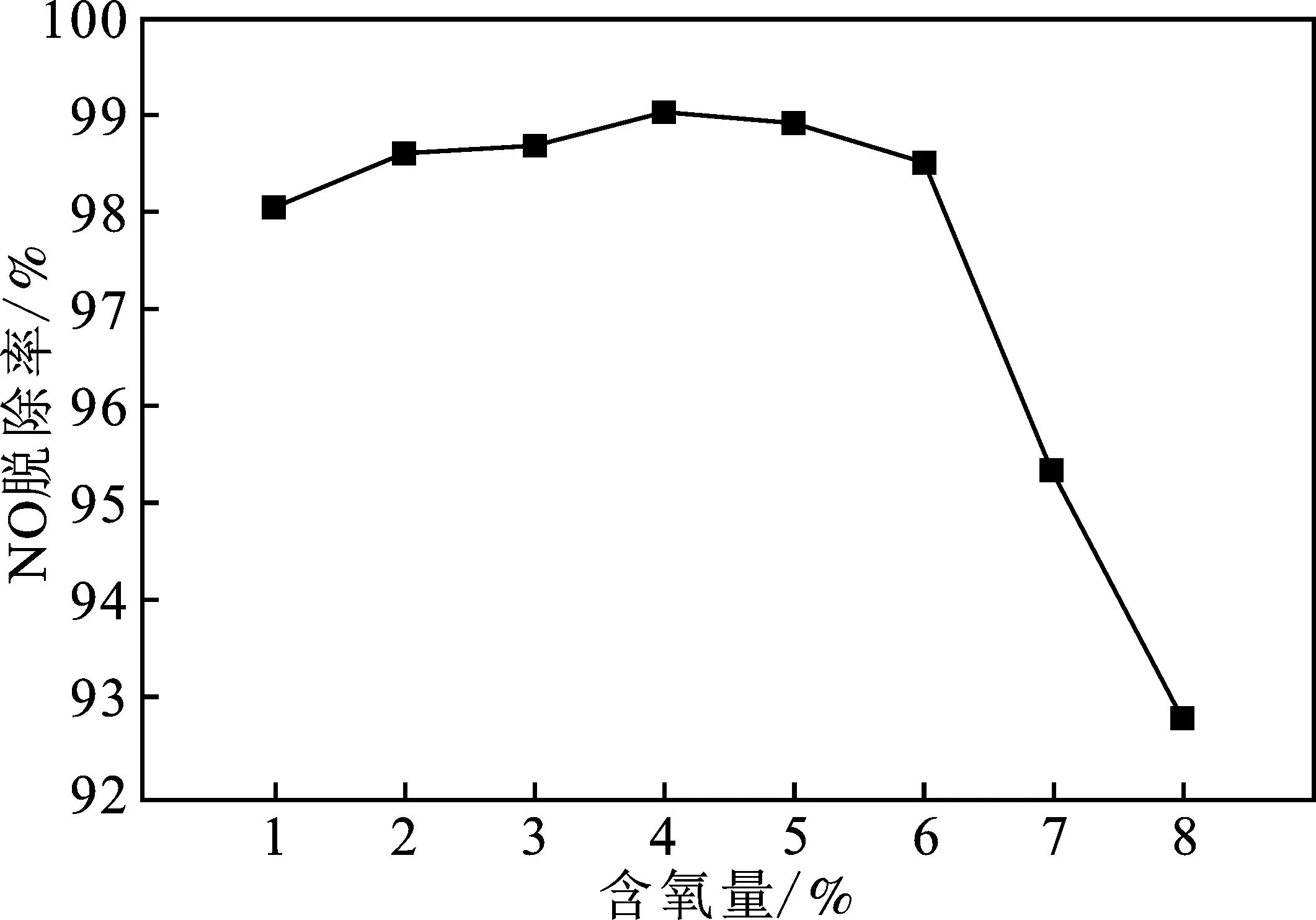
圖5 不同含氧量對NO脫除效率的影響Fig.5 Effect of different oxygen content on NO removal
2.5 氣液比對NO脫除效果的影響
雙組分吸收劑濃度0.03 mol/L Ca(OH)2+0.80 mol/L H2O2,并且以體積比為1∶1配制于 500 mL 錐形瓶中,RPB轉速為900 r/min,含氧量為4%,氣體流量0.3 L/min時,改變液體流量的值,考察氣液比對NO脫除效率的影響,結果見圖6。
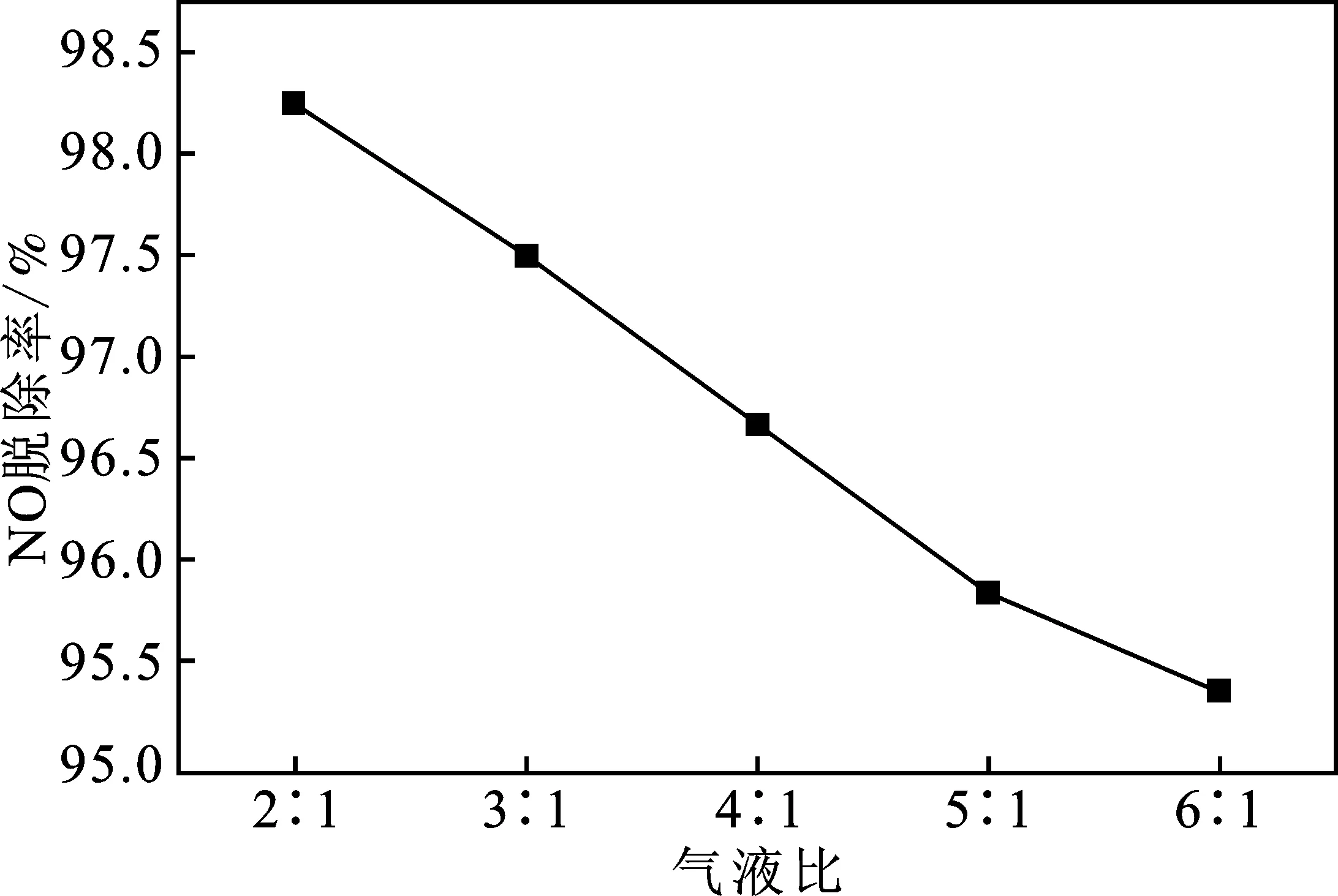
圖6 氣液比對NO脫除效率的影響Fig.6 Effect of gas-liquid ratio on NO removal
由圖6可知,氣液比為2∶1時,NO的脫除率最大,為98.25%,NO的整體脫除效率隨著氣液比的增大而降低,氣液比增大,進入RPB反應腔內的液體流速減慢,傳質表面更新速度降低,導致同等氣量下氣液的接觸減小,弱化了氣體與液體的傳質過程,降低了NO的脫除效率。
2.6 Ca(OH)2+H2O2脫除NO的穩定性探究
循環時間是考察復合吸收液穩定性的重要依據,O2體積分數4%,旋轉床轉速900 r/min,氣體流量0.3 L/min,液體流量0.15 L/min,考察Ca(OH)2+H2O2組合吸收液在不同反應時間點下NO的脫除效果,結果見圖7。
由圖7可知,本次實驗的雙組分吸收液的最佳活性時間范圍是0~70 min。反應開始進行時,脫除效果最佳,反應前70 min,NO脫除效率均能在90%以上,NO脫除率隨時間呈現下降趨勢,時間越長,趨勢越來越明顯。NO脫除效率降低的主要原因是Ca(OH)2+H2O2吸收液是漿液狀態,長時間反應,生成的鈣鹽隨時間積累,NO2的吸收受到抑制,并且鈣鹽也會附著在錐形瓶和硅膠管壁上,最終降低NO的脫除率。說明吸收液活性和穩定性并不是很理想,后期目標是能保證及時更換吸收液和設計自動清洗裝置,保證NO脫除率達到最佳狀態。
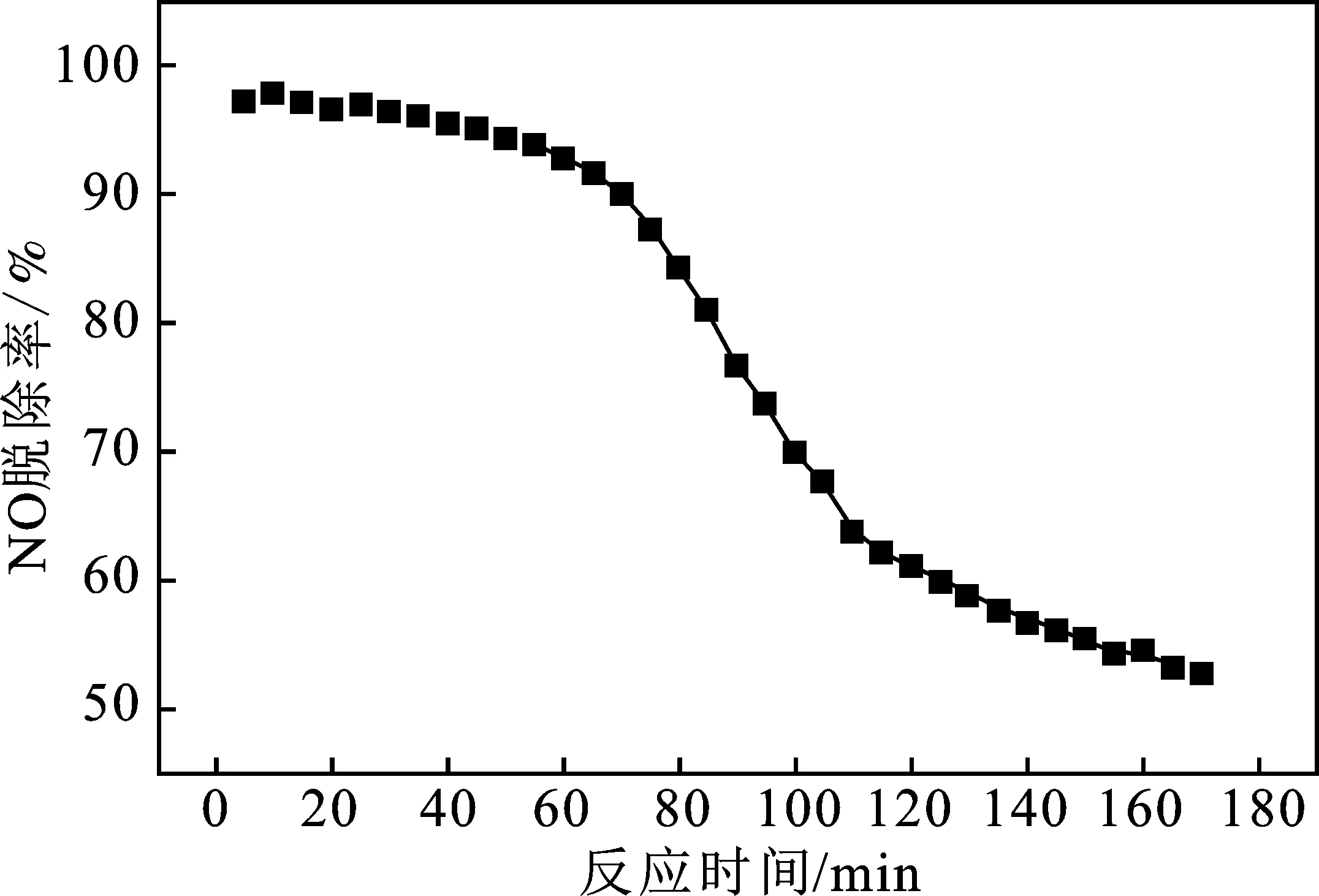
圖7 Ca(OH)2+H2O2的循環時間對NO脫除率的影響Fig.7 Effect of cycle time of Ca(OH)2+H2O2on NO denitration rate
本次使用的吸收劑成本低廉、綠色環保,鈣鹽可以進一步回收利用。H2O2廉價易得,反應產物無二次污染,屬于綠色強氧化劑。RPB在強化相間傳質以及微觀混合方面具有更加高效、穩定、低能耗等優點[14-15]。
2.7 Ca(OH)2+H2O2吸收液的pH值變化
采用pH計檢測每5 min下的吸收液的pH值,其值與吸收液循環時間的變化關系見圖8。
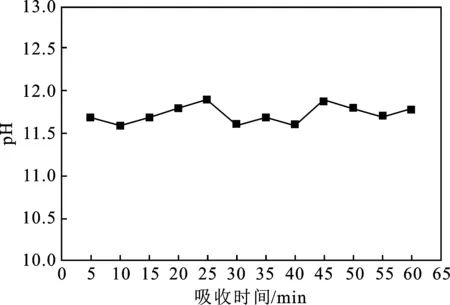
圖8 復合吸收液的pH值變化Fig.8 pH change of composite absorbent
由圖8可知,隨著吸收液循環時間的增加,60 min 內吸收體系Ca(OH)2+H2O2的pH值維持在11.00~12.00之間。主要是因為0.03 mol/L Ca(OH)2溶液本身就屬于堿性物質,反應前測量其pH為13.00,加入250 mL濃度0.80 mol/L H2O2時,溶液pH發生改變,因為雙氧水溶液略顯酸性。NO2等酸性氣體的吸收也可以使Ca(OH)2溶液的pH降低。
3 結論
(1)單組分吸收劑在氣體流量為0.30 L/min,液體流量為0.10 L/min,O2的體積分數為4%,旋轉填充床轉速為900 r/min的實驗條件下,H2O2溶液脫除NO最佳濃度為0.80 mol/L,脫除效率為36.00%;在相同的實驗條件下,Ca(OH)2溶液脫除NO最佳濃度為0.03 mol/L,脫除效率為78.00%。
(2)將0.80 mol/L H2O2溶液和0.03 mol/L Ca(OH)2溶液以體積比1∶1于500 mL的錐形瓶中混合均勻為雙組分吸收液,控制氣體流量、旋轉填充床轉速不變,NO脫除效率最佳時,含氧量為4%,氣液比為2∶1,采用超重力技術強化氣液兩相吸收,雙組分脫硝率均能達到90%以上,并維持一定的時間,吸收劑的pH維持在11~12之間。雙組分吸收液較單一吸收劑對于NO的有效脫除更具優勢。

