依托經典例題,突破離子反應難點
◇ 江蘇 李南俊
離子反應涉及的知識點多而零碎,是高中化學的重點知識,是高考的必考知識.實踐表明有些學生在解答離子反應試題時經常出現錯誤.因此,在教學過程中,教師應注重結合學生的易錯點,篩選、講解經典的例題,幫助學生突破離子反應難點,提高學生解題的正確率,為其化學學習成績的提升奠定堅實基礎.
1 離子方程式的判斷
判斷離子方程式書寫是否正確時應注重把握以下幾點:1)相關物質的書寫、狀態是否正確,包括是否需要拆分、拆分是否正確.2)化學反應是否正確,尤其應明確反應物是過量還是少量.3)準確掌握物質的氧化性、還原性強弱情況,正確判斷反應順序.
例1以下離子反應方程式正確的是( ).

分析SO2被Cl O-氧化成生成硫酸鈣沉淀,選項A錯誤.碳酸鈣難溶于水,書寫離子方程式時不拆開,選項B錯誤.I-的還原性強于Fe2+,1 mol Cl2剛好與2 mol I-完全反應,離子方程式應為2I-+Cl2=I2+2Cl-,選項C錯誤.根據所學可知選項D正確.
2 離子方程式的書寫
離子方程式的書寫是高考的重要考查方向.設計的問題一般較為新穎,考查學生的氧化還原反應、離子反應等知識掌握情況.解答該類試題時應認真審題,運用氧化還原反應價態規律,寫出正確的化學反應方程式,并進行正確地拆分.
例2將K2Mn O4轉化為K Mn O4的生產工藝有兩種:(1)傳統法.將CO2氣體通入K2Mn O4溶液中使體系成中性和弱堿性,K2Mn O4發生歧化反應生成的含錳物質有Mn O2、K Mn O4,則該反應的離子方程式為________.(2)電解法.電解K2Mn O4水溶液制取K Mn O4.則電解槽中總反應離子方程式為______.
分析根據氧化還原反應、電化學知識以及題干給出的已知條件,不難得出傳統法制取K Mn O4的離子方程式為.電解時Mn元素的化合價升高,H元素的化合價降低,生成H2,則反應的離子方程式為.
3 離子的檢驗與推斷
解答該類習題時,先根據反應物或生成物的特有現象,判斷相關的離子.然后運用離子共存知識排除一定不存在的離子種類.另外需要注意的是應進行全面考慮,尤其注重溶液呈現電中性這一隱含知識的應用.
例3某溶液由中的若干離子組成,取適量該溶液進行如圖1所示實驗,下列說法正確的是( ).
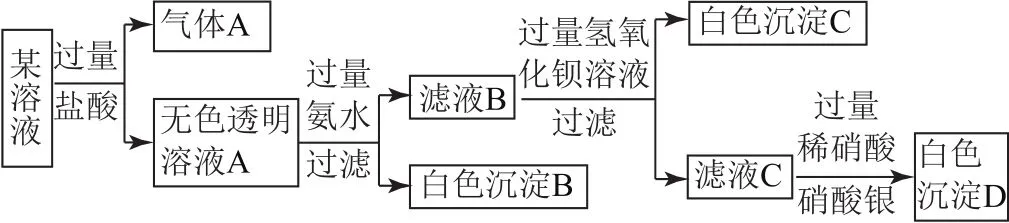
圖1
B.氣體A為CO2,電子式為
C.原溶液中一定不存在的離子是Cu2+、Ba2+、Fe3+
D.生成沉淀B的離子方程式為:Al3++3 OH-=Al(OH)3↓
分析原溶液中加入鹽酸產生氣體說明有,則Cu2+、Ba2+、Fe3+均不存在.溶液A加入過量氨水產生白色沉淀,表明原溶液中含有,沉淀B為Al(OH)3.濾液B中加入過量的氫氧化鋇產生白色沉淀,說明原溶液中含有.濾液C加入過量稀硝酸和硝酸銀產生白色沉淀,但最初加入了鹽酸,故不能判斷原溶液是否含有Cl-.由溶液呈現電中性可知應含有Na+.生成沉淀B的離子方程式為Al3++3 NH3·H2O=Al(OH)3↓+,故選項C正確.
高中化學離子反應教學中,應注重多與學生溝通交流,分析學生感覺“難”的原因,給予學生針對性的指導,同時,注重篩選學生出錯率較高的習題,在課堂上作為例題進行講解,引導學生把握解題的方法與技巧,徹底掌握離子反應中的難點知識.

